2. 南方医科大学第三附属医院,广东 广州 510631 ;
3. 新乡医学院第一附属医院,河南 新乡 453199
2. Third Affiliated Hospital of Southern Medical University, Guangzhou 510631, China ;
3. The First Affiliated Hospital Of Xinxiang Medical University, Xinxiang 453199 China
STOML-2 是stomatin 家族的新成员,具有stomatin 家族共有的一致序列,但不具有N 端跨膜区域,因此,STOML-2发挥功能的机制可能与其他成员不同[1-2]。STOML-2 定位于线粒体内膜,其在食管癌、肺癌、子宫内膜癌等多种肿瘤均高表达[3-4],但其在宫颈癌组织中表达量的高低文献报道不一[5-9]。我们实验室采用免疫组化、Real time-PCR以及Western blot检测宫颈癌组织中的表达情况,发现癌组织中STOML-2 的表达都比对应的癌旁组织高[8],但对其抑制宫颈癌细胞凋亡的机制尚未进行研究,且国内外均未见相关报道。本实验以人宫颈鳞癌Siha细胞为研究对象,以腺病毒为载体介导STOML-2 过表达,研究其对细胞增殖的影响以及抑制宫颈癌细胞凋亡的机制。
1 材料和方法 1.1 材料人宫颈鳞癌Siha细胞由南方医院肿瘤科实验室惠赠,RPMI 1640 培养基(Hyclone),四季青胎牛血清(杭州四季青生物制品公司),STOML-2腺病毒及空载体腺病毒(美国ViGene Biosciences),顺铂(江苏豪森药业),MTT(Sigma),Hoechst33258(武汉谷歌生物),兔抗人α-tubulin(enogene)、兔抗人caspase3 及cleaved-cas- pase3 抗体(CST)、兔抗人Cytochrome C、Bcl-2、Bax 抗体(abcam)、羊抗兔荧光二抗(LI-COR)。
1.2 方法 1.2.1 Siha细胞及其培养将Siha细胞常规培养于含体积分数为10%胎牛血清的RPMI 1640 培养基中,在37 ℃、饱和湿度及含5% CO2的培养箱中传代培养。
1.2.2 腺病毒感染Siha 细胞将Siha 细胞按照20 万/孔接种于6 孔板上,过夜细胞贴壁后换液,按MOI(multiplicity of infection)=50 将腺病毒加入完全培养基中感染细胞,72 h后提取全蛋白,采用Western blot检测STOML-2的表达。
1.2.3 MTT法检测STOML-2过表达后对细胞增殖的影响取对数生长期的Siha 细胞,将细胞按7000/孔接种于96 孔板上,每孔200 μL 完全培养基,设5 个复孔,按MOI=50 将腺病毒加入全培中感染细胞,72 h 后每孔加入20 μL浓度为5 mg/mL的MTT溶液,避光、37 ℃孵育4h,小心去掉孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪测定吸光值(X=490 nm),实验重复3次以上。
1.2.4 MTT法检测顺铂的IC50取对数生长期的Siha细胞,将细胞按7000 个/孔接种于96 孔板上,每孔200 μL 完全培养基,设5 个复孔,72 h 后换成顺铂终浓度为0、2.5、5、10、20、30、40、50、60 μg/mL 的完全培养基,继续培养24 h 后每孔加入20 μL 浓度为5 mg/mL 的MTT溶液,避光、37 ℃孵育4 h。小心去掉孔内培养液,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪测定吸光值(X=490 nm),抑制率(%)=(处理组-调零孔)(/ 对照组-调零孔)×100%,取其平均值。实验重复3次以上。
1.2.5 Hoechst 33258 染色观察细胞形态取对数生长期的Siha 细胞,将细胞按7000/孔接种于96 孔板上,每孔200 μL 完全培养基,设3 个复孔,按MOI=50 将腺病毒加入全培中感染细胞,48 h 后换成顺铂终浓度为15 μg/mL 的完全培养基,继续培养24 h 后,去上清,室温下用4%多聚甲醛固定液固定30 min,用PBS 洗涤3 次,每孔加入50 μL 的Hoechst33258 避光条件下染色15 min,再用PBS 洗涤3 次,在荧光显微镜下观察细胞核形态变化。
1.2.6 流式细胞仪检测细胞凋亡率取对数生长期的Siha 细胞按照20 万/孔接种于6 孔板上,过夜细胞贴壁后换液,按MOI=50 将腺病毒加入全培中感染细胞,72 h 后换成顺铂终浓度为15 μg/mL 的完全培养基,继续培养6 h 后,收集细胞,用AnnexinV-FITC 和PI 标记,用流式细胞仪检测,分析凋亡细胞的比例。
1.2.7 Western blot 分析取对数生长期的Siha 细胞按照100 万/皿接种于大皿,过夜细胞贴壁后换液,按MOI=50 将腺病毒加入全培中感染细胞,72 h 后换成顺铂终浓度为15 μg/mL的完全培养基,继续培养24 h后,按照全蛋白试剂盒和细胞线粒体分离试剂盒收集并裂解细胞,得到细胞全蛋白、线粒体蛋白及胞浆蛋白,用BCA 法对蛋白样品进行定量。取等量蛋白样品用12% SDS-PAGE 进行电泳,恒压将蛋白转至PVDF 膜。室温下将膜在含5%脱脂奶粉的TBST 溶液中封闭l h,按照适当的稀释度加入一抗,4 ℃孵育过夜,荧光二抗室温孵育1 h,应用Western bolt 检测系统测定caspase3、cleaved-caspase3、Bcl-2、Bax 以及线粒体内外Cyt C 的表达水平。
1.3 统计学处理采用SPSS20.0统计软件,实验数据以均数±标准差表示,组间比较采用单因素方差分析,P<0.05 认为差异具有统计学意义。
2 结果 2.1 腺病毒感染Siha细胞后STOML-2的表达Western bolt 结果如图 1 所示,用携带STOML-2 基因的腺病毒转染Siha 细胞72 h 后STOML-2 的表达明显增加,说明外源性的STOML-2 基因可以在Siha 细胞中过表达。

|
图 1 腺病毒感染Siha 细胞72 h 后STOML-2 的表达 Figure 1 Expression of STOML-2 after transfection in Siha cells. 1: Blank group; 2: Empty vector transfection group; 3: Overexpression group. |
MTT 结果显示,STOML-2 过表达后明显促进Siha 细胞的增殖,同空白组和空载体组相比,结果具有显著统计学差异(0.545 ± 0.080 vs 0.548 ± 0.010 vs 0.636 ±0.057,P<0.0001),而空白组与空载体组无统计学差异。
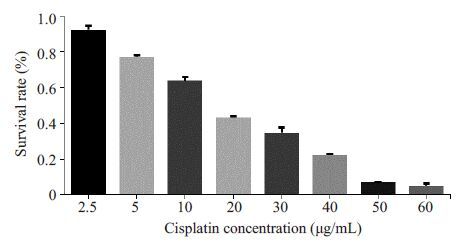
2.3 MTT法检测顺铂的IC50用不用浓度的顺铂处理Siha 细胞24 h 后,MTT 结果显示,随着顺铂浓度的增加,其对Siha 细胞的杀伤率越来越高(图 2),计算得IC50≈15 μg/mL。
|
图 2 不同浓度的顺铂对Siha 细胞的杀伤作用 Figure 2 Changes in the viability of Siha cells after treat- ment with cisplatin. |
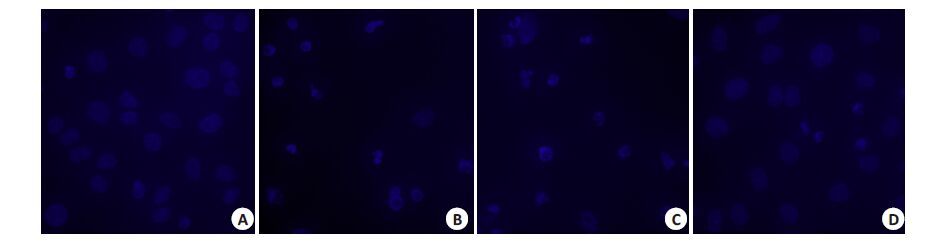
细胞发生凋亡时往往出现细胞核形态的改变。用终浓度为15 μg/mL 的顺铂处理Siha 细胞24 h 后,其Hoechst33258染色结果如图 3所示,空白组和空载体组细胞表现为凋亡细胞的细胞核大小不一,浓染致密的蓝色荧光显示核固缩,部分核裂解为凋亡小体,而过表达组细胞核多较完整,着色较浅,染色质密度均匀一致,说明经同浓度的顺铂处理后STOML-2 过表达组细胞凋亡减少。
|
图 3 荧光显微镜下观察STOML-2 过表达后对Siha 细胞形态的影响 Figure 3 Fluorescence microscope of morphological changes of Siha cells after Cisplatin exposure (Original magnification: ×400).A: Blank group; B: Blank group+Cisplatin; C: Empty vector transfection group+Cisplatin; D: Everexpression group+Cisplatin. |
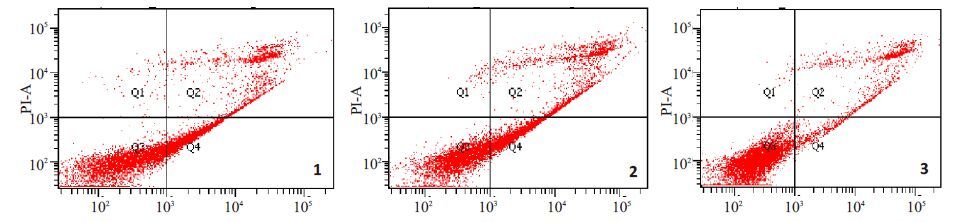
用终浓度为15 μg/mL 的顺铂作用于Siha 细胞6 h后,收集细胞,采用AnnexinV-FITC/PI 双染,上机检测细胞凋亡。结果如图 4 所示,与空白组及空载体组相比,过表达组早期凋亡率明显减少且具有统计学差异(36.30±5.72 vs 39.77±7.34 vs 9.10±5.16,P<0.01),且总凋亡率也明显减少且具有统计学差异(51.40±4.80 vs 61.53±7.17 vs 20.30±9.96,P<0.01),空白组与空载体组相比早期凋亡率及总凋亡率均无统计学差异。
|
图 4 Annexin V-FITC/PI 双染流式细胞分析 Figure 4 Flow cytometry analysis for Annexin V-FITC/PI staining. 1: Blank group + Cisplatin; 2: Empty vector transfection group + Cisplatin; 3: Overexpression group+Cisplatin. |
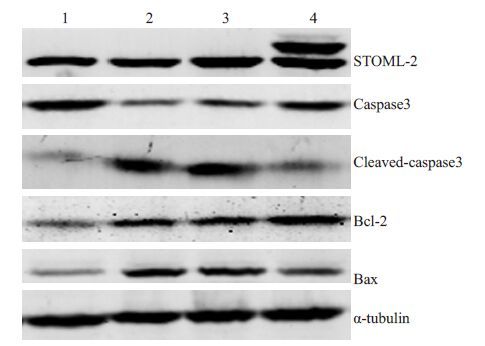
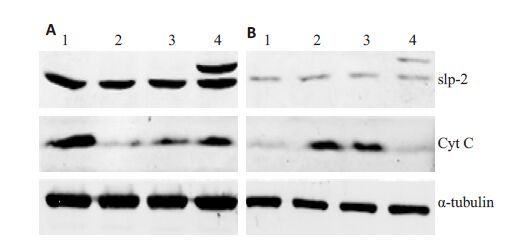
如图 5,6 所示,经顺铂作用24 h 后,与空白组和空载体组相比,过表达组与凋亡直接相关的cleaved-cas- pase3、线粒体外Cyt C及Bax的表达水平降低,而对应的caspase-3、线粒体内Cyt C及Bcl-2的表达水平则升高。
|
图 5 Western blot 检测凋亡相关蛋白的表达 Figure 5 The expression of apoptosis-related proteins in Siha cells detected by Western blot. 1: Blank groupl 2: Blank group + Cisplatin; 3: Empty vector transfection group + Cisplatin; 4: Overexpression group+Cisplatin. |
|
图 6 Western blot 检测线粒体内外细胞色素C 的表达 Figure 6 Levels of Cyt-C releas from mitochondria to cytosol in Siha cells detected by Western blotting. 1:Blank group; 2: Blank group + Cisplatin; 3: Empty vector transfection group + Cisplatinl 4: Overexpression group + Cisplatin. A: Mitochondria; B: Cytosol. |
STOML-2在食管癌、肺癌、子宫内膜癌及宫颈癌等多种恶性肿瘤广泛高表达[3-4],说明了其在恶性肿瘤的发生、发展中起着重要作用。我们使用腺病毒感染宫颈鳞癌Siha 细胞后MTT 结果提示STOML-2 过表达可以进Siha 细胞的增殖。用顺铂诱导各组细胞凋亡后用Annexin V 法检测显示过表达组早期凋亡率及总凋亡率均明显低于对照组,而我们以前用HeLa、HCC94 细胞株沉默STOML-2 后早期凋亡率及总凋亡率均明显高于对照组,说明STOML-2 在宫颈鳞癌细胞中起着抑制凋亡的作用,而STOML-2抑制肿瘤细胞凋亡的机制,国内外均未见相关报道。
Rezaul 等[10]研究发现STOML-2 存在于线粒体内。随后,两个独立的研究小组[11-12]进一步报道STOML-2 定位于线粒体内膜,本实验通过提取线粒体内外蛋白采用Western blot 也同时证实了STOML-2 主要存在于线粒体内。在哺乳类动物的细胞中线粒体通路是凋亡发生时的主要信号通路,在发生细胞外应激和细胞内损伤如DNA损伤时启动[13]。当细胞受到细胞内外的凋亡诱因刺激启动线粒体凋亡途径时,Bcl-2/Bax 介导的线粒体外膜通透(MOMP)使线粒体内一些可溶性的蛋白如Cyt C 从线粒体内膜释放至细胞质内。Cyt C 结合至单体的凋亡蛋白酶激活因子Apaf-1,进而使得Apaf-1 的空间构象发生改变并聚合为多聚体结构。Caspase-9前体与Apaf-1 多聚体结合形成凋亡体,凋亡体的形成能激活Caspase-9,通过Caspase-9 介导的蛋白裂解作用,最终激活了Caspase-3,诱导细胞凋亡的发生。
本实验进一步用顺铂处理STOML-2 过表达的Siha细胞后检测线粒体凋亡途径相关蛋白的变化,结果显示STOML-2 过表达后Bax/Bcl-2 的比率降低,从线粒体释放到胞浆中的细胞色素C 减少,使cleaved-cas- pase3也减少,说明STOML-2过表达可以抑制肿瘤细胞的凋亡,并且其抑制细胞凋亡的机制可能是通过线粒体凋亡途径进行。
综上所述,STOML-2 过表达可以促进Siha 细胞的增殖,STOML-2可能通过线粒体凋亡途径抑制肿瘤细胞的凋亡,更为完整的机制有待进一步实验证实。
| [1] | Owczarek CM, Treutlein HR, Portbury KJ, et al. A novel member of the STOMATIN/EPB72/mec-2 family, stomatin-like 2 (STOML2), is ubiquitously expressed and localizes to HSA chromosome 9p13.1[J]. Cytogenet Cell Genet,2001, 92 (3/4) : 196-203. |
| [2] | Dunphy JT, Linder ME. Signalling functions of protein palmito- ylation[J]. Biochim Biophys Acta,1998, 1436 (1/2) : 245-61. |
| [3] | Zhang L, Ding F, Cao W, et al. Stomatin-like protein 2 is overexpressed in Cancer and involved in regulating cell growth and cell adhesion in human esophageal squamous cell carcinoma[J]. Clin Cancer Res,2006, 12 (5) : 1639-46. DOI: 10.1158/1078-0432.CCR-05-1858. |
| [4] | Cao W, Zhang B, Liu Y, et al. High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast Cancer patient survival[J]. Am J Clin Pathol,2007, 128 (3) : 430-6. DOI: 10.1309/C6X54HRB580EP2NQ. |
| [5] | 吴郁. SLP-2 基因在宫颈鳞癌组织中的表达及其功能的初步研究[D]. 北京: 中国协和医科大学, 2006. |
| [6] | 郑烨. 组织芯片法检测新基因SLP-2在宫颈癌组织中的表达及意义[D]. 青岛: 青岛大学, 2008. |
| [7] | 刘雪梅, 马琳. SLP-2在宫颈腺癌中的表达及其临床意义[J]. 职业与健康,2011, 27 (10) : 1195-7. |
| [8] | 邓欢. STOML-2在宫颈癌中的表达及其功能研究[D]. 广州: 南方医科大学, 2012. |
| [9] | 杨晓, 刘玉玲, 胡晓军, 等. MTA1和SLP-2蛋白在宫颈鳞癌中的表达及相关性[J]. 中国妇幼保健,2013, 28 (11) : 1800-2. |
| [10] | Rezaul K, Wu L, Mayya V, et al. A systematic characterization of mitochondrial proteome from human T leukemia cells[J]. Mol Cell Proteomics,2005, 4 (2) : 169-81. |
| [11] | Hájek P, Chomyn A, Attardi G. Identification of a novel mito- chondrial complex containing mitofusin 2 and stomatin-like protein 2[J]. J Biol Chem,2007, 282 (8) : 5670-81. DOI: 10.1074/jbc.M608168200. |
| [12] | Da Cruz S, Parone PA, Gonzalo P, et al. SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability[J]. Biochim Biophys Acta,2008, 1783 (5) : 904-11. DOI: 10.1016/j.bbamcr.2008.02.006. |
| [13] | Hengartner MO. The biochemistry of apoptosis[J]. Nature,2000, 407 (6805) : 770-6. DOI: 10.1038/35037710. |
 2015, Vol. 35
2015, Vol. 35
