2. 重庆医科大学基础医学院法医学教研室,重庆 400016
2. Department of Forensic Medicine, College of Basic Medicine, Chongqing Medical University, Chongqing 400016, China
脑白质损伤(WMD)是引起早产儿神经系统发育受阻及未成熟脑组织损伤最常见的原因,其主要表现为成熟少突胶质细胞减少、髓鞘形成受阻及神经发育障碍等[1]。围生期感染、缺血/缺氧是引起WMD 主要原因[2]。近年来,氧疗被广泛用于新生儿复苏及肺部疾病的治疗。临床证据显示常压高浓度氧暴露是远期认知功能缺陷和神经系统转归不良的重要因素之一[3],但其发生机制尚未阐明。Notch 是一种高度保守信号通路,在多种组织器官早期发育和修复过程中对发育细胞的分化、增殖和凋亡起着决定作用[4]。Notch 受体激活可介导炎症因子释放、阻碍少突胶质细胞成熟,参与脑白质损伤过程[5]。目前尚未Notch信号在新生期高氧脑白质损伤中作用实验研究报道,本研究拟通过对新生3 天(P3)小鼠80%高浓度氧暴露48 h,建立新生期高氧暴露脑白质损伤模型。本研究应用γ-分泌酶特异性阻断剂DAPT,探讨Notch 信号通路在新生鼠高氧暴露致脑白质损伤中的作用。
1 材料和方法 1.1 材料SPF 级健康C57BL/10J 新生3 d 小鼠64 只,购自重庆医科大学实验动物中心[SCXK(渝) 2012-0001]。DAPT(GSI-IX)(Selleck,美国),SYBR Green(碧云天生物技术研究所,中国),引物合成(Invitrogen,美国),TRIzol 试剂(Invitrogen,美国),MBP(ab62631)小鼠单克隆抗体(abcam,美国),NG2 兔抗小鼠多克隆抗体(Millipore 公司,美国),FITC 标记山羊抗小鼠二抗(碧云天生物技术研究所,中国),Alex Fluor555 山羊抗兔二抗(碧云天生物技术研究所,中国),自制塑料氧箱(25 cm×15 cm×15 cm),氧含量测氧仪MB-20(青岛明博环保有限公司,中国),荧光显微镜及图像采集系统(Olympus 公司,日本),Morris 水迷宫实验装置及分析系统(硕林苑科技有限公司,北京)。
1.2 方法 1.2.1 动物高氧模型制备及分组新生3 d 的C57BL/10J 野生小鼠64 只,随机分为空气对照组(C)、空气+ DAPT组(C+DAPT)、高氧组(H)、DAPT预处理后高氧暴露组(H+DAPT);每组16 只小鼠,C+DAPT 组和H+ DAPT 组于高氧暴露前1 h 通过单次腹腔注射γ-分泌酶抑制剂DAPT(10 mg/kg)(溶于1%二甲基亚砜),而C组和H组以同样的方法注入等量1%二甲基亚砜。将H组和H+DAPT 组的小鼠和母鼠一起置于高氧箱中,放入数字测氧仪,通入100%的氧气2.5 L/min,,并用数字测氧仪持续监测氧箱内氧及二氧化碳浓度,始终保持氧箱内氧浓度≥80%,CO2 浓度≤5%(用钠石灰吸收CO2);C 组及C+DAPT 组与各自哺乳母鼠置同室空气中饲养。将H 组和H+DAPT 组哺乳母鼠在通氧24 h 后与C 组和C+DAPT组哺乳母鼠交换,以避免哺乳母鼠因氧中毒导致喂养能力下降。各组环境温度均控制在21~25 ℃,湿度60%~70%,维持12 h 日照/夜间循环。高氧暴露48 h后停止通氧,取出置于空气中喂养至生后第5 d和12 d,C 组、C+DAPT 组在空气中常规饲养。各组分别在第5 天处死4 只,用于检测脑白质区NICD mRNA 表达;第12 天分别处死4 只,用于脑白质区免疫荧光检测;各组余下8只重置空气中饲养至第28天,行Morris水迷宫实验。
1.2.2 检测新生鼠脑质量、体质量的变化将各组新生鼠在不同的时间点(3、5、12及28 d)取出,使用电子天平(型号DENVER)秤各组小鼠体质量;乙醚麻醉后迅速取出脑组织,除去血液,滤纸拭干,称重,即为脑质量。
1.2.3 实时荧光定量PCR 检测脑组织NICD 表达将各处理的组脑组织匀浆按Trizol 法抽提总RNA,测定RNA 浓度和纯度,逆转录合成cDNA。然后PCR 扩增引物序列(表 1)。PCR 反应体系10 μL:cDNA 模版1 μL,上下游引物各0.25 μL,SYBR溶液4.5 μL,超纯水4μL。反应条件:95 ℃预变性3 min;95 ℃ 10 s,60 ℃30 s,40 个循环;72 ℃延伸5 min。测定目的基因、校对基因和β-actin的PCR产物的Ct值,NICD的相对表达量采用2-△△ct法计算。
| 表 1 引物序列表 Table 1 Primer sequence |
各组动物乙醚麻醉后,4%多聚甲醛经左心室灌注固定后,取材于4%多聚甲醛固定12~16 h,依次置入梯度蔗糖溶液(20%、30%)脱水,过夜直至沉底,包埋,制成5 μm 冰冻切片,选取脑白质区作免疫荧光染色。选取的冰冻切片逐级至水化,一抗[小鼠单抗MBP(1∶500);兔抗小鼠NG2(1∶200)],阴性对照以0.01 M PBS 代替一抗,4 ℃ 孵育过夜。次日室温复温1 h,加稀释的二抗[FITC 山羊抗小鼠绿光(1∶200);Alex Fluor555 山羊抗兔红光(1∶200)] 37 ℃孵育1 h,DAPI 室温孵育15 min,加抗荧光淬灭剂,封片,荧光显微镜下观察并拍照。MBP(绿色荧光)提示成熟少突胶质细胞细胞,NG2(红色荧光)显示少突胶质前体细胞,DAP(I 蓝色荧光)显示细胞核。
1.2.5 Morris 水迷宫实验各组28 d 小鼠参照文献[6]的方法行Morris 水迷宫实验。Morris 水迷宫选用小鼠通用型,圆形恒温水池,直径100 cm,高50 cm,水深25 cm,水温控制在22~24 ℃,水中加入牛奶,使其呈黑色不透明状。在水池壁的边沿均匀分布4个不同形状的标记,将水池等分为1、2、3 及4 个象限,选第3 象限正中放置高度为23 cm,直径8 cm的平台,没入水下2 cm,迷宫外参照物保持固定。实验分为两部分。
定位航行实验:将C57BL/10J 小鼠按顺时针方向依次由第1、2、3、4象限入水点顺序放入水中。记录2 min 内寻找平台的时间(逃避潜伏期)和其寻找平台所行游动的距离。如果小鼠在2 min内找到平台,记录2 min内实际逃避潜伏期和游动距离;如果在2 min 内未找到平台,由实验者将其引上平台并停留20 s,逃避潜伏期则记录为2 min。所有实验小鼠连续训练5 d。
空间探索实验:定位航行实验全部结束后24 h,撤去平台,仍将小鼠由不同象限放入池中自由游泳2 min,计算其跨越虚拟平台位置的次数,及小鼠在目标象限(第三象限)停留时间。
1.3 统计学分析采用SPSS19.0统计学软件分析,数据以均数±标准差表示;定位航行实验和空间探索实验数据使用重复测量方差分析;其余数据组间两两比较采用单因素方差分析,LSD检验;P<0.05表示差异有统计学意义。
2 结果 2.1 高氧暴露对新生鼠脑质量、体质量的影响正常新生鼠(C 组)脑质量、体质量随日龄的增加而迅速增长。高氧暴露组(H 组)5、12、28 d 新生鼠体质量明显减轻,与同日龄C组新生鼠比较差异有统计学意义(P<0.05);而使用DAPT 干预后5、12、28 d 新生鼠脑质量、体质量较H组明显增加(P<0.05,表 2、3)。
| 表 2 新生小鼠高氧暴露后在不同时间点脑质量的变化 Table 2 Changes of brain weight in each group at different time points (Mean±SD,n=10) |
| 表 3 新生小鼠高氧暴露后在不同时间点体质量的变化 Table 3 Changes of body weight in each group at different time points (Mean±SD,n=10) |
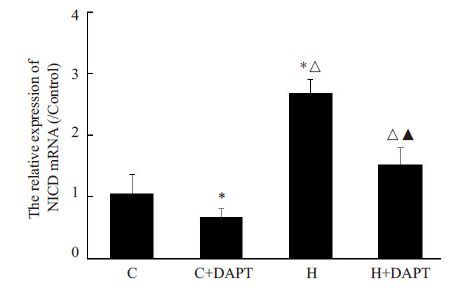
与空气对照组(C 组)相比,高氧暴露后可引起NICD mRNA 表达量明显增加,且差异有统计学意义(P<0.05);给予DAPT 预处理的高氧组(H+DAPT 组)NICD mRNA 表达量较高氧组(H 组)显著降低(P< 0.05,图 1)。
|
图 1 小鼠P5脑内NICD mRNA表达量的变化 Figure 1 NICD mRNA expression in the immature brain in each group. *P<0.05,vs C group; △P<0.05,vs C+DAPT group; ▲P<0.05,vs H group. |
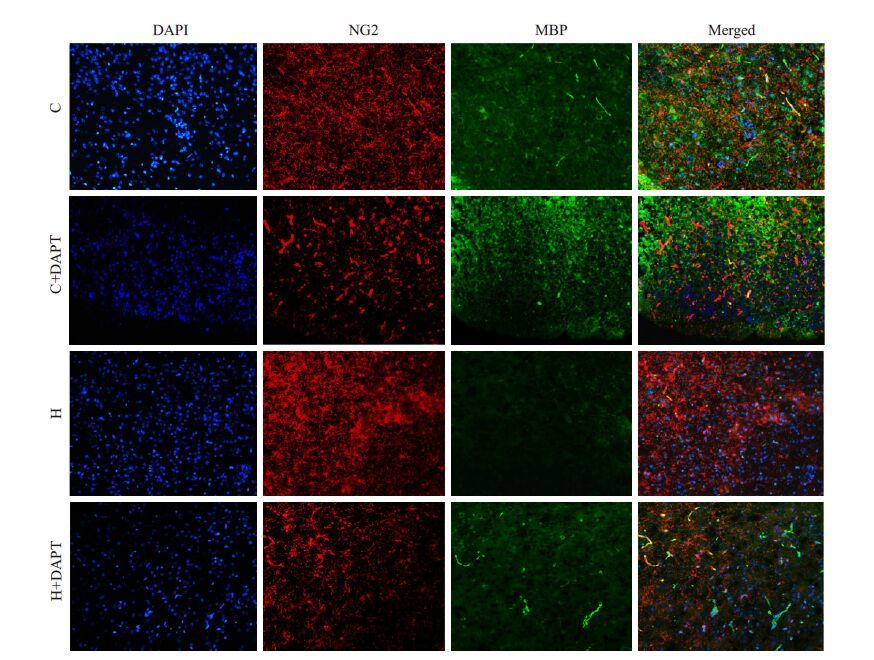
免疫荧光标记绿色荧光标记MBP 细胞,红色荧光标记NG2 细胞,蓝色显示细胞核。与C 组比较,高氧暴露后NG2 表达明显增多,MBP 表达明显降低;DAPT 预处理的高氧组与H组比较NG2 表达显著降低,MBP 表达增多(图 2)。
|
图 2 小鼠P12脑白质区NG2和MBP免疫荧光观察 Figure 2 Expression of NG2 and MBP in immature brain of the mice in the 4 groups on postnatal day 12 (Immunofluorescence staining,original magnification: ×200). |
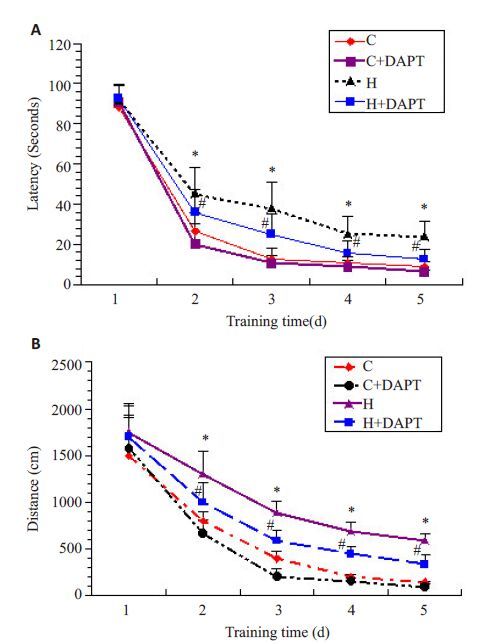
各实验组逃避潜伏期及游动距离均随时间延长呈逐渐下降趋势(P<0.05),说明通过训练能有效缩短其搜寻平台的时间和游动距离。从训练第2 天开始,H 组的逃避潜伏期和游动距离均较C 组延长(P<0.05);与H 组比较,H+DAPT 组的逃避潜伏期和游动距离明显缩短(P<0.05,图 3A、B)。
|
图 3 各组新生小鼠高氧暴露后定位航行能力的比较 Figure 3 Comparison of navigation ability of the mice in each group after treatments. *P<0.05 vs control (C) group; #P<0.05 vs hyperoxia (H) group. A: Escape latency; B: Swimming distance. |
与C 组比较,H 组小鼠找到平台次数和在目标象限停留时间减少,结果有统计学意义(P<0.05);经DAPT 预处理高氧暴露后(H+DAPT组),小鼠穿越平台次数和在目标象限停留时间较H组明显增多(P<0.05,表 4)。
| 表 4 各组新生小鼠高氧暴露后空间搜索能力比较 Table 4 Comparison of spatial search ability of the newborn mice after different treatments ( n=8,Mean±SD) |
新生儿(特别是早产儿)脑血流自主调节机制并不完善,易受多种病理生理因素影响,从而引起脑血流动力学变化,成为缺氧缺血性脑病等脑损伤的病理基础,是导致新生儿死亡和儿童期中枢神经系统后遗症的重要原因[7]。而早期给予常压高浓度氧疗可有效改善患者缺氧状态、减轻器官损害,提高生存质量。但近年一些临床研究表明[8],暴露在高浓度氧气中病人院内死亡率明显增高,部分患者表现为迟发型认知、学习记忆功能障碍。高氧早期暴露可致成熟依赖性的少突胶质细胞成熟障碍,髓鞘形成异常,病理过程可能与脑白质损害有关[9]。目前尚未完全阐明引起上述脑白质损害的具体机制。Notch 在多个物种中广泛表达,其家族成员结构具有高度保守性,在细胞分化、发育及成熟中起着关键作用[10]。因此,探讨Notch 信号通路对阐明高氧致脑白质损伤的细胞分子机制具有重要意义。
Notch 信号是脊椎动物和无脊椎动物发育过程中一类十分重要的信号受体蛋白家族,Notch 受体激活后主要通过释放胞内段NICD,NICD 转移至细胞核激活靶基因(如Hes)发挥生物学效应[10]。γ-分泌酶是NICD 释放过程中的关键酶,有研究证实DAPT 可以作为γ-分泌酶抑制剂阻断Notch 信号通路。新生3 d 小鼠脑组织成熟度相当于人体孕23~32周脑成熟度,此时的脑组织内细胞分化、发育达最高峰[11]。本研究通过对P3 的C57BL/10J 小鼠腹腔注射DAPT 后1h 内给予高氧持续暴露48 h,以获得早产儿高氧暴露模型。实验结果发现,DAPT预处理后,可以明显下调NICD基因在高氧暴露中的表达。同时,新生鼠高氧早期暴露后脑质量和体质量较正常组明显下降,但给予DAPT 预处理后,这种差异明显好转,即体质量和脑质量明显增加。脑质量的减轻从一个侧面反映出高氧对脑发育的影响,体质量的减轻表明高氧可能影响新生儿营养的供给。上述表明DAPT抑制Notch信号可能对高氧暴露引起的脑损伤具有保护作用,Notch 信号可能参与了高氧暴露引起的未成熟脑损伤。
Notch 受体表达于少突胶质细胞前体细胞(OPCs)表面,可以阻断哺乳动物中枢神经系统发育过程中少突胶质细胞(OL)的分化成熟和髓鞘碱性蛋白(MBP)的形成[11-12];选择性的敲除OPCs表面的Notch受体会引起未成熟OL 的分化,也就是说Notch 信号对OPCs 分化为OL 具有抑制作用。本研究结果发现3 d 新生鼠高氧暴露后,12 d 可发现新生鼠未成熟脑内NG2 细胞表达增多,MBP 表达减少,提示高氧暴露后脑白质区的OL 减少,OPCs增多;并且DAPT预处理减少了高氧暴露引起的OPCs增加和OL减少。
脑白质作为脑实质的重要组成部分,主要由少突胶质细胞、星形胶质细胞和髓鞘-轴突组成。作为髓鞘形成的关键细胞—少突胶质细胞,其成熟关系脑白质的发育;而NG2 细胞作为少突胶质细胞前体细胞,其分化方向能直接影响少突胶质细胞成熟[12]。MBP 是脑中成熟少突胶质细胞的特异性的标志物,其表达量可直接作为判断脑白质损伤程度的指标。少突胶质细胞和脑白质发育异常共同造成了WMD 最直接的表现,即CNS 低髓鞘化[9, 11]。WMD 是存活早产儿中最常见的神经系统发育异常,会引起早产儿明显的运动和/或认知功能缺陷。
Morris水迷宫是神经生物学研究动物空间学习、记忆功能常用的检测方法,能够较准确地反映实验动物以视觉为基础的空间学习、记忆、定向及定位能力的变化[13-14]。实验中,第28 天小鼠在前5 d 进行游泳定位航行训练,学会了找到固定位置隐蔽的平台,并且记录每一次找到平台的时间和路程轨迹,从而可以检验点燃大鼠的学习能力;6 d撤去了平台,检测大鼠在原平台位置所在象限停留时间,从而可以检验点燃大鼠的记忆能力。结果发现,高氧暴露48 h后C57BL/10J小鼠出现远期学习记忆障碍;而采用DAPT 预处理后,高氧暴露后的小鼠定位航行逃避时间、游行距离明显缩短及空间搜索实验目标象限停留时间和穿越平台次数明显增加。提示Notch 信号参与了高氧暴露致未成熟脑白质损伤,且下调高氧暴露后Notch 信号通路可增加对脑白质中的成熟少突胶质细胞数量,降低新生期高氧暴露致远期学习记忆能力的损害。
综上所述,早期高氧暴露可致未成熟脑白质损伤,主要表现为少突胶质细胞分化障碍,具体机制可能是高氧引起脑内Notch 信号激活,阻碍了少突胶质细胞的成熟,延缓脑白质发育,对远期学习记忆能力造成损害;而DAPT可以通过抑制Notch信号通路而改善高氧导致的组织化学改变和神经行为学变化。
| [1] | Ritter J, Schmitz T, Chew LJ, et al. Neonatal hyperoxia exposure disrupts axon-oligodendrocyte integrity in the subcortical white matter[J]. J Neurosci,2013, 33 (21) : 8990-9002. DOI: 10.1523/JNEUROSCI.5528-12.2013. |
| [2] | Schmitz T, Ritter J, Mueller S, et al. Cellular changes underlying hyperoxia-induced delay of white matter development[J]. J Neurosci,2011, 31 (11) : 4327-44. DOI: 10.1523/JNEUROSCI.3942-10.2011. |
| [3] | Muthuraju S, Pati S, Rafiqul M, et al. Effect of normabaric hyperoxia treatment on neuronal damage following fluid percussion injury in the striatum of mice: a morphological approach[J]. J Biosci,2013, 38 (1) : 93-103. DOI: 10.1007/s12038-012-9290-7. |
| [4] | Artavanis-Tsakonas S, Rand MD, Lake RJ. Notch signaling: cell fate control and signal integration in development[J]. Science,1999, 284 (5415) : 770-6. DOI: 10.1126/science.284.5415.770. |
| [5] | Wang S, Sdrulla AD, Disibio G, et al. Notch receptor activation inhibits oligodendrocyte differentiation[J]. Neuron,1998, 21 (1) : 63-75. DOI: 10.1016/S0896-6273(00)80515-2. |
| [6] | 乔智慧, 黄秀兰, 蔡娜莉, 等. 抵抗素及IL-1β在新生大鼠缺氧缺血性脑损伤中的表达及其意义[J]. 免疫学杂志,2010, 12 (12) : 1104-6. |
| [7] | 李敏许, 梁倩玉, 张兰. 不同机械通气方式对新生儿脑血流的影响及临床意义[J]. 中国妇幼保健,2011, 26 (9) : 1333-5. |
| [8] | Collins MP, Lorenz JM, Jetton JR, et al. Hypocapnia and other ventilation-related risk factors for cerebral palsy in low birth weight infants[J]. Pediatr Res,2001, 50 (6) : 712-9. DOI: 10.1203/00006450-200112000-00014. |
| [9] | Brehmer F, Bendix I, Prager S, et al. Interaction of inflammation and hyperoxia in a rat model of neonatal white matter damage[J]. PLoS One,2012, 7 (11) : e49023. DOI: 10.1371/journal.pone.0049023. |
| [10] | 鲁茁壮, 王立生, 吴祖泽. Notch信号通路研究进展[J]. 生理科学进展,2004, 4 (2) : 135-8. |
| [11] | Back SA, Luo NL, Borenstein NS, et al. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury[J]. J Neurosci,2001, 21 (4) : 1302-12. |
| [12] | Maki T, Liang AC, Miyamoto N, et al. Mechanisms of oligo- dendrocyte regeneration from ventricular-subventricular zone- derived progenitor cells in white matter diseases[J]. Front Cell Neurosci,2013, 7 (275) : 275. |
| [13] | Gekas J, Walther G, Skuk D, et al. In vitro and in vivo study of human amniotic fluid-derived stem cell differentiation into myogenic lineage[J]. Clin Exp Med,2010, 10 (1) : 1-6. DOI: 10.1007/s10238-009-0060-2. |
| [14] | 宋炜, 蔡鹏, 杜雷, 等. 丙泊酚对癫痫大鼠学习记忆及海马TLR4表达的影响[J]. 中国药理学通报,2014, 30 (12) : 1725-9. |
 2015, Vol. 35
2015, Vol. 35
