2. 美国德州 A&M 大学生命科学院;美国 德州休斯顿 77030 ;
3. 南方医科大学南方医院妇产科,广东 广州 510515
2. Texas A&M University Health Science Center, Institute of Biosciences and Technology, Houston, Texas 77030, USA ;
3. Department of Obstetrics and Gynecology, Nanfang Hospital, Guangzhou 510515,China
心肌肥大是指心肌细胞增大而无细胞分裂,是心肌细胞对高血压、心脏瓣膜病、心肌梗死及先天性心脏病等多种疾病产生的适应性代偿。最新研究表明,小RNA 作为重要的调控元件与心肌肥大具有密切的联系。研究表明,越来越多的mirRNA 如:mir-208、mir-1、mir-195、mir-133等被发现在心肌细胞的生长、维持心血管系统的完整、调控基因表达和保持心脏运动节律等方面具有重要的调节功能,在临床疾病方面,mir-133 与心肌肥大存在密切联系[1-3]。本研究构建了microRNA-133a 腺病毒表达载体,以体外分离培养大鼠心肌细胞为研究对象,利用苯肾上腺素(PE)诱导法建立心肌肥大的体外细胞研究模型,研究miroRNA-133a 在心肌肥大中的作用机制,为临床诊疗提供新的途径。
1 材料和方法 1.1 材料 1.1.1 试剂DMEM 培养液、Opti-MEM I Reduced Serum Medium、Lipofectamine 2000 Reagent、新生牛血清购自美国GIBCO(Invitrogene),Adeno-XTM ViraKTM Expression system 2 购自Clontech Laboratories,inc。TaqMan miR-assay 试剂盒购自Applied Biosystems (catalog no 4373142)。
1.1.2 实验动物新生0~3 d的SD大鼠,雌雄不限,购自美国Charles river。
1.2 方法 1.2.1 质粒的构建与腺病毒的合成为了心肌细胞持续表达miR-133a,我们使用Adeno-X-virTrak Expression system2 构建miR-133a 的腺病毒质粒。首先将miR- 133a precursor cDNA 序列导入donor 质粒pDNA- CMV,然后利用cre-loxp介导的同源重组系统将该段序列导入一个包含红色荧光蛋白的腺病毒载体中,并利用pacI 线性化质粒并转染293 细胞,而对照组为仅表达红色荧光蛋白的质粒。7~10 d后收获转染细胞,通过快速反复冻融法收获病毒。最终病毒的浓度为1.14×107 和2.0×107 plaque-forming unit/mL。为了确定感染细胞的病毒浓度,预实验病毒浓度梯度为为1~5 MOI,最终感染心肌细胞的浓度梯度为5 MOI。为检测收获病毒的表达miR-133a的效果,将培养的C2C12细胞分为两组,分别为病毒组(采用miR-133a 病毒株感染),及对照组(用对照病毒株进行感染),培养48 h 后,荧光显微镜下观察细胞并拍照,收获细胞行RT-PCR 比较两组之间miR-133a的表达。
1.2.2 小鼠心肌细胞的分离及培养分离小鼠心肌细胞的方案通过了Texas A&M 健康研究所动物关怀与使用委员会批准。分离出生1~2 d的Sprague-Dawley大鼠的心脏,使用collagenase(75 U/mL)和pancreatin(0.6 mg/mL)消化法反复消化,通过细胞筛(BD)除去组织碎片,采用percoll梯度离心法分离细胞,加入含5%马血清的DF培养液(DMEM/F12,17 mmol/L NaHCO3,2 mmol/L L-葡萄糖苷)20 mL,混匀细胞,于1600 r/min 离心5 min,弃去上清,加入30 mL plating Medium(含5%小牛血清的DF 培养液),混匀细胞,种于37 ℃ 150 mm 培养皿中1h,纤维细胞将贴壁生长,轻轻吸取含未贴壁细胞的培养液于50 mL离心管中,并用plating Medium轻洗培养皿1次,收集培养液于离心管中,1200 r/min离心5 min,弃去上清,计数细胞,按1×106/皿密度种植细胞于培养皿中,培养基为含10% FBS 的DF 培养液,12 h 后换液,继续培养[4]。
1.2.3 PE诱导心肌肥大实验将上述培养心肌细胞在无血清的DF 培养基中培养24 h,将培养基换为10% FBS的DF培养5 h,将细胞分为2组,在模型组培养基中加入phenylephrine(浓度为100 μmol/L)继续培养,对照组不加,48 h 后收集细胞进行免疫组化染色,拍照后使用Image J软件分别测量模型组和对照组细胞大小并收集细胞的RNA 检测行RT-PCR 检测Acta1、Actc1、 Actb、Myh6、Myh7、BNP基因表达。
1.2.4 miR-133a 拮抗实验培养的心肌细胞在无血清的DF 培养基中培养24 h,将培养基换为10% FBS 的DF,将细胞分为2 组,1 组为miR-133a 拮抗组,加入miR-133a病毒(5 U/cell)另一组为对照组加入仅表达红色荧光蛋白的病毒共培养5 h,在两组细胞培养基中均加入phenylephrine(浓度为100 μmol/L)继续培养,48 h 后收集细胞进行免疫组化染色,拍照后使用Image J 软件分别测量模型组和对照组细胞大小,并收集细胞的RNA 检测行RT-PCR 检测Acta1、Actc1、Actb、Myh7、 BNP基因表达。
1.2.5 定量RT-PCRmiR-133a 的Q-PCR 采用TaqMan miR-assay 试剂盒,使用mmu-miR-16(catalog no 4427975)为内对照,使用strategene Mx3000p qPCR system 进行扩增,按照试剂盒的操作说明进行实验操作;Acta1、Actb、Myh7、BNP 基因表达采用SYBR 的方法,使用invitrogene 逆转录试剂盒结合olig T 引物行逆转录cDNA,使用GAPDH为内对照进行扩增,引物合成通过生工生物工程(上海)有限公司进行合成,序列如下:Acta1:R:5'-ggcggtgctgtccctctatgct-3',F: 5'-cgggca acggaaacgctcatt-3';Actb:R:5'-agcggttccgatgccctgag-3',R: 5'-aggggccggactcatcgtactc-3';Myh7:F: 5'-gccgcgcc agtacttcataggtg-3',R:5'-tggccttggggaacatgcact-3';BNP: F:5'-gcggcatggatctcctgaaggtg-3',R:5'-agcccaaacgactgac ggatcc-3'。
1.2.6 免疫组化染色采用2%福尔马林PBS 溶液固定细胞,常温孵育15 min;再用1% Triton100-PBS 溶液处理细胞,常温孵育15 min,以增加细胞的通透性;采用MF-20(DSHB,University of Iowa)为一抗孵育60 min,PBS 清洗3 次,每次10 min;使用Alexa Fluor 488 anti- goat IgG(Invitrogen,A11055)为二抗孵育30 min,PBS 清洗3 次,每次10 min;使用DAPI 染核,PBS 清洗,封片,在荧光显微镜下观察拍照。
1.2.7 数据统计数据以结果均数±标准差表示,采用SPSS 13 统计软件对所测数据进行单因素方差分析,以P<0.05为差异有统计学意义。
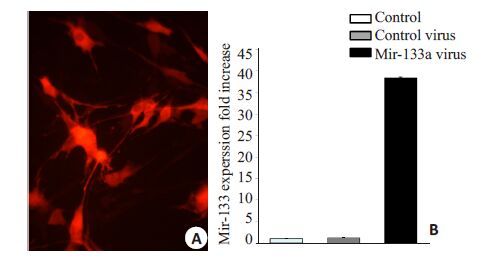
2 结果 2.1 构建的miR-133a腺病毒株表达miR-133a的情况两组C2C12 细胞在使用病毒及对照病毒株感染48 h后,在荧光显微镜镜下观察,均出现红色荧光;收集RT-PCR 结果表明,miR-133a 病毒株感染后的细胞株miR-133a 表达显著增高,对照组与未感染病毒的C2C12细胞组相比,miR-133a表达未见显著差异(图 1)。
|
图 1 miR-133a腺病毒表达检测 Figure 1 Detection of the expression of miR-133a adenovirus. A: Virus-infected C2C12 cells express miR1-133a and RFP; B: The expression of miR-133a was increased by nearly 40 folds compared to that in the control groups. |
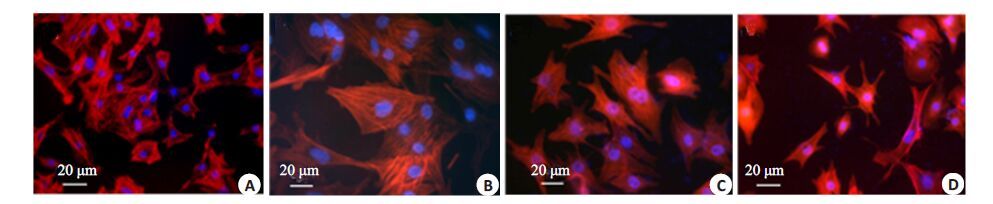
在PE 诱导实验中,心肌细胞在PE 诱导48 h 后,与 对照组细胞面积明显增大(图 2A、B,P<0.001);在miR-133a 拮抗实验中,miR-133a 病毒组较对照组细胞面积显著变小(图 2C、D,P<0.001)。
|
图 2 miR-133a拮抗PE诱导的心肌肥大 Figure 2 miR-133a negatively regulates cardiomyocyte hypertrophy induced by phenylephrine. A: Normal cultured cardiomyocytes; B: Cardiomyocytes 48 h after phenylephrine induction; C: Cardiomyocyte exposed to control virus for 5 h followed by phenylephrine induction for 48 h; D: Cardiomyocyte exposed to miR-133a virus for 5 h followed by phenylephrine induction for 48 h. |
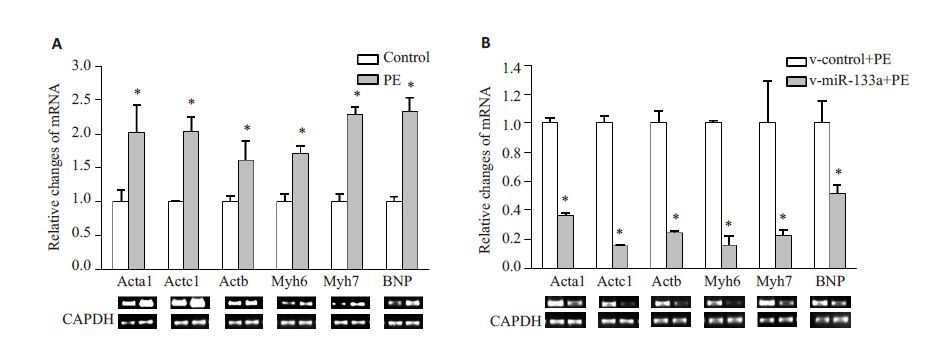
在PE 诱导实验中,心肌细胞在PE 诱导48 h 后,与对照组细胞相比,Acta1、Actb、Myh7、BNP 基因表达显著升高(图 3A)。在miR-133a拮抗实验中,miR-133a病毒组较对照组上述基因表达显著降低(图 3B)。
|
图 3 荧光定量PCR检测心肌肥大相关基因的表达 Figure 3 Detection of cardiomyocyte hypertrophy-associated gene expression with fluorescent quantitative PCR. A: Compared with normal cultured group,the expression levels of Acta1,Actc1,Actb,Myh6,Myh7 and BNP mRNA increased in PE group; B: Compared with those in control group,the expression levels of Acta1,Actc1,Actb,Myh6,Myh7 and BNP mRNAs were significantly reduced in miR-133a virus infected PE group. *P<0.05. |
在诱导心肌肥大因素中,神经体液因素是一类常见的原因,其中肾上腺素受体及其信号传导通路是诱导心肌肥大的重要因素。该通路被激活后,细胞内多个基因和蛋白质的表达量发生改变,发生一些列生物化学变化,从而导致心肌肥大的发生。在本研究中,采用了Acta1、Actb、Myh7、BNP 基因作为心肌肥大的发生指标,上述基因均是在细胞增殖密切相关的基因,在心脏胚胎发育早期或出生后病理状态下高表达,新出生0~3 d SD 大鼠心肌细胞在体外可以离体培养7 d,是研究心脏相关疾病的经典模型。
miRNA属于转录后调控,主要通过作为RNA诱导的沉默复合体(RISC)的一个元件,识别mRNA 的3'端非编码区,引起该mRNA 降解或者翻译抑制,从而负性调节靶蛋白的表达,发挥其生物学功能。mir-133a存在两个同源拷贝mir-133a-1、133a-2 和一个结构高度类似的同源拷贝133b。从老鼠胚胎发育的第12天到第18天,mir-133呈上升趋势。在成体的组织中表达最高。原位杂交也证实mir-133 只是选择性的在胚胎的心脏和骨骼肌中表达,在其它组织中则没有被发现[5]。Fire 等[6-7] 观察zebrafish的发育过程也得到了同样的结论。由此,人们认为mir-133a 在胚胎发育中正确的位相和时序的表达,对骨骼肌和心脏的发育是十分必要的。它对骨骼肌的增生和分化具有不可缺少的调控作用。Alessandra Care等[8-11]不仅在3个不同的心肌肥大动物模型均发现mir-133a 显著下降,更重要的是,在一个冠状动脉狭窄和心肌肥大的病人中也发现mir-133a的表达下调显著,推断出mir-133与心肌肥大之间存在直接的联系。
本研究中,利用miR-133a precursor cDNA 序列构建miR-133a腺病毒载体,并感染细胞收获病毒,该病毒感染细胞后可以持续高表达miR-133a;利用梯度密度离心法分离心肌细胞,培养后第2 天,细胞就呈现字主节律性收缩,是研究心脏相关机制的重要模型,在PE诱导后细胞面积较对照组增加了3 倍以上,且相关与心肌肥大的病理性指标密切联系的基因表达显著升高,可以完全再现心肌肥大的病理特征;在上述模型中加入miR-133a 病毒后,由于miR-133a 的表达增强,通过实验我们可以观察到miR-133a 可以显著抑制由PE 诱导的病理性肥大,相关基因的表达也得到显著抑制,这一现象表明,miR-133a 对心肌肥大有拮抗作用,这一研究结果也与其他研究者的结果相一致。值得我们注意的是,microRNA 属于转录后调控,其作用机制主要通过它对相关靶基因的转录调控实现的,在上述研究的基础上,寻找microRNA 的靶基因并研究它们之间的相互作用机制及相关靶基因的作用,将会为进一步明了microRNA 的作用机理,阐明相关生理、病理过程发生、 发展机制起到重要的促进作用[12-14]。
| [1] | Wen P, Song D, Ye H, et al. Circulating MiR-133a as a biomarker predicts cardiac hypertrophy in chronic hemodialysis patients[J]. PLoS One,2014, 9 (10) : e103079. DOI: 10.1371/journal.pone.0103079. |
| [2] | Duisters RF, Tijsen AJ, Schroen B, et al. miR-133 and miR-30 regulate connective tissue growth factor: implications for a role of microRNAs in myocardial matrix remodeling[J]. Circ Res,2009, 104 (2) : 170-8. DOI: 10.1161/CIRCRESAHA.108.182535. |
| [3] | Fan Y, Xie P, Zhang T, et al. Regulation of the stability and transcriptional activity of NFATc4 by ubiquitination[J]. FEBS Lett,2008, 582 (29) : 4008-14. DOI: 10.1016/j.febslet.2008.11.009. |
| [4] | 马燕琳, 杨祥胜, 林曦, 等. 梯度离心法分离、富集、纯化新生乳鼠心肌细胞[J]. 海南医学院学报,2011, 17 (12) : 1598-9. |
| [5] | Feng J, Schaus BJ, Fallavollita JA, et al. Preload induces troponin I degradation independently of myocardial ischemia[J]. Circulation,2001, 103 (16) : 2035-7. DOI: 10.1161/01.CIR.103.16.2035. |
| [6] | Fire A, Xu SQ, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature,1998, 391 (6669) : 806-11. DOI: 10.1038/35888. |
| [7] | Graef IA, Chen F, Chen L, et al. Signals transduced by Ca(2 + )/ calcineurin and NFATc3/c4 pattern the developing vasculature[J]. Cell,2001, 105 (7) : 863-75. DOI: 10.1016/S0092-8674(01)00396-8. |
| [8] | Dakhlallah D, Zhang J, Yu L, et al. MicroRNA-133a engineered mesenchymal stem cells augment cardiac function and cell survival in the infarct heart[J]. J Cardiovasc Pharmacol,2015, 65 (3) : 241-51. DOI: 10.1097/FJC.0000000000000183. |
| [9] | Guo TS, Zhang J, Mu JJ, et al. High-salt intake suppressed microRNA-133a expression in Dahl SS rat myocardium[J]. Int J Mol Sci,2014, 15 (6) : 10794-805. DOI: 10.3390/ijms150610794. |
| [10] | García R, Villar AV, Cobo M, et al. Circulating levels of miR-133a predict the regression potential of left ventricular hypertrophy after valve replacement surgery in patients with aortic stenosis[J]. J Am Heart Assoc,2013, 2 (4) : e000211. |
| [11] | Han X, Yang F, Cao H, et al. Malat1 regulates serum response factor through miR-133 as a competing endogenous RNA in myogenesis[J]. FASEB J,2015, 29 (7) : 3054-64. DOI: 10.1096/fj.14-259952. |
| [12] | Besser J, Malan D, Wystub K, et al. MiRNA-1/133a clusters regulate adrenergic control of cardiac repolarization[J]. PLoS One,2014, 9 (11) : e113449. DOI: 10.1371/journal.pone.0113449. |
| [13] | Kuwabara Y, Ono K, Horie T, et al. Increased microRNA-1 and microRNA-133a levels in serum of patients with cardiovascular disease indicate myocardial damage[J]. Circ Cardiovasc Genet,2011, 4 (4) : 446-54. DOI: 10.1161/CIRCGENETICS.110.958975. |
| [14] | Diniz GP, Lino CA, Guedes EC, et al. Cardiac microRNA-133 is down-regulated in thyroid hormone-mediated cardiac hypertrophy partially via Type 1 Angiotensin II receptor[J]. Basic Res Cardiol,2015, 110 (5) : 49. DOI: 10.1007/s00395-015-0504-7. |
 2015, Vol. 35
2015, Vol. 35
