2. 广州市开发区医院肾内科,广东 广州 510730
2. Department of Nephrology, Guangzhou Development Zone Hospital, Guangzhou 510730, China
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多因素参与的自身免疫性疾病,70%以上的系统性红斑狼疮患者临床上有不同程度的肾脏受累[1-3]。狼疮性肾炎(LN)是SLE 累及肾脏所引起的一种免疫复合物性肾炎,是临床进展至终末期肾脏病的主要继发性肾脏疾病之一[4]。LN具有病理变化多样性、易复发及活动性等特点,是SLE 患者死亡的重要原因[5-7],迄今为止仍缺乏临床治愈这种自身免疫性疾病的有效手段[8]。但是可以肯定,进行实时监测并及早发现病情的活动性,早期治疗复发性LN,有利于改善LN病人临床转归[9-10]。目前临床确诊LN 和判断LN 活动性的金标准是重复肾穿刺活检[11]。但是在实际操作过程中,肾穿刺活检很难反复进行,不便于临床医生随时监测和判断病情的活动状态,进行随访和疗效观察。因此,我们迫切需要找到可替代金标准的,可实时监测病情活动状态的敏感、特异的生物标志物来指导临床治疗。但是目前临床使用的无创性,可重复进行的检测方法,仅有24 h 尿蛋白定量、尿蛋白/肌酐比、尿沉渣镜检及红细胞位相等几项检测。检测项目少且灵敏性不够。我们试图从无创性检验方法中找出早期、敏感、方便和特异的判断LN 活动性的生物标志物,以利于早期诊断,防治LN 活动及疾病进展。既往有文献报道,血管内皮粘附分子(VCAM-1)水平与SLE 的活动性和器官损伤密切相关[12-13]。但是对于细胞间粘附分子(ICAM-1)和VCAM-1 在LN 活动期和非活动期的变化和意义仍无报道。因此,本研究的目的是分析活动性LN 患者尿液和肾组织中sICAM-1 和VCAM-1 的变化情况,探讨尿sICAM-1 和VCAM-1 水平与肾脏活动性病理改变的相关性。判断尿sICAM-1 和VCAM-1 水平的变化是否能成为判断活动性LN 的敏感生物标志物。
1 材料和方法 1.1 病例和标本收集 1.1.1 病例收集与分组选取我院2013~2014 年全年收治经肾穿刺活检并依据1982 年美国风湿病学会诊断标准确诊为LN 的患者92 例。肾穿刺病理结果依据2003 年ISN/RPS 狼疮性肾炎的病理学分型分为活动性(ⅢA/ⅣA 型,n=57)和非活动性(Ⅱ/Ⅴ 型,n=35)LN。患者年龄在15~65 岁之间(平均年龄34 岁),病情稳定,肾小球滤过率(eGFR)>80 mL/min,并除外合并严重感染性疾病、恶性肿瘤、妊娠、心血管疾病、肝功异常、过敏性紫癜、急性肾功能不全等因素。同时纳入20 例排除炎症、肿瘤等疾病的门诊健康体检者(平均年龄34 岁)作为对照组。本研究经南方医科大学南方医院伦理委员会审批通过。
1.1.2 尿液及肾组织标本留取患者在进行肾穿刺活检当天留取随机尿,3000 r/min 离心15 min,留取上清分装,-80 ℃保存;留取经肾组织常规光镜染色(HE、PAS、MASSON、PASM 染色)和免疫荧光染色(IgG、IgA、IgM、C3、C1q)检查确诊为狼疮性肾炎患者的石蜡组织标本。免疫组化染色采用肾石蜡标本4 μm切片。
1.2 方法 1.2.1 双抗体夹心酶联免疫吸附法(ELISA)测定ELISA 法测定患者尿sICAM-1,VCAM-1(购自Raybiotech公司),按试剂盒说明书进行操作。
1.2.2 免疫组织化学检测肾组织ICAM-1、VCAM-1 表达(1)石蜡切片脱蜡入水;(2)0.3%过氧化氢室温15 min,水洗;(3)抗原修复,PBS 洗2 min×3;(4)滴加低倍景稀释anti-human ICAM-1(1∶100,Santa Cruz),anti-human VCAM-1(1∶200,Santa Cruz)的一抗37 ℃ 1 h,PBS 洗2 min×3;(5)滴加Envision 试剂盒(DAKO)的2抗室温20 min,PBS洗2 min×3;(6)DAB显色5 min,水洗;(7)脱水、透明、封固。并对染色结果依据本课题组以往的方法进行半定量分析[14]。所有组织学分析由两个病理学家独立进行,保证实验的双盲和可靠性。
1.2.3 其他检查ELISA测定血清抗核抗体(ANA)和双链DNA 抗体(dsDNA)水平(购自Trinity Biotech 公司),按试剂盒说明书进行操作,血清ANA 和dsDNA 正常值低于25 U/mL。生化分析仪(型号AU480,购自Beckman Coulter)检测肝肾功能,血常规,免疫六项,24 h尿蛋白定量等。
1.2.4 数据分析采用SPSS 18.0 进行统计分析。计量资料数据以均数±标准差或者中位数表示,独立样本之间的比较采用独立样本t 检验或Mann-Whitney 秩和检验。采用Spearman法进行相关性分析。根据受试者工作特征(ROC)曲线计算尿sICAM-1和VCAM-1的特异性和敏感性。P<0.05 为差异有统计学意义。
2 结果 2.1 人口学和一般情况资料共入选经肾穿刺活检确诊为LN的患者92例,其中活动性LN(ⅢA/Ⅳ型)57例,非活动性LN(Ⅱ/Ⅴ型)35例。健康人对照组20例。各组年龄、性别、体质量指数、肾小球滤过率、ANA、尿白蛋白/肌酐比等均无统计学差异(表 1)。
| 表 1 人口学和一般情况 Table 1 Demographic and general data of LN patients ( n=92) |
用ELISA 的方法测定正常人、活动性和非活动性LN 患者尿sICAM-1 和VCAM-1 细胞因子的水平。如图 1 所示,LN 患者尿sICAM-1 和VCAM-1 水平显著高于正常人。而活动性LN患者这两种因子的水平显著高于非活动性LN患者。
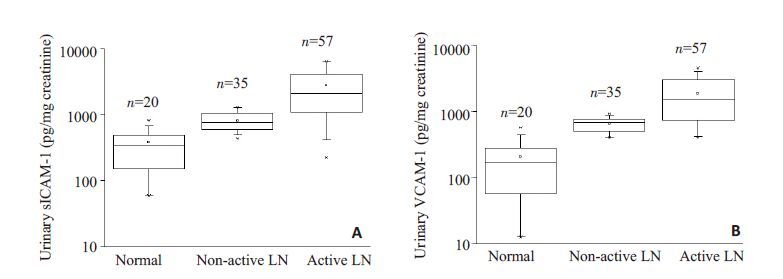
|
图 1 活动性LN患者尿sICAM-1和VCAM-1水平显著增高 Figure 1 Urine sICAM-1 and VCAM-1 levels are elevated in patients with active LN. A: Urinary sICAM-1 level,healthy people (normal): 191.3 (57.2-279.1),patients with non-active LN: 678.2 (500.1-770.8),patients with active LN: 1481 (732-3042). B: Urinary VCAM-1 level,healthy people (normal): 385.8 (157.5-551.1),patients with non-active LN 678.5 (594.2-1053.9),patients with active LN: 2096.7 (1096.7-4228.9). Continuous variables are expressed as the median (25th percentile to 75th percentile [interquartile range]). To compare continuous variables,Mann-Whitney rank sum test are used. P<0.001. |
采用特异性抗人ICAM-1 或VCAM-1 抗体对所有LN 患者的肾活检组织切片上进行免疫组织化学染色。随后用IPP 图像软件对肾组织上ICAM-1 和VCAM-1 的表达进行分析。结果如图 2 所示,肾脏表达ICAM-1 和VCAM-1。与正常对照组和非活动性LN 组相比,活动性LN 患者肾脏局部两种因子的表达显著升高,肾脏ICAM-1 染色的半定量分析,非活动性LN:1.2±0.4,活动性LN:2.2±0.8;肾脏VCAM-1 染色的半定量分析,非活动性LN:1.1±0.3,活动性LN:2.0±0.6;其差异具有显著统计学意义,P<0.001。
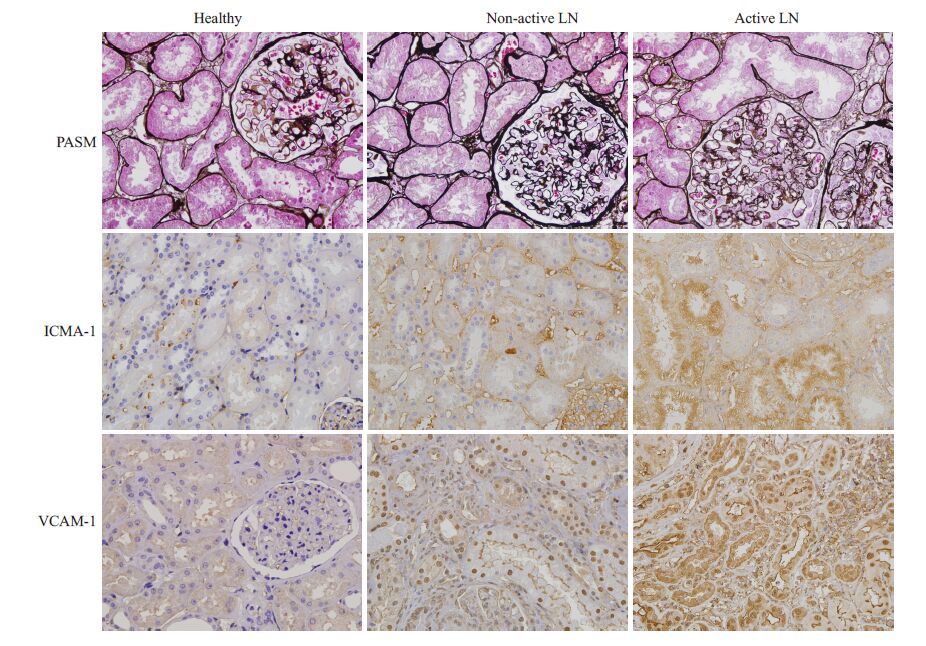
|
图 2 ICAM-1和VCAM-1在肾脏组织的表达 Figure 2 Expression of ICAM-1 and VCAM-1 in the kidney. |
我们采用Spearman 相关分析对尿液中sICAM-1 和VCAM-1 的水平和肾脏局部ICAM-1 和VCAM-1 的表达强度进行相关分析。我们发现,活动性LN 患者尿sICAM-1 浓度与肾ICAM-1 表达强度之间呈正相关关系,尿VCAM-1 浓度与VCAM-1 表达强度之间呈正相关关系(图 3)。
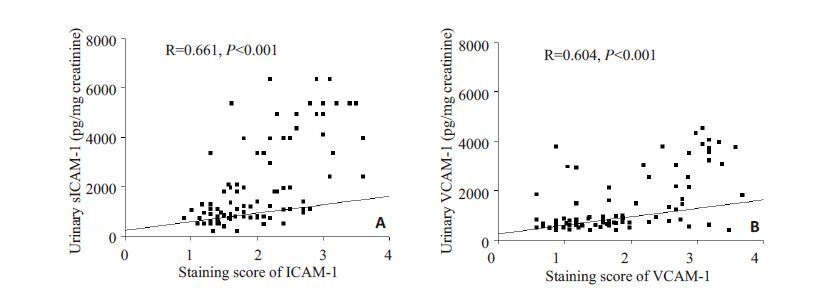
|
图 3 活动性LN患者尿sICAM-1浓度与肾ICAM-1表达密切,尿VCAM-1浓度与VCAM-1表达密切相关 Figure 3 Urine sICAM-1 and VCAM-1 level are correlated with intrarenal expression of sICAM-1 and VCAM-1 in active LN patients. A: Relationship between urinary sICAM-1 levels and intrarenal expression of ICAM-1; B: Relationship between urinary VCAM-1 levels and intrarenal expression of VCAM-1. The relationship between them is analyzed by Spearman method. |
以活动性LN 和非活动性LN 患者为分析人群,将所有可能的切点作为阈值进行灵敏度和特异性计算后,以灵敏度为纵坐标,(1-特异度)为横坐标作ROC 曲线(如图 4所示)。根据曲线,分析尿sICAM-1和VCAM-1 在预测活动性LN 中的敏感性和特异性。尿sICAM-1 的ROC 曲线分析显示,曲线下面积为0.874(95% CI 0.803-0.946,P<0.001),尿sICAM-1 值>1095.00 pg/mg creatinine 时诊断为活动性LN,特异性94.5%,敏感性78.9%。尿VCAM-1 的ROC 曲线分析显示,曲线下面积为0.882(95%CI 0.821-0.943,P<0.001),尿VCAM-1值>898.11 pg/mg creatinine 诊断为活动性LN,特异性98.2%,敏感性66.7%。
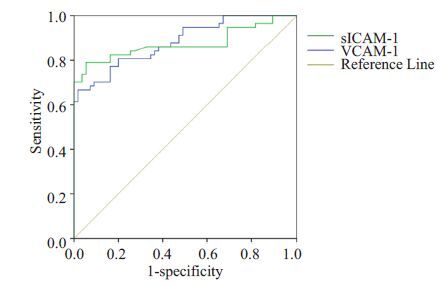
|
图 4 尿sICAM-1和VCAM-1水平的ROC曲 Figure 4 ROC analyses of urine sICAM-1 and VCAM-1 levels for predicting active LN. |
LN 是临床进展至终末期肾脏病的主要继发性疾病,临床表现呈多样性,在慢性病程中易急性发作[15]。活动性LN 患者,往往出现肾损伤的进行性加重和肾功能的进行性下降。越早发现LN 的活动性和肾脏病变的活动程度,越有利于及早调整治疗方案和改善病人预后[5]。在已有的评价LN 活动性的方法中,重复肾穿刺活检是最直观的、可靠的[16],但其会造成不同程度肾组织损伤,有的还会引起肾周血肿等并发症,常作为鉴别诊断的确诊方法并不适合用于LN 的的长期监测。SLEDAI 评分是常用判断SLE 活动性的指标,但这种评分所计算的积分的高低与肾脏病变的活动并不完全平行[11]。血清学检查中补体水平下降和dsDNA 滴度的上升反映的也是SLE的全身活动情况,不能直接反应肾脏的受损程度。目前临床常用24小时尿蛋白/白蛋白定量和尿白蛋白/肌酐比作为监测和诊断LN 活动性的指标,但是尿蛋白/白蛋白检测一般只对有明显肾脏活动,并且未经治疗的患者敏感,而对LN 活动早期或正在接受免疫抑制剂治疗的患者不太灵敏,因此尿检正常并不意味着LN没有进入活动期[11]。我们的研究也发现,如表 1所示,活动性和非活动性LN患者的血清dsDNA,ANA,C3 和尿白蛋白/肌酐比之间无明显差异,证实这些值的高低不能反映肾脏病变的活动情况。因此,我们需要寻找新的反映LN活动性的生物标志物。
活动性LN 的病变首先体现在肾脏病理上的改变,然后是出现蛋白尿,血尿等临床症状。因此寻找反映肾脏活动性病理改变的生物标志物是至关重要。活动性LN 肾脏病理上主要表现为肾小球增生性改变、免疫复合物沉积、坏死、炎症细胞的浸润等。其中炎症细胞的浸润是区分LN 活动性与非活动性的早期和重要指标[17]。而血管粘附分子是介导肾脏局部炎细胞浸润的关键环节。ICAM-1 和VCAM-1 是血管粘附分子家族成员,生理情况下以低水平表达于巨噬细胞,树突状细胞和血管内皮细胞,因此在正常环境下,血管内皮抵抗白细胞的粘附。当肾血管内皮细胞,巨噬细胞等在受到促炎症因子的刺激后可导致ICAM-1 和VCAM-1 在质膜上表达增多并与单核一巨噬细胞和中性粒细胞的极迟活化相关抗原4(VLA1)相结合,介导白细胞迅速转移到炎症部位,参与炎症及其下游反应[18]。因此,研究肾脏局部粘附分子的表达可能可以反映肾脏局部的炎症状态。
Wu 等[12]的研究发现,与正常对照相比,SLE患者尿VCAM-1 水平增加,并随SLE 的活动性(SLEDAI 评分)的增加而增高。提示监测粘附分子水平可能有助于早期发现SLE 的活动性病变。我们的研究从病理学分型的角度将LN 区分活动性(ⅢA/Ⅳ)和非活动性(Ⅱ/Ⅴ)LN,并分析这两类LN 与尿sICAM-1 和VCAM-1 水平之间的关系。如图 1 所示,我们发现活动性LN 患者尿sICAM-1 和VCAM-1 水平较正常人和非活动性LN 患者相比显著升高,说明测定尿sICAM-1 和VCAM-1 水平对于区分LN的活动期和非活动期有重要意义。
随后我们的研究了正常人,LN 患者肾组织中ICAM-1 和VCAM-1 的表达情况。如图 2 所示,LN 患者肾组织中的ICAM-1 和VCAM-1 主要表达于肾小管上皮细胞,这一结果与Alsuwaida 等[11]的研究结果一致。而且活动性LN患者肾组织中这两种粘附分子的表达较非活动性LN 患者显著增加,提示肾组织中的ICAM-1 和VCAM-1 表达可能与LN 的活动性相关,这些粘附分子可能可以分泌到肾小管管腔,成为尿sICAM-1 和VCAM-1 的重要来源。我们对LN 患者尿液中sICAM-1和VCAM-1的水平和肾脏局部sICAM-1和VCAM-1 的表达强度的相关分析也证实,LN 患者尿sICAM-1 浓度与肾ICAM-1 表达强度之间存在正相关关系,尿VCAM-1 浓度与VCAM-1 表达强度之间也存在正相关关系(图 3)。并且LN 患者尿sICAM-1 和VCAM-1 的ROC 曲线表明(图 4),以尿sICAM-1>1095.00 pg/mg creatinine 和VCAM-1>898.11 pg/mg creatinine 为标准判断LN 患者肾脏病变是否处于活动期,具有较高的特异性和敏感性。所有这些结果提示,尿液中升高的sICAM-1和VCAM-1可能部分来源于肾脏,并与他们在肾脏的表达强度密切相关。长期监测尿sICAM-1和VCAM-1,可早期发现LN的活动性病变。
本研究也存在一定的局限性。本课题是横断面研究,研究结果提示尿sICAM-1 和VCAM-1 可以用来判断LN 的活动期和非活动期,但是其明确的临床应用价值仍有待大规模,多中心随机对照实验来进一步论证。此外,尿sICAM-1 和VCAM-1 水平的高低反映的是肾脏病变的炎症程度,而非特异性的LN的肾脏炎症变化,因此在后续临床实验中,还需要联合其他LN 常规指标同时进行监测,以利于更准确和特异的判断LN 的病程变化趋势。这都需要在我们以后的研究中进一步完善。
综上所述,我们的结果表明尿sICAM-1 和VCAM-1 反映了LN 肾脏炎症的状态,可以作为判断LN活动性的生物标志物。长期监测尿中这两个指标可以帮助我们观察LN患者的病情变化,并可为疗效观察,实现个体化治疗提供新依据。
| [1] | Kotzin BL. Systemic lupus erythematosus[J]. Cell,1996, 85 (3) : 303-6. DOI: 10.1016/S0092-8674(00)81108-3. |
| [2] | Koutsokeras T, Healy T. Systemic lupus erythematosus and lupus nephritis[J]. Nat Rev Drug Discov,2014, 13 (3) : 173-4. DOI: 10.1038/nrd4227. |
| [3] | Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011, 365 (22) : 2110-21. DOI: 10.1056/NEJMra1100359. |
| [4] | Houssiau FA. Management of lupus nephritis: an update[J]. J Am Soc Nephrol,2004, 15 (10) : 2694-704. DOI: 10.1097/01.ASN.0000140218.77174.0A. |
| [5] | Fiehn C, Hajjar Y, Mueller K, et al. Improved clinical outcome of lupus nephritis during the past decade: importance of early diagnosis and treatment[J]. Ann Rheum Dis,2003, 62 (5) : 435-9. DOI: 10.1136/ard.62.5.435. |
| [6] | Moroni G, Quaglini S, Gallelli B, et al. The long-term outcome of 93 patients with proliferative lupus nephritis[J]. Nephrol Dial Transplant,2007, 22 (9) : 2531-9. DOI: 10.1093/ndt/gfm245. |
| [7] | Mosca M, Bencivelli W, Neri R, et al. Renal flares in 91 SLE patients with diffuse proliferative glomerulonephritis[J]. Kidney Int,2002, 61 (4) : 1502-9. DOI: 10.1046/j.1523-1755.2002.00280.x. |
| [8] | Lorenz G, Desai J, Anders HJ. Lupus nephritis: update on mechanisms of systemic autoimmunity and kidney immunopathology[J]. Curr Opin Nephrol Hypertens,2014, 23 (3) : 211-7. DOI: 10.1097/01.mnh.0000444816.57378.21. |
| [9] | Bertsias GK, Tektonidou M, Amoura Z, et al. Joint European league against rheumatism and European renal Association-European dialysis and transplant association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis[J]. Ann Rheum Dis,2012, 71 (11) : 1771-82. DOI: 10.1136/annrheumdis-2012-201940. |
| [10] | Fiehn C. Early diagnosis and treatment in lupus nephritis: how we can influence the risk for terminal renal failure[J]. J Rheumatol,2006, 33 (8) : 1464-6. |
| [11] | Alsuwaida AO. The clinical significance of serial kidney biopsies in lupus nephritis[J]. Modern Rheumatology,2014, 24 (3) : 453-6. DOI: 10.3109/14397595.2013.844293. |
| [12] | Wu T, Xie C, Wang HW, et al. Elevated urinary VCAM-1,P-selectin, soluble TNF receptor-1,and CXC chemokine ligand 16 in multiple murine lupus strains and human lupus nephritis[J]. J Immunol,2007, 179 (10) : 7166-75. DOI: 10.4049/jimmunol.179.10.7166. |
| [13] | Reyes-Thomas J, Blanco I, Putterman C. Urinary biomarkers in lupus nephritis[J]. Clin Rev Allergy Immunol,2011, 40 (3) : 138-50. DOI: 10.1007/s12016-010-8197-z. |
| [14] | Cao W, Li A, Wang L, et al. A Salt-Induced Reno-Cerebral reflex activates Renin-Angiotensin systems and promotes CKD progression[J]. J Am Soc Nephrol,2015, 26 (7) : 1619-33. DOI: 10.1681/ASN.2014050518. |
| [15] | Sprangers B, Monahan M, Appel GB. Diagnosis and treatment of lupus nephritis flares--an update[J]. Nat Rev Nephrol,2012, 8 (12) : 709-17. DOI: 10.1038/nrneph.2012.220. |
| [16] | Hill GS, Delahousse M, Nochy D, et al. Predictive power of the second renal biopsy in lupus nephritis: significance of macrophages[J]. Kidney Int,2001, 59 (1) : 304-16. DOI: 10.1046/j.1523-1755.2001.00492.x. |
| [17] | Illei GG, Lipsky PE. Biomarkers in systemic lupus erythematosus[J]. Curr Rheumatol Rep,2004, 6 (5) : 382-90. DOI: 10.1007/s11926-004-0013-4. |
| [18] | Chakraborty S, Hu SY, Wu SH, et al. The interaction affinity between vascular cell adhesion molecule-1(VCAM-1)and very late antigen-4(VLA-4)analyzed by quantitative FRET[J]. PLoS One,2015, 10 (3) : e0121399. DOI: 10.1371/journal.pone.0121399. |
 2015, Vol. 35
2015, Vol. 35
