2. 武警浙江省总队嘉兴医院烧伤整形科,浙江 嘉兴 314000
2. Jiaxing Hospital of Zhejiang Armed Police Corps, Jiaxing 314000, China
瘢痕是皮肤创伤愈合的必然结果,给患者带来了外观畸形、感觉异常甚至器官功能障碍,一直没有特别有效的治疗方法,主要是因为对其机制研究尚不清楚。目前普遍认为转化生长因子-β(TGF-β)介导的信号通路是促使创伤愈合、瘢痕形成关系最密切的机制[1]; TGF-β可刺激皮肤成纤维细胞(FB)增殖并分泌细胞外基质(ECM),导致瘢痕生成;这种作用一旦失控,则伤口过度愈合并发展为病理性瘢痕[2]。血小板源性生长因子(PDGF)是创伤后释放的另一种重要的细胞因子,能够促进细胞的趋化、分裂与增殖,在创伤修复过程中起重要的作用[3]。有研究显示,PDGF 可以促进FB 表达TGF-β受体Ⅱ(TβRⅡ),使FB 对TGF-β的敏感性增加[4-5],与TGF-β协同促进瘢痕形成。核因子Ⅰ(NFI)是哺乳动物体内广泛存在的一类转录因子,目前发现的有A、B、C、X 四种亚型。有研究表明,敲除NFI-C后,PDGF通路及TGF-β通路明显增强[6, 7],导致伤口愈合加速;但NFI-C过表达对这两条通路及瘢痕形成的影响未见报道。本实验首次通过慢病毒转染技术构建NFI-C 过表达FB,研究NFI-C 是否可抑制PDGF 对TβRⅡ的上调作用,降低伤口愈合过程中FB 对TGF-β 的敏感性,从而为临床改善瘢痕及抗病理性瘢痕的基因治疗提供新思路。
1 材料和方法 1.1 材料 1.1.1 细胞株人皮肤成纤维细胞株HFF-1 细胞(ATCC)。
1.1.2 主要试剂和材料DMEM 培养基、胎牛血清、青霉素、链霉素、胰酶(Gibco);;PDGF-BB(PeproTech); Blasticidin 、Trizol 液(Invitrogen);Polybrene(Sigma); MTS 试剂盒(Promega);细胞裂解液、蛋白酶抑制剂、 BCA 蛋白定量试剂盒、ECL Prime 蛋白印迹试剂(Thermo);0.45 μm PVDF 膜(Millipore);抗人TβRⅡ、抗人NFI-C、抗人GAPDH、辣根过氧化物酶标记的二抗(CST);逆转录试剂盒(Fermentas);SYBR Green Super Mix(Bio-rad);TβR Ⅱ引物(上游:5'-GTC GCT TTG CTG AGG TCT AT AA-3',下游:5'-CTC TGT CTTCCA AGA GGC AT AC-3)'及内参基因GAPDH 引物(上游:5'-AGG TCC ACC ACT GAC ACG TT-3',下游: 5'-GCC TCA AGA TCA TCA GCA AT-3)'(上海生工)。
1.1.3 主要仪器CO2恒温培养箱、NanoDrop 3300微量紫外分光光度计(Thermo);普通光学显微镜和IMT-2倒置显微镜(OLYMPUS);EXL808 全自动酶标仪(BIO-TEK);ABI 7500 Real Time PCR System(ABI)。
1.2 PDGF对人皮肤成纤维细胞表达TβRⅡ的影响HFF-1 细胞培养于含15%胎牛血清、1%双抗(青霉素+链霉素)的DMEM 高糖培养基,置于37 ℃、5% CO2饱和湿度培养箱培养。每隔2~3 d 换液1 次,当细胞长满90%培养皿时采用胰酶消化,以1∶3 的比例传代。取P3代HFF-1细胞,加入30 ng/mL的PDGF-BB作用24 h,采用Western blot 检测PDGF-BB 处理及未处理HFF-1细胞表达TβRⅡ的差异。
1.3 慢病毒NFI-C最适转染复数值测定人NFI-C 序列为NCBI 数据库CR536507.1(1500 bp)。慢病毒NFI-C(Lenti-GFP-NFI-C)以及含有空载体的阴性病毒(Lenti-GFP)均委托美国Invitrogen TM—Life Technologies 公司(上海)构建。取P3 代、对数生长期的HFF-1 按5×103/孔接种于96 孔板,贴壁后更换含6 μg/mL Polybrene 的无血清培养基,将Lenti-GFP-NFI-C 按转染复数(multiplicity of infection,MOI)0、5、10、30、50、100 转染HFF-1,每组设15 孔,37 ℃、5% CO2下转染6 h后更换完全培养液。常规培养8d,于0、2、4、6、8 d 采用MTS 法于490 nm 测吸光度值,各时相点每MOI取3孔测定;转染96 h后于荧光倒置显微镜下观察表达GFP 的细胞,以GFP 阳性细胞占总细胞的比例作为转染效率;以生长活性抑制低、感染效率高确定最佳MOI值。
1.4 慢病毒转染FB后NFI-C的表达取对数生长期P3 代HFF-1 细胞,用无血清DMEM 培养基洗1 次,换无血清培养基孵育24 h 使细胞同步于G0 期,然后弃上清,分成2 个实验组,即Lenti-GFP- NFI-C 转染组和未转染组;转染组按最佳MOI 进行转染。转染6 h 后更换为完全培养基,于第4 天采用western blot法测定两组细胞NFI-C蛋白的表达。
1.5 慢病毒转染对PDGF促进FB表达TβRⅡ的影响取对数生长期P3代HFF-1细胞,转染前准备同上,分为5 组:(1)NFI-C 转染组:将Lenti-GFP-NFI-C 按照最佳MOI 转染HFF-1 细胞,待筛选出稳定转染细胞后用30 ng/mL PDGF-BB 刺激24 h;(2)阴性病毒组:将Lenti-GFP 按照最佳MOI 转染HFF-1 细胞,待筛选后用30 ng/mL 的PDGF-BB 刺激24 h;(3)PDGF 组:HFF-1 细胞单用30 ng/mL PDGF-BB 刺激24 h;(4)单纯NFI-C 转染组:将Lenti-GFP-NFI-C 按照最佳MOI 转染HFF-1细胞,并筛选稳定转染细胞;(5)空白对照组:不做任何处理。转染的细胞于转染48 h 后加入0.05 μg/mL Blasticidin筛选稳转细胞,每2~3 d换液,1周后换完全培养基并在(1)、(2)、(3)组中加入PDGF-BB继续培养24 h。
1.6 Western blot法测定NFI-C和TβRⅡ蛋白的表达取1.2、1.4、1.5 中各组细胞用冰预冷的PBS 重复洗涤2 次,吸干洗涤液。加入细胞裂解液及1%蛋白酶抑制剂冰上裂解15 min,收集裂解液于4 ℃、1400 r/min离心7.5 min。收集上清液,BCA法进行蛋白定量。按蛋白量40 μg/孔进行10% SDS-PAGE凝胶电泳(80 V 20 min,150 V 约1.5 h)并转膜(400 mA 1.5 h)至PVDF 膜。于5%脱脂奶粉室温封闭1 h,剪膜后分别加入1∶1000稀释的一抗,4 ℃过夜;TBST 洗膜(5 min×3 次),加相应的辣根过氧化物酶标记的二抗,室温孵育1 h;充分洗膜后用ECL Prime 蛋白印迹试剂进行化学发光显色,X 片曝光显影。用美国Bio-Rad 公司Quantity One 软件对Western条带进行定量分析,读取积分光密度值。
1.7 荧光定量PCR法测定TβRⅡ mRNA的表达取1.5 中各组细胞,用Trizol 液常规提取总RNA,使用微量紫外分光光度计测定RNA 的含量及260 和280 nm 的吸光度(A)值,控制A260/A280 在1.9~2.1。取2μg 总RNA 参照逆转录试剂盒说明书进行cDNA 合成,然后应用ABI 7500 Real Time PCR System 进行扩增。PCR 反应体系:cDNA 50 ng,2 × SYBR Green Super Mix 12.5 μL,引物300 nmol/L,补水至25 μL。反应条件:95 ℃预变性30 s,95 ℃变性10 s,60 ℃复性30 s,循环40 次。设定65 ℃为荧光检测点,进行扩增。用基于内参物GAPDH 的相对定量分析,目的基因mRNA表达量用2-△△Ct计算转录水平的差异。
1.8 统计学分析所有实验数据均为独立重复3 次实验后得到的平均值,数据分析用SPSS 19.0 软件以均数±标准差表示,采用单因素方差分析、LSD-t 检验分析各MOI组转染效率及生长活性数据;单因素方差分析、SNK-q 检验分析各处理组组间差异,P<0.05为差异具有统计学意义。
2 结果 2.1 PDGF促进皮肤成纤维细胞表达TβRⅡ(图 1)HFF-1 细胞经PDGF-BB 处理后,其TβRⅡ条带与GAPDH 灰度值比值为0.59±0.03,高于未处理细胞0.29±0.05,且差异有统计学意义(n=3,P<0.05)。
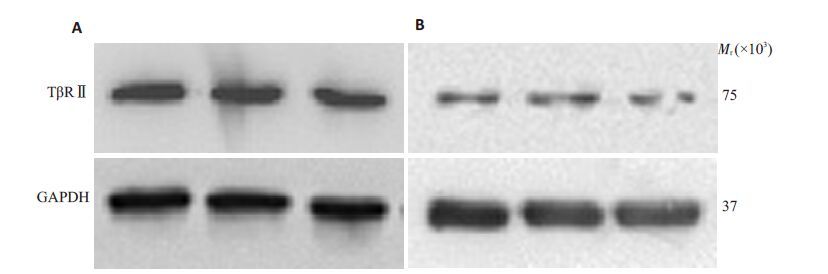
|
图 1 PDGF作用HFF-1细胞24 h的TβRⅡ变化 Figure 1 Expression of TβR II in HFF-1 cells 24 h after PDGF treatment. A: PDGF-treated cells; B: Untreated cells. |
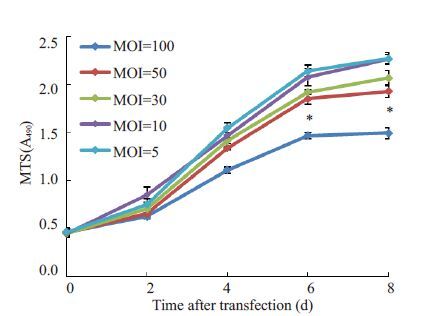
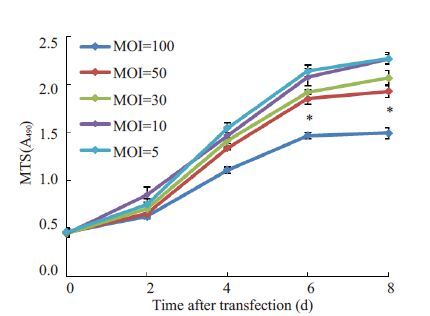
慢病毒转染后3 d,细胞GFP 表达良好(图 2);转染细胞NFI-C条带与GAPDH灰度值比值为1.07±0.13(图 3A),高于未转染细胞0.23±0.03(图 3B),差异有统计学意义(n=3,P<0.05)。不同MO(I 0、5、10、30、50、100)转染HFF-1 细胞的转染效率及生长活性分别(图 4,5),结果发现MOI 从50 增至100 时细胞生长抑制明显加重,而转染效率升高差异无统计学意义(P>0.05),因而最佳MOI为50。
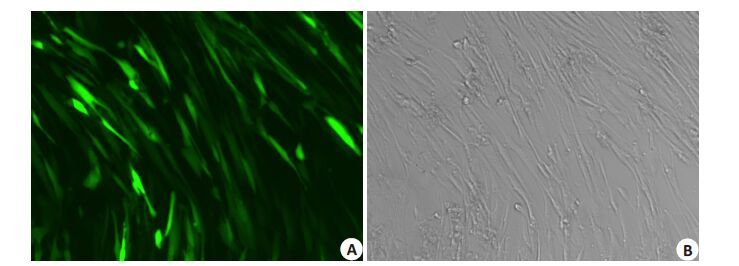
|
图 2 慢病毒转染HFF-1细胞后表达GFP Figure 2 Expression of GFP in HFF-1 cells after lentiviral transfection (Original magnification: ×100). A: HFF-1 cells expressing GFP; B: Bright field image of the same field of vision. |
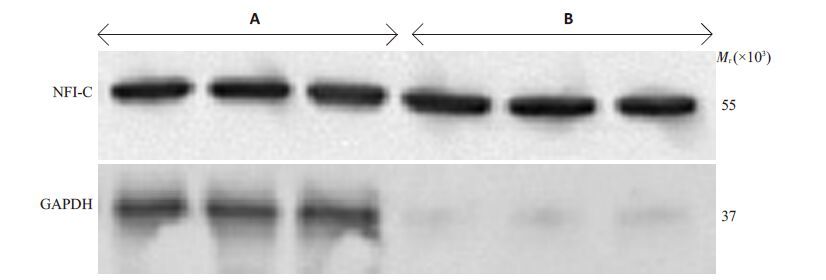
|
图 3 Lenti-GFP-NFI-C转染HFF-1细胞后NFI-C的表达情况 Figure 3 Expression of NFI-C in HFF-1 cells after transfection with Lenti-GFP-NFI-C. A: Lenti-GFP-NFI-C -transfected group; B: Non-transfected group. |
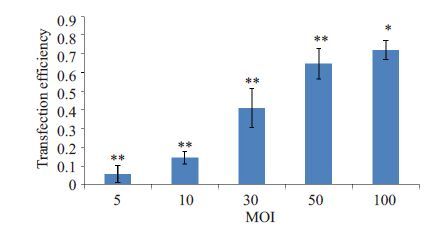
|
图 4 Lenti-GFP-NFI-C转染后各MOI组转染效率 Figure 4 Changes of transfection efficiency with increased MOIs of lenti-GFP-NFI-C. *P>0.05 vs MOI of 50; **P<0.05 for comparisons among MOIs of 5,10,30,and 50. |
|
图 5 Lenti-GFP-NFI-C转染后各MOI组细胞生长曲线 Figure 5 Cell growth curves after Lenti-GFP-NFI-C transfection with increased MOIs. *P<0.05 for comparison of MOI of 100 with MOIs of 5,10,30,and 50. |
Western blot 显示:NFI-C 转染组TβR Ⅱ条带与GAPDH 的比值为0.39±0.06(图 6A),低于阴性病毒组(0.62±0.11)(图 6B)和PDGF 组(0.66±0.10)(图 6C),差异具有统计学意义(n=3,P<0.05);且阴性病毒组与PDGF 组之间无显著性差异(n=3,P>0.05);单纯NFI-C转染组(0.322 ± 0.002)(图 6D)与空白对照组(0.325 ± 0.019)(图 6E)之间亦无显著性差异(n=3,P>0.05)。RT-qPCR 显示:NFI-C 转染组TβR Ⅱ mRNA 水平与GAPDH 的比值为0.24±0.12,低于阴性病毒组(0.73± 0.13)和PDGF 组(0.81±0.12),差异具有统计学意义(n=3,P<0.05);阴性病毒组与PDGF 组之间亦无显著性差异(n=3,P>0.05);单纯NFI-C 转染组(0.15±0.04)与空白对照组(0.17±0.04)之间亦无显著性差异(n=3,P>0.05)。
|
图 6 PDGF作用Lenti-GFP-NFI-C转染、Lenti-GFP转染以及未转染的HFF-1细胞24 h后TβRⅡ蛋白水平变化 Figure 6 Expression of TβRII protien in different groups. A: Lenti-GFP-NFI-C-transfected cells; B: Negative control cells; C: PDGF-treated cells; D: Lenti-GFP-NFI-C-transfected cells without PDGF treatment; E: Blank control group. |
皮肤创伤后,各种细胞因子激活FB 是瘢痕形成的关键机制。目前普遍认为,在创伤后的早期从分子水平干预被激活的FB,可能会有效改善瘢痕的形成,并从根本上解决这一临床难题。因此,发现创伤早期干预分子来调节瘢痕形成具有重要的意义。TGF-β通路过度激活会导致FB过度增殖,ECM大量沉积,最终发展为病理性瘢痕[2],因而TGF-β通路是抗瘢痕治疗的重要靶位[8-9]。组织中的TGF-β必须先与细胞表面的TβRⅡ结合才能激活下游基因表达,因而TβRⅡ是TGF-β通路的关键转导分子;病理性瘢痕的重要特征之一是FB 对TGF-β的敏感性上升;而通过竞争性抑制TβRⅡ则表现出良好的抗瘢痕效果[10]。
NFI 家族属于转录复制因子,是编码位置特异性的转录因子,在众多真核生物不同组织、器官、细胞的基因表达方面均发挥着重要的作用[11]。NFI-C是NFI家族成员,早期研究发现,NFI-C 的缺失可促进TGF-β1 的表达,从而导致小鼠牙根发育异常[12]。Lee 等[7]发现,在小鼠成牙质细胞中加入TGF-β1可诱导NFI-C降解。近年Plasari 等发现,NFI-C 敲除后TGF-β通路基因表达明显上调,伤口愈合明显加速[6]以及毛囊形成受阻[13],而毛囊等皮肤附属器缺失是瘢痕的特征之一;此外,该研究还发现敲除NFI-C 的小鼠PDGF 通路激活明显增强[6]。PDGF 是创伤早期释放的一种细胞因子,具有促进FB增殖、ECM 生成等作用[14],抑制PDGF 及其受体可有效缓解肺及肾纤维化进程[15-16]。PDGF是由A、B两条链组成的二聚体,分别构成PDGF-AA、PDGF-AB 和PDGF-BB 3 种亚型;PDGF 受体(PDGF receptor,PDGFR)也是由α、β两条链组成的二聚体;PDGF-AA 只能结合αα二聚体受体,PDGF-AB 能结合αα、αβ二聚体受体,PDGF-BB 能结合αα、αβ、ββ二聚体受体,因而PDGF-BB 在3 者之中作用效果最强。PDGF 3 种亚型均可上调TβRⅡ,增强FB 对TGF-β的敏感性[4];而病理性瘢痕的形成往往伴随着PDGF 表达异常增高以及FB对其反应性增强[14]。本研究采用PDGF-BB作用于人皮肤成纤维细胞,结果发现其TβRⅡ表达较未处理细胞明显升高,与文献报道一致。分析其原因,可能是由于PDGF 可激活丝裂原活化蛋白激酶(MAPK)、细胞外调节蛋白激酶、MAPK/ ERK 激酶(MEK)以及磷脂酰肌醇3-激酶(PI3-K)等通路[17],这些下游通路同时参与TGF-β通路的自身正反馈放大途径;其中MEK 的激活可直接导致TβRⅡ表达上调[18],PI3-K 激活可导致瘢痕疙瘩FB 侵袭性增强[19];此外,PDGF-BB 刺激可显著提升组蛋白乙酰化的水平[20],这一过程亦可诱导TβRⅡ表达[21]。可见PDGF 通路与TGF-β通路在伤口愈合过程中是相互协调的,这种平衡一旦被打破,就有可能造成伤口过度愈合或不愈合;而NFI-C紧密联系着这两条通路的相互作用。
本研究采用慢病毒载体转染FB,相对于腺病毒载体具有表达时间长、宿主免疫反应小、细胞毒性小、能转染非分裂细胞等优势,利于在转染之后筛选得到高纯度的过表达细胞株。结果显示,FB 在转染后可稳定表达NFI-C;在PDGF-BB刺激下,NFI-C转染的FB表达TβR Ⅱ明显低于阴性病毒组和PDGF 组;但在没有PDGF 的条件下,NFI-C 转染并不影响TβRⅡ的基础性表达;而阴性病毒组和PDGF组之间的差异无统计学意义,表明NFI-C 可显著抑制PDGF 导致的TβRⅡ上调,降低FB 对TGF-β的敏感性,且慢病毒转染本身不具有这种抑制作用。国外研究表明PDGF 可上调TβRⅡ mRNA 稳定表达,进而提升其蛋白水平[4-5];在本实验中,NFI-C 使PDGF 作用后的FB 表达TβRⅡ mRNA 水平下降程度大于其蛋白水平,表明NFI-C 主要在转录水平抑制PDGF 对TβRⅡ的上调作用。其机制还不清楚,笔者推测NFI-C 可能通过与抑制上述的PDGF 下游信号通路、 与转录因子竞争性结合TβRⅡ基因启动子位点或者募集转录抑制因子等途径来抑制TβRⅡ基因表达[11]。此外,PDGFR 的α、β链可激活不同的通路,且在伤口愈合过程中PDGFR β 链的表达显著高于α 链[4];而敲除NFI-C 的细胞主要表现为PDGFR α链的上调[6];因而PDGF促进TβRⅡ表达的确切途径以及NFI-C在这两条通路之间作用的具体机制仍十分复杂,有待进一步研究。
综上所述,慢病毒载体介导的NFI-C 能有效抑制PDGF 上调皮肤FB 表达TβRⅡ,从而降低其对TGF-β 的敏感性,这一结果为改善瘢痕形成提供1 种新的潜在干预分子,并为今后临床抗瘢痕的基因治疗提供新思路。PDGF 及TGF-β通路是创伤后的两条关键通路,过度激活或者过度抑制分别会导致伤口的过度愈合或不愈合,因此如何控制基因转染之后NFI-C 对PDGF 及TGF-β通路的抑制作用在一个适当范围内,使其不至于作用过度而影响伤口正常愈合依然需要研究。与以往敲除性实验不同,本研究首次构建NFI-C 过表达细胞株,这对细胞的其他影响尚不明确,将来可行动物实验进一步探讨其安全性和有效性。
| [1] | Walraven M, Gouverneur M, Middelkoop E, et al. Altered TGF-β signaling in fetal fibroblasts: what is known about the underlying mechanisms?[J]. Wound Repair Regen,2014, 22 (1) : 3-13. DOI: 10.1111/wrr.2014.22.issue-1. |
| [2] | Gordon KJ, Blobe GC. Role of transforming growth factor-beta superfamily signaling pathways in human disease[J]. Biochim Biophys Acta,2008, 1782 (4) : 197-228. DOI: 10.1016/j.bbadis.2008.01.006. |
| [3] | Werner S, Grose R. Regulation of wound healing by growth factors and cytokines[J]. Physiol Rev,2003, 83 (3) : 835-70. |
| [4] | Czuwara-Ladykowska J, Gore EA, Shegogue DA, et al. Differential regulation of transforming growth factor-beta receptors type I and Ⅱ by platelet-derived growth factor in human dermal fibroblasts[J]. Br J Dermatol,2001, 145 (4) : 569-75. DOI: 10.1046/j.1365-2133.2001.04443.x. |
| [5] | Tiede S, Ernst N, Bayat A, et al. Basic fibroblast growth factor: a potential new therapeutic tool for the treatment of hypertrophic and keloid scars[J]. Ann Anat,2009, 191 (1) : 33-44. DOI: 10.1016/j.aanat.2008.10.001. |
| [6] | Plasari G, Calabrese A, Dusserre Y, et al. Nuclear factor I-C links platelet-derived growth factor and transforming growth factor beta1 signaling to skin wound healing progression[J]. Mol Cell Biol,2009, 29 (22) : 6006-17. DOI: 10.1128/MCB.01921-08. |
| [7] | Lee DS, Yoon WJ, Cho ES, et al. Crosstalk between nuclear factor I-C and transforming growth factor-β1 signaling regulates odontoblast differentiation and homeostasis[J]. PLoS One,2011, 6 (12) : e29160. DOI: 10.1371/journal.pone.0029160. |
| [8] | Tan WQ, Gao ZJ, Xu JH, et al. Inhibiting scar formation in vitro and in vivo by adenovirus-mediated mutant Smad4: a preliminary report[J]. Exp Dermatol,2011, 20 (2) : 119-24. DOI: 10.1111/exd.2011.20.issue-2. |
| [9] | 张涛, 荣新洲, 杨荣华, 等. 积雪草苷对增生性瘢痕中转化生长因子-β mRNA 及基质金属蛋白酶类表达的影响[J]. 南方医科大学学报,2006, 26 (1) : 67-70. |
| [10] | Russo LM, Brown D, Lin HY. The soluble transforming growth factor-beta receptor: advantages and applications[J]. Int J Biochem Cell Biol,2009, 41 (3) : 472-6. DOI: 10.1016/j.biocel.2008.01.026. |
| [11] | Gronostajski RM. Roles of the NFI/CTF gene family in transcription and development[J]. Gene,2000, 249 (1/2) : 31-45. |
| [12] | Steele-Perkins G, Butz KG, Lyons GE, et al. Essential role for NFI-C/CTF transcription-replication factor in tooth root develo- pment[J]. Mol Cell Biol,2003, 23 (3) : 1075-84. DOI: 10.1128/MCB.23.3.1075-1084.2003. |
| [13] | Plasari G, Edelmann S, H?gger F, et al. Nuclear factor I-C regulates TGF-{beta}-dependent hair follicle cycling[J]. J Biol Chem,2010, 285 (44) : 34115-25. DOI: 10.1074/jbc.M110.120659. |
| [14] | Armour A1, Scott PG, Tredget EE. Cellular and molecular patho- logy of HTS: basis for treatment[J]. Wound Repair Regen,2007, Suppl 1 : S6-17. |
| [15] | Abdollahi A, Li M, Ping G, et al. Inhibition of platelet-derived growth factor signaling attenuates pulmonary fibrosis[J]. J Exp Med,2005, 201 (6) : 925-35. DOI: 10.1084/jem.20041393. |
| [16] | Chen YT, Chang FC, Wu CF, et al. Platelet-derived growth factor receptor signaling activates pericyte-myofibroblast transition in obstructive and post-ischemic kidney fibrosis[J]. Kidney Int,2011, 80 (11) : 1170-81. DOI: 10.1038/ki.2011.208. |
| [17] | Trojanowska M. Role of PDGF in fibrotic diseases and systemic sclerosis[J]. Rheumatology (Oxford),2008, 47 (Suppl 5) : v2-4. |
| [18] | Chen G, Ghosh P, Longo DL. Distinctive mechanism for sustained TGF-β signaling and growth inhibition: MEK1 activation- dependent stabilization of type Ⅱ TGF-β receptors[J]. Mol Cancer Res,2011, 9 (1) : 78-89. DOI: 10.1158/1541-7786.MCR-10-0216. |
| [19] | Song J, Xu H, Lu Q, et al. Madecassoside suppresses migration of fibroblasts from keloids: involvement of p38 kinase and PI3K signaling pathways[J]. Burns,2012, 38 (5) : 677-84. DOI: 10.1016/j.burns.2011.12.017. |
| [20] | Azahri NS, Di Bartolo BA, Khachigian LM, et al. Sp1, acetylated histone-3 and p300 regulate TRAIL transcription: mechanisms of PDGF-BB-mediated VSMC proliferation and migration[J]. J Cell Biochem,2012, 113 (8) : 2597-606. DOI: 10.1002/jcb.v113.8. |
| [21] | Zhao B, Chen YG. Regulation of TGF-β Signal Transduction[J]. Scientifica (Cairo),2014, 2014 : 874065. |
 2015, Vol. 35
2015, Vol. 35
