2. 甘肃省庆阳市人民医院肿瘤外科,甘肃 庆阳 745000 ;
3. 西安交通大学医学院第二附属医院急诊科,陕西 西安 710004
2. Department of Surgical Oncology, Qingyang People's Hospital, Qingyang 745000, China ;
3. Department of Emergency, Second Affiliated Hospital of Xi'an Jiaotong University College of Medicine, Xi'an 710004, China
胃癌是世界上最常见的恶性肿瘤之一[1]。目前,胃癌的总体预后仍然较差[2],其治疗方法以手术切除为主,辅以围手术期化疗、放疗或免疫治疗等[3]。但是,多数患者在诊断时已经处于进展期,即使接受根治性切除手术,术后仍然有高达42%的复发率[4];化疗等辅助治疗对预后的改善依然很有限[5]。这说明目前胃癌的治疗方案依然存在诸多限制,迫切需要加入新的治疗方法。中药是重要的药物开发来源,β-榄香烯(1-甲基-1-乙烯基-2,4-二异丙基环己烷,β-elemene)是从莪术油中提取的一种广谱抗肿瘤药物,是我国自行开发研制的国家二类非细胞毒性抗肿瘤新药,具有疗效确切、能促进化疗药物反应性、副作用轻微等优点[6],但具体的抗肿瘤机制仍有待进一步研究。
本课题组前期研究发现,β-榄香烯能够上调胃癌细胞PAK1IP1(p21-activated protein kinase-interacting protein 1)的表达[7]。PAK1IP1 是Pak1(p21-activated protein kinase 1)的负性调节蛋白,能够特异性结合Pak1 的N 端结合区,抑制Pak1 及其下游的ERK 信号分子的活化,从而负性调节肿瘤细胞的生长和存活[8]。Pak1和ERK作为维持和促进肿瘤细胞生长和存活的重要信号分子,在胃癌细胞中存在过度表达和活化,是胃癌治疗研究的重要作用靶点[9]。本研究观察β-榄香烯对胃癌细胞及正常胃黏膜上皮细胞生长和存活的影响,并探讨β-榄香烯对胃癌细胞Pak1、ERK 及凋亡相关蛋白表达的影响,以期为其临床应用提供参考和依据,为胃癌的临床治疗提供新的方向。
1 材料与方法 1.1 研究材料SGC7901 人胃癌细胞购于第四军医大学实验动物中心,GES-1人永生化正常胃黏膜上皮细胞由西安交通大学医学院中心实验室提供。β- 榄香烯乳剂(β-elemene)购买于大连金港制药有限公司,用含10% 胎牛血清、0.1% DMSO 的RPMI 1640 培养基稀释药物。Annexin V-FITC/PI凋亡检测试剂盒购于上海七海复泰生物科技有限公司。兔抗人t-Pak1 抗体、兔抗人phospho-Pak1(Thr423)抗体来自Abcam公司。兔抗人phospho-ERK1/2(Thr202/Tyr204)抗体来自南京凯基生物科技发展有限公司。兔抗人caspase-3(cleaved,17 000)抗体、兔抗人Bcl-2 抗体、兔抗人Bax 抗体来自北京博奥森生物技术有限公司,兔抗人GAPDH 抗体来自Santa Cruz公司。
1.2 细胞培养细胞用含10%胎牛血清的RPMI 1640 培养基在37 ℃、5% CO2 条件下培养,隔天换液,待生长至70%~80%致密度时,用0.25%的胰蛋白酶消化传代培养,一般传代稀释比例为1∶3至1∶4,待细胞生长至70%~80%致密度时用于实验用。
1.3 四甲基偶氮唑盐比色法(MTT)取对数生长期的细胞,按(5~10)×104 /孔接种至24 孔板内,每孔培养基1000 µL。待培养过夜后,按照不同的剂量给予β-榄香烯(0,20,30,40,60,80,120 µg/mL)处理,一定时间后,每孔加入50 µL MTT,继续培养3~4 h,离心并弃上清,每孔加入DMSO 500 µL 以溶解蓝紫色结晶甲臜,于震动摇床震荡混匀2 min使结晶完全溶解,选择490 nm 波长,用酶标仪测定各孔光吸收值(A),计算不同药物浓度的抑制率和药物在每个细胞的50%抑制浓度(IC50),绘制药物的剂效曲线。各实验孔A值统一减去调零值校正后,抑制率=1-实验组A值/对照组A值。
1.4 流式细胞术(FCM)检测细胞凋亡细胞按3~5×105个/孔接种至6 孔板内,次日给予β- 榄香烯(30 µg/mL)干预,对照组同时换液,待药物处理24 h后收集细胞,并按照Annexin V-FITC/PI双染法(按试剂盒说明书)预染细胞,30 min内上机检测,采用流式细胞术(Flow Cytometry,FCM)检测细胞凋亡。
1.5 流式细胞术(FCM)检测细胞周期待细胞生长至70%~80%致密度时,给予无血清培养基饥饿处理24 h,然后按照检测细胞凋亡的方法接种、干预并收集细胞,采用PI 单染法检测β-榄香烯(30 µg/mL)干预对SGC7901胃癌细胞周期分布的影响。
1.6 平板克隆形成实验细胞按200 个/孔接种于六孔板内,待4~6 h 贴壁后,实验组给予β-榄香烯(30 µg/mL)处理,对照组给予更换相同的培养基,继续培养10~14 d,待形成肉眼可见的集落时终止培养,PBS 清洗3 遍,甲醇固定15 min,用0.1%结晶紫溶液染色20 min,流水缓慢冲洗后晾干,计数大于50个细胞的克隆,计算克隆形成率。
1.7 免疫印迹实验(Western blots)SGC7901胃癌细胞经30 µg/mL β-榄香烯处理48 h 后提取总蛋白并进行定量,相同质量的蛋白样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白转印至硝酸纤维素膜(NC 膜),用5%~10%脱脂牛奶封闭2~3 h,孵育一抗4 ℃过夜,0.5% TBST缓冲液洗膜,室温孵育二抗1 h,再次洗膜后用ECL化学发光法检测结果。
1.8 统计学方法数据以均数±标准差表示,采用SPSS 17.0 软件对数据进行统计学分析,两组间比较采用Student's t 检验。P<0.05表示差异具有统计学意义。
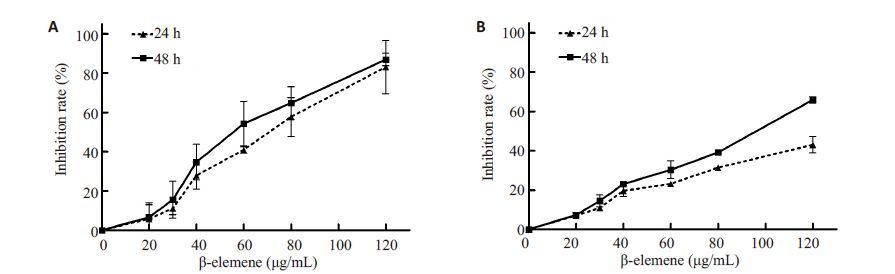
2 结果 2.1 β-榄香烯对SGC7901 胃癌细胞和GES-1 正常胃黏膜上皮细胞活性的影响β-榄香烯处理24 h 和48 h 后,对SGC7901 胃癌细胞和GES-1 正常胃黏膜上皮细胞的活性均具有显著的抑制作用,并呈剂量和时间依赖性(图 1)。β-榄香烯对SGC7901 胃癌细胞作用24 h 和48 h 的IC50 分别为67.2 µg/mL 和56.9 µg/mL,对GES-1 正常胃黏膜上皮细胞作用24 h 和48 h 的IC50 分别为151.9 µg/mL 和µg/mL。
|
图 1 β-榄香烯对SGC7901胃癌细胞和GES-1正常胃黏膜上皮细胞活性的抑制作用 Figure 1 β-elemene inhibits the viability of gastric cancer SGC7901 cells (A) and non-cancer gastric mucosal epithelial GES-1 cells (B). |
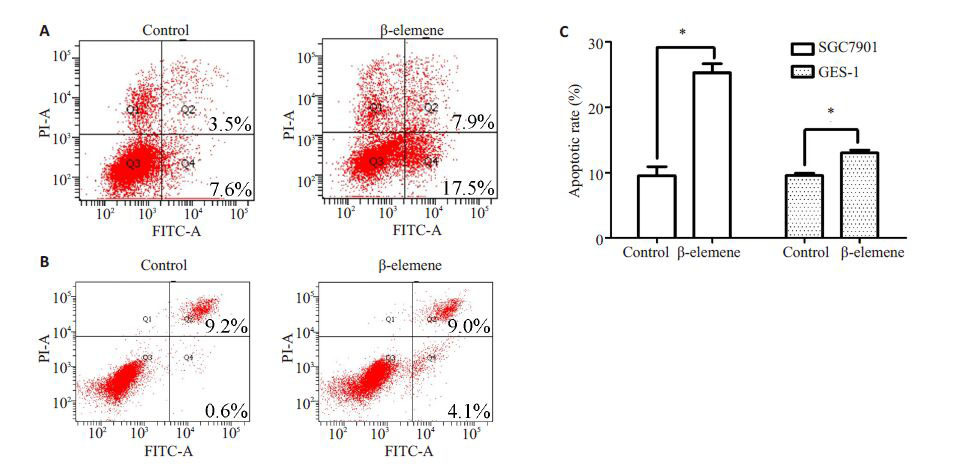
采用对SGC7901 胃癌细胞接近50% IC50 浓度30 μg/mL β-榄香烯处理24 h,显著增加了SGC7901 胃癌细胞的凋亡水平(图 2A,C),而相同浓度的β-榄香烯处理后,GES-1正常胃黏膜上皮细胞的凋亡水平亦有增加(图 2B,C),但其凋亡诱导作用明显弱于SGC7901胃癌细胞。
|
图 2 β-榄香烯对SGC7901 胃癌细胞和GES-1 正常胃黏膜上皮细胞凋亡的影响 Figure 2 Flow cytometry of β-elemene-induced apoptosis of SGC7901 cells (A) and GES-1 cells (B) and statistical analysis (C). *P<0.05. |
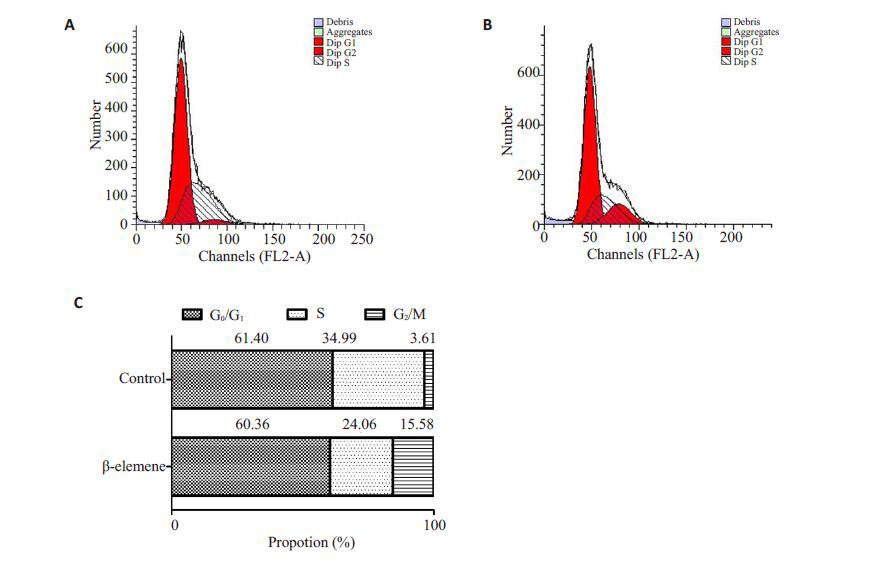
经过β-榄香烯(30 µg/mL)处理24 h后,SGC7901细胞的S期细胞比例减少,G2/M期细胞比例增加(图 3)。
|
图 3 β-榄香烯对SGC7901胃癌细胞周期分布的影响 Figure 3 Effects of β-elemene on cell cycle distribution in SGC7901 cells. A: Control group; B: β-elemene-treated group; C: Statistical analysis of cell cycle distribution. |
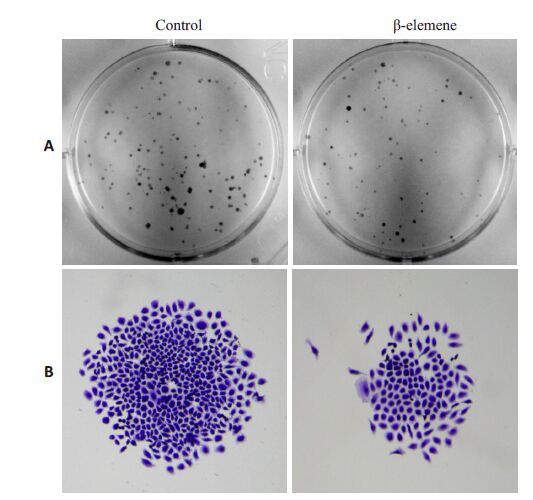
我们采用克隆形成实验观察β-榄香烯对SGC7901 细胞单细胞集落形成能力的影响,结果发现,经过β-榄香烯(30 µg/mL)处理后,SGC7901 细胞的克隆形成率显著降低(图 4A),同时,所形成集落的大小及集落所包含的细胞数量低于对照组(图 4B)。
|
图 4 β-榄香烯对SGC7901胃癌细胞克隆形成的影响 Figure 4 Effects of β-elemene on clonogenic survival in SGC7901 cells observed macroscopically (A) and under microscope (B). |
根据细胞学实验的结果及本课题组前期研究,我们进一步检测了β-榄香烯对SGC7901 胃癌细胞相关蛋白表达的影响。β-榄香烯降低了Bcl-2 蛋白表达水平,增加了Bax 和活化的Caspase-3(17Kd)表达水平。β-榄香烯降低了Pak1(Thr423)和ERK1/2 的磷酸化水平,但对Pak1的总蛋白表达无明显影响(图 5)。
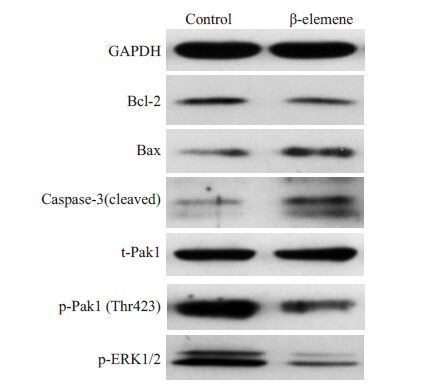
|
图 5 β-榄香烯对SGC7901 胃癌细胞蛋白表达的影响 Figure 5 Effects of β-elemene on protein expression in SGC7901 cells. |
目前胃癌的治疗方案是以手术为主[8],辅以围手术期化疗、放疗或免疫治疗,但是我国胃癌的早期诊断率低,多数患者在诊断时已经处于进展期,存在淋巴结播散、腹膜与脏器侵袭和转移,可能已经超出了手术的根治效能。化疗的总体疗效仍然不理想,且存在明显的个体差异和副作用[5],放疗抵抗则一直限制放疗在胃癌治疗中的开展[10],这些因素的存在使胃癌患者总体远期预后仍然不理想。因此,开发新的药物以提高胃癌的治疗效果显得尤为重要。β-榄香烯是我国自主研发的国家二类抗肿瘤新药,已经作为一线化疗药物的联合或替代药物在临床用于部分肿瘤的辅助治疗,并显示出一定的治疗价值[11-12],但是其抗肿瘤作用的分子机制尚不完全清楚。体外研究也发现,β-榄香烯能够抑制多种肿瘤细胞的生长,诱导肿瘤细胞凋亡,可能的分子机制包括抑制ERK和PI3K/Akt信号通路的活化[13]、调控Bcl-2家族蛋白的表达[14]、下调survivin 基因的表达[15]等。而在胃癌细胞中的作用机制尚有待进一步研究。本研究发现β-榄香烯能够抑制SGC7901 胃癌细胞增殖、诱导凋亡,并能够诱导SGC7901胃癌细胞发生G2/M期阻滞,而对正常胃黏膜细胞GES-1的毒性作用轻微,其对胃癌细胞的抗肿瘤作用可能与抑制Pak1/ERK 信号通路的活化、 调控凋亡相关蛋白的表达有关。
PAK 是一个丝/苏氨酸蛋白激酶家族,由六个成员组成(Pak1-Pak6),在多种肿瘤组织中存在过表达或过度活化,可调控肿瘤细胞的多种生长相关信号通路及细胞运动、存活、增殖、转录等多种生物学行为,是重要的肿瘤治疗作用靶点,其中以Pak1 研究较多[16]。Pak1 的激酶活化主要通过自身氨基酸残基的磷酸化而实现,其中,第423 位苏氨酸残基(Thr423)的磷酸化水平决定着Pak1 的整体活化水平[17]。近来研究发现,Pak1 在胃癌组织和细胞中存在过度表达和活化,并促进胃癌的进展、侵袭转移,与胃癌患者的预后呈负相关,通过下调Pak1 的活性能够抑制胃癌细胞的生长、存活和侵袭运动,所以Pak1 是胃癌的潜在预后因子和治疗靶点[18-19]。ERK 分子及其信号通路则是细胞生长和存活所必须的基本信号通路之一。研究发现,Pak1 位于ERK 信号通路的上游,可通过激酶依赖或非激酶依赖的方式激活ERK 信号通路,从而促进肿瘤细胞的生长和存活[16, 20]。本研究首次发现β-榄香烯能够降低胃癌细胞Pak1(Thr423)及其下游ERK1/2 的磷酸化水平,而对Pak1 的总表达水平无明显影响,说明β-榄香烯可能通过调控Pak1/ERK信号通路而抑制胃癌细胞增殖和诱导胃癌细胞凋亡。
Bcl-2 蛋白家族是调控细胞存活和凋亡的重要蛋白质基础,其中,Bcl-2 是抑制凋亡蛋白,Bax 是促凋亡蛋白,Bcl-2/Bax 比例可以调控细胞存活或凋亡,Bcl-2 表达下调或Bax 表达上调可以促进凋亡的发生,Bad 则通过与Bcl-2 结合成复合体而抑制Bcl-2 发挥作用;Caspase-3 则是凋亡发生的执行者,标志着细胞凋亡的发生水平[21]。研究发现,Pak1 可能通过Pak1/ Raf1/Bad 信号通路,磷酸化Bad,抑制Bad 与Bcl-2 结合,使Bcl-2活性增加,从而抑制细胞凋亡[22]。本研究发现,β-榄香烯能够诱导胃癌细胞凋亡,其可能通过抑制Pak1 活性,从而下调Bcl-2 表达,上调Bax 和caspase-3的表达,这与既往的研究结论一致[14]。
另外,本研究首次评价了β-榄香烯对正常胃黏膜上皮细胞增殖和凋亡的影响,β-榄香烯对正常胃黏膜上皮细胞的增殖抑制作用明显弱于胃癌细胞,对正常胃黏膜上皮细胞的24 h IC50是SGC7901胃癌细胞的2.26倍;β-榄香烯对正常胃黏膜上皮细胞的凋亡诱导效应也明显弱于SGC7901 胃癌细胞。本研究结果说明β-榄香烯生长抑制和凋亡诱导作用在肿瘤细胞和正常细胞之间存在明显的差异,在发挥抗肿瘤作用的同时,不会对正常组织产生明显的毒副作用,具有良好的安全性。
综上所述,β-榄香烯可能通过抑制Pak1/ERK 信号通路的活化,调控Bcl-2、Bax 及Caspase-3 等凋亡相关蛋白的表达,抑制胃癌细胞增殖,促进胃癌细胞凋亡,而其抗肿瘤剂量对正常胃黏膜细胞无明显的毒副作用。本研究将为β-榄香烯的临床应用及其抗肿瘤机制研究提供参考和依据。
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010, 127 (12) : 2893-917. DOI: 10.1002/ijc.v127:12. |
| [2] | Zhang H, Sun LL, Meng YL, et al. Survival trends in gastric cancer patients of Northeast China[J]. World J Gastroenterol,2011, 17 (27) : 3257-62. |
| [3] | Saka M, Morita S, Fukagawa T, et al. Present and future status of gastric cancer surgery[J]. Jpn J Clin Oncol,2011, 41 (3) : 307-13. DOI: 10.1093/jjco/hyq240. |
| [4] | D'angelica M, Gonen M, Brennan MF, et al. Patterns of initial recurrence in completely resected gastric adenocarcinoma[J]. Ann Surg,2004, 240 (5) : 808-16. DOI: 10.1097/01.sla.0000143245.28656.15. |
| [5] | GASTRIC(Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group, Paoletti X, Oba K, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer: a meta-analysis[J]. JAMA,2010, 303 (17) : 1729-37. DOI: 10.1001/jama.2010.534. |
| [6] | Tan W, Lu J, Huang M, et al. Anti-cancer natural products isolated from Chinese medicinal herbs[J]. Chin Med,2011, 6 (1) : 27-41. DOI: 10.1186/1749-8546-6-27. |
| [7] | Liu JS, He SC, Zhang ZL, et al. Anticancer effects of β-elemene in gastric cancer cells and its potential underlying proteins: a proteomic study[J]. Oncol Rep,2014, 32 (6) : 2635-47. |
| [8] | Xia C, Ma W, Stafford LJ, et al. Regulation of the p21-activated kinase(PAK)by a human Gbeta -like WD-repeat protein, hPIP1[J]. Proc Natl Acad Sci USA,2001, 98 (11) : 6174-9. DOI: 10.1073/pnas.101137298. |
| [9] | Vadlamudi RK, Kumar R. p21-activated kinases in human cancer[J]. Cancer Metastasis Rev,2003, 22 (4) : 385-93. DOI: 10.1023/A:1023729130497. |
| [10] | Tsutsui M, Takahashi T, Saikawa Y, et al. Chemoradiotherapy for highly advanced gastric cancer[J]. J Clin Oncol,2014, 32 (3) : 546. |
| [11] | Xu HB, Zheng LP, Li L, et al. Elemene, one ingredient of a Chinese herb, against malignant tumors: a literature-based meta-analysis[J]. Cancer Invest,2013, 31 (2) : 156-66. DOI: 10.3109/07357907.2012.756108. |
| [12] | Wang B, Peng XX, Sun R, et al. Systematic review of β-Elemene injection as adjunctive treatment for lung cancer[J]. Chin J Integr Med,2012, 18 (11) : 813-23. DOI: 10.1007/s11655-012-1271-9. |
| [13] | Zhan YH, Liu J, Qu XJ, et al. β-Elemene induces apoptosis in human renal-cell carcinoma 786-0 cells through inhibition of MAPK/ERK and PI3K/Akt/mTOR signalling pathways[J]. Asian Pac J Cancer Prev,2012, 13 (6) : 2739-44. DOI: 10.7314/APJCP.2012.13.6.2739. |
| [14] | Li QQ, Lee RX, Liang H, et al. Anticancer activity of β-Elemene and its synthetic analogs in human malignant brain tumor cells[J]. Anticancer Res,2013, 33 (1) : 65-76. |
| [15] | Chen X, Wang Y, Luo H, et al. β-elemene acts as an antitumor factor and downregulates the expression of survivin, Bcl-xL and Mta-1[J]. Mol Med Rep,2012, 6 (5) : 989-95. |
| [16] | Dummler B, Ohshiro K, Kumar R, et al. Pak protein kinases and their role in cancer[J]. Cancer Metastasis Rev,2009, 28 (1) : 51-63. |
| [17] | Zenke FT, King CC, Bohl BP, et al. Identification of a central phosphorylation site in p21-activated kinase regulating autoinhi- bition and kinase activity[J]. J Biol Chem,1999, 274 (46) : 32565-73. DOI: 10.1074/jbc.274.46.32565. |
| [18] | Liu F, Li X, Wang C, et al. Downregulation of p21-activated kinase-1 inhibits the growth of gastric cancer cells involving cyclin B1[J]. Int J Cancer,2009, 125 (11) : 2511-9. DOI: 10.1002/ijc.v125:11. |
| [19] | He H, Baldwin GS. p21-activated kinases and gastrointestinal cancer[J]. Bioch Et Bioph Acta,2012, 1833 (1) : 33-9. |
| [20] | Wang Z, Fu M, Wang L, et al. p21-activated kinase 1(PAK1)can promote ERK activation in a kinase-independent manner[J]. J Biol Chem,2013, 288 (27) : 20093-9. DOI: 10.1074/jbc.M112.426023. |
| [21] | Strasser A, O'Connor L, Dixit VM. Apoptosis signaling[J]. Annu Rev Biochem,2000, 69 : 217-245. DOI: 10.1146/annurev.biochem.69.1.217. |
| [22] | Schürmann A, Mooney AF, Sanders LC, et al. p21-activated kinase 1 phosphorylates the death agonist bad and protects cells from apoptosis[J]. Mol Cell Biol,2000, 20 (2) : 453-61. DOI: 10.1128/MCB.20.2.453-461.2000. |
 2015, Vol. 35
2015, Vol. 35
