2. 解放军军事医学科学院放射与辐射研究所,北京 100850
2. Beijing Institute of Radiation Medicine, Beijing 100850, China
前列腺癌是威胁老年男性生命健康的常见肿瘤之一,西方发达国家其发病率排在男性恶性肿瘤发病率首位,死亡率位居第2 位[1]。2012 中国肿瘤登记年报统计数据显示前列腺癌是我国男性发病排名第6 位的恶性肿瘤,其发病率和死亡率逐年上升。这与医疗水平的提高,人民寿命的延长,生活方式的不合理以及前列腺癌筛查的推广普及等因素有关。研究发现FoxM1 在肝癌、皮肤癌和肺癌等多种人类肿瘤组织中的表达异常,并与肿瘤病人预后有相关性[2-4]。研究表明FoxM1参与了肿瘤的增殖、转移、耐药等多种致病机制[5],本课题组前期研究发现FoxM1在人前列腺癌中的表达量增加[6],但对其在前列腺癌中的作用机制有待进一步的深入研究。RNA 干扰技术因是研究基因功能的重要方法,慢病毒载体作为介导RNA干扰的工具能够将目的基因整合到宿主细胞内,使细胞中基因长期稳定低表达[7]。本研究将构建携载绿色荧光蛋白(GFP)的FoxM1 shRNA 慢病毒载体,并建立人前列腺癌稳定细胞株,观察和鉴定其转染效率和干扰效率,为进一步研究FoxM1 在体内外对前列腺癌细胞及组织的作用奠定基础。
1 材料与方法 1.1 主要试剂及仪器质粒抽提试剂盒购于康为世纪公司,逆转录试剂盒、Real-timePCR 试剂盒购自TOYOBO,Trizol、Lipo- fectamine 2000、MTT 购自Invitrogen,载体pHBLV- U6-ZsGreen-Puro 购于汉恒生物科技有限公司(上海),大肠杆菌菌株DH5α购于Invitrogen,限制性内切酶、T4连接酶、DNA ladder购于Fermentas,凝胶回收试剂盒购于Axygen,慢病毒包装系统汉恒生物科技有限公司(上海),嘌呤霉素购自美国Sigma,细胞培养基RPMI 1640 培养基购自Gibco,胎牛血清FBS购自HyClone,兔抗人FoxM1 购自Abcam,鼠抗人GADPH 购自Santa,羊抗兔、兔抗鼠二抗购自北京中杉金桥生物技术有限公司,凋亡试剂盒Annexin V-APC Apoptosis Analysis Kit 购于天津三箭生物技术有限公司。
1.2 FoxM1 shRNA慢病毒载体的构建及鉴定根据Genebank 中人FoxM1 基因序列设计特异性针对FoxM1 基因的3 条shRNA 序列上下游分别加入BamHⅠ,EcoRⅠ酶切位点:
(1)FoxM1 shRNA1:5'-GATCCGGGCCCAACA GGAGTCTAATCAACTCGAGTTGATTAGACTCCT- GTTGGGCTTTTTTC-3'
5'-AATTGAAAAAAGCCCAACAGGAGTCTAA TCAACTCGAGTTGATTAGACTCCTGTTGGGCCC G-3'
(2)FoxM1 shRNA2:5'-GATCCGCACTATTCAA CAATAGCCTATTTCAAGAGAATAGGCTATTGTT- GATAGTGCTTTTTTC-3'
5'-AATTGAAAAAAGCACTATCAACCAATAG CCTATTCTCTTGAAATAGGCTATTGTTGATAGTG CG -3'
(3)FoxM1 shRNA3:5'-GATCCGCCAATCGTT CTCTGACAGAAGTTCAAGAGATTCTGTCAGAG AACGATTGGCTTTTTTC-3'
5'-AATTGAAAAAATGGGAATGGAAGGATCT GTTAAAGCACATAACAGATCCTTCCATTCCCAC G-3'
对照组Scramble,即Lv-Scramble序列:
5'-GATCCTTCTCCGAACGTGTCACGTAATTC AAGAGATTACGTGACACGTTCGGAGAATTTTTT G-3'
5'-AATTCAAAAAATTCTCCGAACGTGTCAC GTAATCTCTTGAATTACGTGACACGTTCGGAGA- AG-3'
引物由上海桑尼生物合成,分别稀释至100 μmol/L,之后进行退火反应,退火程序为95 ℃,10 min;75 ℃,10 min;55 ℃,10 min;35 ℃,10 min;15 ℃,10 min。使用BamHⅠ,EcoRⅠ双酶切对pHBLV-U6-ZsGreen-Puro 载体进行酶切之后胶回收载体片段。将FoxM1 shRNA 片段与载体连接反应,4 ℃过夜。将连接反应混合物转化大肠杆菌DH5α,37 ℃过夜。挑取单克隆后37 ℃摇菌14 h,菌液送上海桑尼生物技术有限公司测序。鉴定正确后大量扩增慢病毒质粒。
1.3 重组慢病毒的包装及滴度测定制备慢病毒穿梭质粒及其辅助包装原件载体质粒,3 种质粒(pSPAX2,pMD2G,pHBLV-U6-FoxM1 shRNA-ZsGreen-Puro)载体分别进行高纯度无内毒素抽提,按LipofectaminTM2000 转染试剂说明书共转染293T 细胞,转染后6 h 更换为完全培养基,培养48 h 和72 h后,收集富含慢病毒颗粒的细胞上清液,0.45 μm滤器过滤病毒上清液,病毒上清液通过超离心浓缩病毒。对其浓缩后得到高滴度的慢病毒浓缩液。分装后-80 ℃中保存病毒液
采用稀释计数法测定各组病毒滴度。第1 天将生长状态良好的293T 细胞消化计数后稀释至1×104/mL,加入96孔板,100 μL /孔,为每个病毒准备6个孔。放入37 ℃,5% CO2 培养箱中培养。第2 天做6 个稀释度(10-3.3×10-2),加入对应的96孔板中。24 h后更换培养基,定期观察。48 h后在荧光显微镜下观察结果,荧光百分比在10%~30%的孔计算病毒滴度。滴度(PFU/mL)=细胞数×荧光百分比×MOI(1)×病毒稀释倍数×103。
1.4 细胞培养人前列腺癌细胞DU-145 由军事医学科学院生物工程研究所周建光教授提供。复苏冻存的DU-145 细胞,重悬于含10% FBS 的RPMI 1640 培养基中,加入1%谷氨酰胺及1%青链霉素。置于25 cm2 培养瓶,37 ℃、5% CO2 细胞培养箱中培养。每1~2 d 换液1 次,待细胞80%~90%融合后用0.25%胰酶消化传代。
1.5 慢病毒载体转染细胞及相关检测DU-145细胞接种于6孔板中,5×105/孔,细胞60%~ 70%融合时加入慢病毒进行感染,24 h更换培养基,48 h后荧光显微镜下观察GFP 表达效率。加入嘌呤霉素进行筛选,每24 h更换含嘌呤霉素的培养基,2 d传代1次,0.25%胰酶消化传代,传代3~4次后收集细胞。
1.6 Real time PCR 检测FoxM1 mRNA 表达筛选有效干扰慢病毒载体Trizol 法提取慢病毒感染的DU-145 细胞总RNA,逆转录试剂盒逆转录cDNA,实时荧光定量PCR 检测细胞内FoxM1 mRNA表达水平,内参为GAPDH。反应条件:95 ℃预变性15 min,95 ℃ 5 s,64 ℃退火30 s,40个循环。引物序列为:FoxM1:(目的产物片段大小220 bp):上游引物:5'-GGACCAGGTGTTTAAGCAGCA G-3'; 下游引物:5'-CAATGCGGACTCGCTTGCTA T-3';GADPH(目的片段大小137 bp):上游引物:5'-GCAC CGTCAAGGCTGAGAAC-3';下游引物:5'-TGGTGAAGACGCCAGTGGA-3';由上海生工生物公司合成。
1.7 细胞生长活性及细胞克隆能力 1.7.1 MTT法检测感染后细胞生长活性取感染后对数生长的细胞,胰酶消化后制备单细胞悬液,以1×104/孔接种于96孔板,每个时间点设3个复孔,定时加入20 μL MTT,孵育4 h 后加入DMSO,之后酶标仪检测490 nm波长处吸光度值,连续检测8 d,绘制生长曲线。
1.7.2 平板克隆实验检测细胞克隆能力取感染后对数生长的细胞,制备细胞悬液;稀释悬液,种于培养皿;轻轻晃动,使细胞均匀分布。细胞培养箱中培养2~3 周; 经常观察,当看到有克隆形成时,终止培养;染色:a.PBS轻柔洗3次;b.多聚甲醛固定15 min;c.去除固定液,结晶紫染色,30 min;d.洗净染色液,室温干燥。倒置平皿,叠加带格的透明胶片,显微镜下计数细胞克隆数。
1.8 细胞FoxM1蛋白表达及凋亡检测 1.8.1 Western blot检测FoxM1蛋白表达收集细胞,加入细胞裂解液,提取总蛋白,等量蛋白上样,经SDS-PAGE 电泳、转膜、5%脱脂牛奶室温封闭1 h、分别加一抗兔抗人FoxM1(1∶500)及鼠抗人GADPH(1∶ 1000)4 ℃孵育过夜,TBST 洗膜3 次,每次10 min,羊抗兔、兔抗鼠二抗(1∶2000)分别室温孵育1 h,TBST 洗膜3次,每次10 min,DAB显色检测蛋白表达。
1.8.2 流式细胞仪检测细胞凋亡细胞凋亡检测:感染后的稳定细胞株,胰酶消化后制备1×106悬浮液,重悬至预冷的PBS 中;将细胞悬浮在1×Binding Buffer 中,300 g 离心10 min,弃去Binding Buffer;细胞重悬在1 mL 1 × Binding Buffer 中;每管加入100 μL 细胞,5 μL Annexin V-APC;轻轻振荡,室温孵育5 min,避光;加入5 μL PI溶液室温孵育5 min,避光;加入500 μL PBS,轻轻混匀;上机检测。
1.9 统计学方法数据以均数±标准差表示,采用SPSS 13.0 统计软件分析,两组间均数比较采用t 检验,多组间均数比较采用方差分析,P≤0.05为差异有统计学意义。
2 结果 2.1 重组慢病毒载体的构建及鉴定慢病毒载体pHBLV-U6-ZsGreen-Puro(图 1)经过酶切后的片段在1%琼脂糖凝胶电泳中的条带大小为7.7 kb(图 2)。其与合成的3对FoxM1 shRNA连接产物得到的重组质粒,经过转化大肠杆菌DH5α,挑菌,37 ℃摇菌过夜,送公司测序鉴定,结果表明3 个FoxM1 shRNA慢病毒载体构建成功(图 3)。
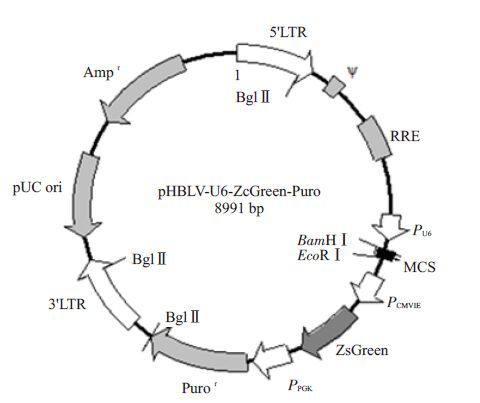
|
图 1 pHBLV-U6-ZsGreen-Puro干扰载体图谱 Figure 1 Structure map of the lentiviral vector pHBLV-U6- ZsGreen-Puro. |
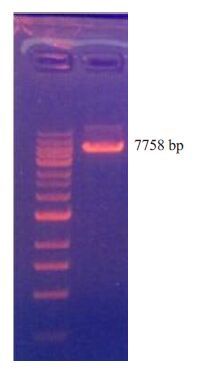
|
图 2 pHBLV-U6-ZsGreen-Puro 干扰载体 Figure 2 Identification of the lentiviral vector pHBLV-U6-ZsGreen-Puro. |
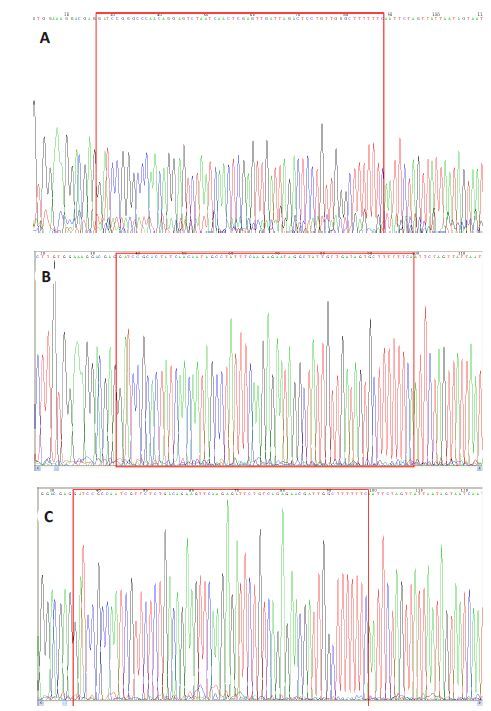
|
图 3 FoxM1 shRNA慢病毒载体测序结果 Figure 3 Identification of the lentiviral vector pHBLV-U6-ZsGreen- Puro. A: FoxM1 shRNA1; B: FoxM1 shRNA2; C: FoxM1 shRNA3. |
三质粒共转染293T 细胞,48 h 后细胞出现融合现象,荧光显微镜下观察到较强的绿色荧光(图 4)。转染效率高,病毒包装成功。干扰组对照滴度=4×104×10%× MOI(1)×病毒稀释倍数(30)×103=1.2 ×108 PFU/mL,FOXM1 shRNA 滴度=4×104×10%×MOI(1)×病毒稀释倍数(30)×103=1.2×108 PFU/mL。滴度(PFU/mL)=细胞数×荧光百分比×MOI(1)×病毒稀释倍数×103。
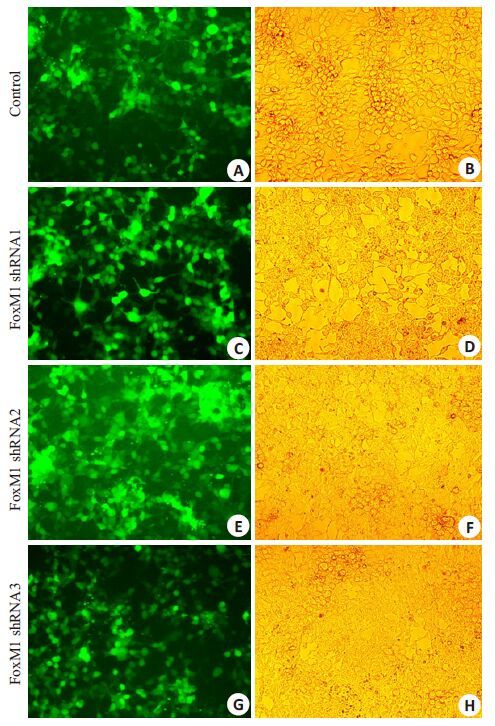
|
图 4 FoxM1 shRNA慢病毒包装后荧光显微镜下观察293T 细胞 Figure 4 Fluorescence of 293T cells packaging FoxM1 shRNA lentiviral vectors (Original magnification: ×100). A,B: Control; C,D: FoxM1 shRNA1; E,F: FoxM1 shRNA2; G,H: FoxM1 shRNA3. |
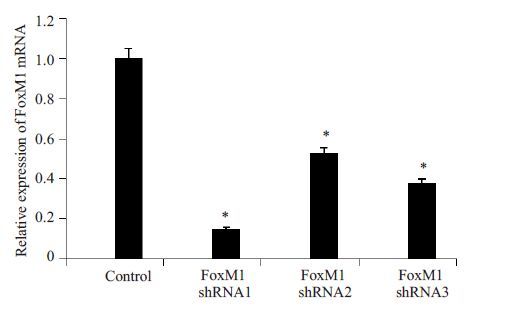
各组慢病毒感染DU-145 细胞48 h 后,细胞生长状态良好,转染效率较高。Real-time PCR 结果显示:3 对FoxM1 shRNA 病毒载体感染后的DU-145 细胞中FoxM1 mRNA表达水平较空白载体组显著降低(图 5),FoxM1 shRNA1的敲低效果最为显著,因此确定其为筛干扰效果较好的慢病毒载体,大量包装慢病毒以备后续实验。病毒感染细胞后经嘌呤霉素筛选后的细胞形态学无明显变化,生长状态良好,稳定表达绿色荧光(图 6)。
|
图 5 FoxM1 shRNA 转染细胞后Real time-PCR 检测FoxM1 mRNA的表达 Figure 5 Relative expression of FoxM1 mRNA in lentivirus transduced DU145 cells detected by real-time PCR. *P<0.05 vs control. |
|
图 6 荧光显微镜下观察FoxM1 shRNA慢病毒转染染DU-145细胞 Figure 6 Fluorescence and bright-field images of DU145 cells after lentiviral transduction (Original magnification: ×40). A: Control; B: FoxM1 shRNA. |
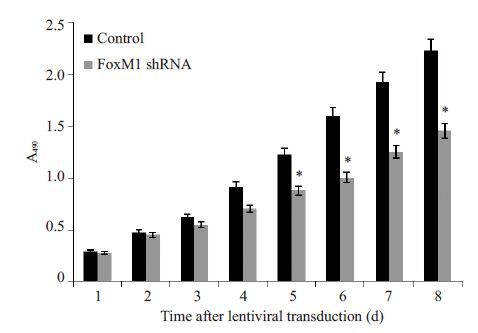
FoxM1 shRNA1 稳定转入的DU-145 细胞培养8 d 后,MTT 法检测96 孔板各孔490 nm 波长处的吸光度值,绘制出细胞的生长曲线(图 7),较空白载体组,稳定表达FoxM1 shRNA1 的DU-145 细胞生长速度明显减慢,两组之间差异有统计学意义(P<0.05),说明抑制FoxM1表达能够抑制DU-145细胞的生长增殖能力。
|
图 7 FoxM1 shRNA慢病毒转染后DU-145细胞生长曲线 Figure 7 Cell growth of DU145 cells. *P<0.05 vs control. |
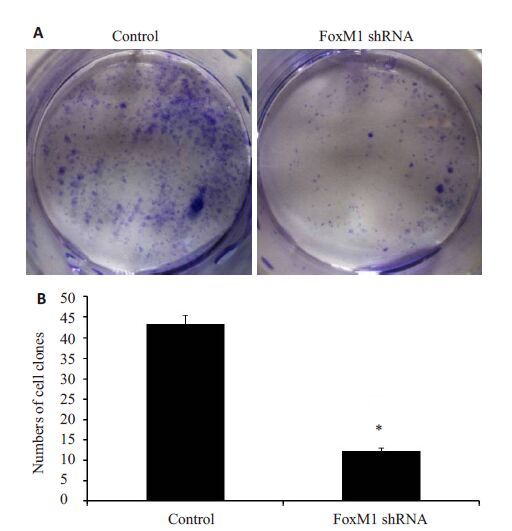
建立好的FoxM1 敲低稳定细胞株,选取生长状态良好的细胞,接种2 周后,显微镜下观察形成克隆数(图 8)。在FoxM1 敲低组,细胞形成克隆数目少,克隆小,克隆率显著低于正常组(P<0.05)。说明FoxM1 能够促进前列腺癌细胞增殖和克隆形成。
|
图 8 FoxM1 shRNA转染细胞后细胞克隆形成能力 Figure 8 Colony formation of FoxM1 shRNA-transfected cells. *P<0.05 vs control. |
应用Western blot 检测FoxM1 shRNA1 稳转DU-145 细胞内FoxM1 蛋白水平表达,结果显示: FoxM1 蛋白水平表达较空白载体组显著降低,表达水平分别为对照组3.95±0.435,FoxM1 敲低组1.82±0.132(P<0.05,图 9)。
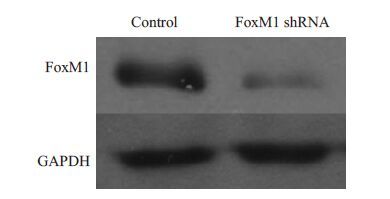
|
图 9 FoxM1 shRNA 转染细胞后Western Blot检测FoxM1蛋白的表达 Figure 9 Expression of FoxM1 protein in cells detected by Western blotting. |
图 10流式细胞术结果显示,对照组、FoxM1敲低组DU-145 细胞凋亡率分别为(10.647 ± 0.653)% 和(14.877±0.460)%,两组间具有显著差异,P<0.05。结果表明FoxM1敲低组细胞凋亡率高于对照组。
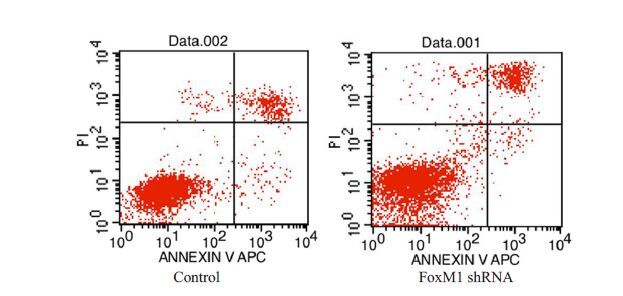
|
图 10 FoxM1 shRNA转染细胞后流式细胞仪检测细胞凋亡增加 Figure 10 Increased apoptosis of FoxM1 shRNA-transfected cells detected by flow cytometry. |
叉头框(Fox)转录因子家族成员FoxM1 在多种肿瘤细胞中表达异常增加[2-4]。FoxM1 参与多个肿瘤致病转移环节,包括细胞周期与增殖、细胞衰老、血管生成、 迁移浸润及化疗后药物抵抗等[5]。研究发现前列腺上皮细胞中FoxM1参与前列腺癌发生密切相关[8],前列腺癌组织中FoxM1表达量明显增高[9],本研究团队前期研究发现FoxM1 参与前列腺癌转移[6]。FoxM1 在肿瘤的致病、转移、治疗、耐药等多个环节有重要作用,但是具体的作用机制尚不明确,有待深入研究。
生物学研究中,病毒成为将DNA或RNA传递进入细胞的有效载体。病毒复杂的结构利于其进入细胞、转运基因以及整合靶细胞基因组以表达病毒的基因组,因此在基因传递载体中是最为高效的[10]。来源于逆转录家族的病毒具有独特的优势,它们能够将自己的RNA 转换成DNA并整合至靶细胞的染色体中[11]。慢病毒载体用于基因传递已经有20 多年历史了,它具有以下特征:能够将载体整合至宿主基因组中,稳定传递基因;具有感染分裂和非分裂细胞的能力;具有广泛的组织嗜性;病毒转导后不表达病毒蛋白;传递复杂的多顺反子或包含内含子序列的遗传元件;更为安全的整合位点谱以及相对容易的病毒操作和生产体系[11]。人免疫缺陷病毒(HIV)是目前较为常用的慢病毒载体[12]。关于其安全性在学术界也有过争论,一种观点认为非HIV载体更为安全,因为它们来源于不感染人类的病毒;而另外一种观点认为,来源于分子生物学以及发病机制已为人知,有多重药物治疗方法的病毒相对较在人体致病机制尚不清楚的病毒更为安全[13]。HIV 病毒除了其在分裂和非分裂细胞中稳定的整合转基因能力外,还拥有较其他病毒更低的插入突变诱发率[14]。
慢病毒载体的应用包括稳定的转基因过表达,持续的基因沉默,免疫,活体成像,制备转基因动物,诱导多能细胞等[7]。慢病毒因其能够有效转导非分裂细胞,抗原递呈细胞而成为具有潜力的疫苗递送载体。在小鼠恶性黑色素瘤模型中,慢病毒介导的肿瘤特异免疫能够抑制肿瘤的活性[15];慢病毒载体是制备转基因动物的研究工具,目前采用此技术成功生产了不同种类的转基因动物,包括小鼠、大鼠、猪、牛、猴子和鸟类[16],慢病毒技术产生的转基因动物具有较高的转基因表达水平和更高的生存率,且未观察到副反应[17];慢病毒载体在肿瘤的免疫基因治疗方面也取得了很大进展,研究认为慢病毒载体能够用于产生以树突状细胞为基础的抗肿瘤疫苗并将肿瘤特异受体递送给T 细胞,也能通过调节凋亡、放疗化疗和血管生成等相关分子调节肿瘤细胞及其进展[18];在基因功能研究中,抑制基因表达的RNA 干扰技术采用慢病毒作为载体已经比较成熟[19-20],近期还有研究者通过慢病毒过表达miRNA靶序列从而在活体稳定敲低miRNA 功能的研究[21];慢病毒在体在活体成像领域也有重要的地位,从起初的将绿色荧光蛋白转入细胞到后来的萤火虫荧光素酶基因转入人胚胎干细胞以监测其在活体动物中的生长情况[22-23]。
本实验设计合成了3条FoxM1的siRNA和shRNA 序列,分别将其连接在表达GFP和嘌呤霉素的慢病毒载体pHBLV-U6-ZsGreen-Puro 上,继而包装病毒并得到了高低度的FoxM shRNA 慢病毒载体。用病毒液感染人前列腺癌细胞DU-145,real-time PCR 结果筛选到1 条干扰效率较高的慢病毒载体。携带GFP 的慢病毒载体转染细胞,利用细胞发出荧光的强度和数量直观地观察转染效率;建立稳定转染的细胞株,移植在活体动物后可以实现活体成像。本实验利用慢病毒载体干扰前列腺癌细胞中FoxM1的表达后,Western bloting检测到细胞内FoxM1 的表达水平显著降低,细胞的生长增殖能力及克隆形成能力也有所下降,FoxM1 敲低后,细胞凋亡明显增加。FoxM1 shRNA慢病毒载体的成功构建为本课题组进一步开展FoxM1 在前列腺癌致病机制的基础研究及活体动物研究奠定了基础。
| [1] | Siegel R, Ma J. Zou Z and jemal a. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(4): 9-29. |
| [2] | Sun HC, Li M, Lu JL, et al. Overexpression of forkhead box M1 protein associates with aggressive tumor features and poor prognosis of hepatocellular carcinoma[J]. Oncol Rep,2011, 25 (6) : 1533-9. |
| [3] | Huynh KM, Soh JW, Dash R, et al. FOXM1 expression mediates growth suppression during terminal differentiation of HO-1 human metastatic melanoma cells[J]. J Cell Physiol,2011, 226 (1) : 194-204. DOI: 10.1002/jcp.22326. |
| [4] | Wang Y, Wen L, Zhao SH, et al. FoxM1 expression is significantly associated with cisplatin-based chemotherapy resistance and poor prognosis in advanced non-small cell lung cancer patients[J]. Lung Cancer,2013, 79 (2) : 173-9. DOI: 10.1016/j.lungcan.2012.10.019. |
| [5] | Koo CY, Muir KW, Lam EW. FOXM1: from Cancer initiation to progression and treatment[J]. Biochim Biophys Acta,2012, 1819 (1) : 28-37. DOI: 10.1016/j.bbagrm.2011.09.004. |
| [6] | Wang Y, Yao B, Wang Y, et al. Increased FoxM1 expression is a target for metformin in the suppression of EMT in prostate cancer[J]. Int J Mol Med,2014, 33 (6) : 1514-22. |
| [7] | Sakuma T, Barry MA, Ikeda Y. Lentiviral vectors: basic to translational[J]. Biochem J,2012, 443 (3) : 603-18. DOI: 10.1042/BJ20120146. |
| [8] | Cai Y, Balli D, Ustiyan V, et al. Foxm1 expression in prostate epithelial cells is essential for prostate carcinogenesis[J]. J Biol Chem,2013, 288 (31) : 22527-41. DOI: 10.1074/jbc.M113.455089. |
| [9] | 王建. FoxM1 在前列腺癌中的表达及其临床意义[J]. 实用癌症杂志,2013, 28 (2) : 125-6. |
| [10] | Segura MM, Mangion M, Gaillet B, et al. New developments in lentiviral vector design, production and purification[J]. Expert Opin Biol Ther,2013, 13 (7) : 987-1011. DOI: 10.1517/14712598.2013.779249. |
| [11] | Esposito D, Craigie R. HIV integrase structure and function[J]. Adv Virus Res,1999, 52 (8) : 319-33. |
| [12] | Pluta, K, kacprzak MM. use of HIV as a gene transfer vector[J]. Acta Biochim Pol,2009, 56 (4) : 531-95. |
| [13] | Dropulić B. Lentiviral vectors: their molecular design, safety, and use in laboratory and preclinical research[J]. Hum Gene Ther,2011, 22 (6) : 649-57. DOI: 10.1089/hum.2011.058. |
| [14] | Modlich U, Navarro S, Zychlinski D, et al. Insertional transfo- rmation of hematopoietic cells by self-inactivating lentiviral and gammaretroviral vectors[J]. Mol Ther,2009, 17 (11) : 1919-28. DOI: 10.1038/mt.2009.179. |
| [15] | Yang HG, Hu BL, Xiao L, et al. Dendritic cell-directed lentivector vaccine induces antigen-specific immune responses against murine melanoma[J]. Cancer Gene Ther,2011, 18 (5) : 370-80. DOI: 10.1038/cgt.2011.13. |
| [16] | Pfeifer A. Lentiviral transgenesis[J]. Methods Mol Biol,2004, 13 (6) : 513-22. |
| [17] | Kvell K, Czömpöly T, Hiripi L, et al. Characterisation of eGFP- transgenic BALB/c mouse strain established by lentiviral tran- sgenesis[J]. Transgenic Res,2010, 19 (1) : 105-12. DOI: 10.1007/s11248-009-9288-6. |
| [18] | Emeagi PU, Goyvaerts C, Maenhout S, et al. Lentiviral vectors: a versatile tool to fight cancer[J]. Curr Mol Med,2013, 13 (4) : 602-25. DOI: 10.2174/1566524011313040011. |
| [19] | Singer O, Verma IM. Applications of lentiviral vectors for shRNA delivery and transgenesis[J]. Curr Gene Ther,2008, 8 (6) : 483-8. DOI: 10.2174/156652308786848067. |
| [20] | 廉滋珍, 曹佐武, 陈冉, 等. 慢病毒干扰小鼠附睾特异的meClps基因可降低精子的运动能力[J]. 南方医科大学学报,2014, 34 (9) : 1359-64. |
| [21] | Gentner B, Schira G, Giustacchini A, et al. Stable knockdown of microRNA in vivo by lentiviral vectors[J]. Nat Methods,2009, 6 (1) : 63-6. DOI: 10.1038/nmeth.1277. |
| [22] | Pfeifer A, Kessler T, Yang M, et al. Transduction of liver cells by lentiviral vectors: analysis in living animals by fluorescence imaging[J]. Mol Ther,2001, 3 (3) : 319-22. DOI: 10.1006/mthe.2001.0276. |
| [23] | Pomper MG, Hammond H, Yu X, et al. Serial imaging of human embryonic stem-cell engraftment and teratoma formation in live mouse models[J]. Cell Res,2009, 19 (3) : 370-9. DOI: 10.1038/cr.2008.329. |
 2015, Vol. 35
2015, Vol. 35
