急性心肌梗死是一种严重影响人类生命健康的心血管疾病,直接经皮冠状动脉介入治疗(PCI)是目前推荐的重要有效的治疗方法。然而在临床实践中发现,某些心外膜血管在再灌注治疗期间已解除机械性梗阻,但相应心肌组织并没有完全有效地恢复血流灌注和氧供,即出现缺血再灌注损伤[1-2]。心肌微血管位于循环系统的末梢部位,决定了心肌的灌注水平,与缺血再灌注损伤密切相关,而微血管内皮细胞作为血流灌注和心肌组织之间的直接屏障,在缺血再灌注损伤中是最先被累及的,其损伤机制包括产生过量活性氧诱导细胞凋亡、 钙超载等[3-4]。由于内皮细胞具有明显的结构特异性和生理特异性,所以对于大血管内皮细胞的研究很难准确解释微血管病变。因此,找到合适的药物和方法来促进心肌的微血管内皮细胞的增殖和迁移功能,对后期受损内皮的修复起到至关重要的作用。胰高糖素样多肽-l(glucagon-like peptide-1,GLP-1)是一种餐后由远端肠腔L型细胞分泌的天然降血糖激素,对GLP-1的研究多集中在血糖调节方面[5],近年来发现GLP-1 受体(GLP-1R)在心脏以及血管等组织中也有表达,故为GLP-1 在心血管保护作用上提供了理论基础[6-8]。Bose 等[9]首先在大鼠离体心脏缺血再灌注模型中发现,GLP-1 可以通过激活PI3K/Akt 通路减少心肌梗死面积以及改善心排血量,Wang等[10]发现GLP-1通过CEMCs上特定的GLP-1R介导,从而激活胞内的相关分子信号通路,可以起到抗炎、抗氧化作用。利拉鲁肽是通过基因重组技术利用酵母生产的胰高糖素样肽类似物,属于GLP-1受体激动剂,与天然生理性GLP-1有97%的同源性,能耐受二肽基肽酶Ⅳ(DPP-Ⅳ)的降解作用,可根据葡萄糖浓度“按需”调节胰岛素分泌,安全性好。目前利拉鲁肽对CMECs 的增殖、迁移作用尚未见报道,本研究将着眼于GLP-1促进CMECs生长的机制做一探究。
1 材料和方法 1.1 试剂和仪器选取出生后5~6 d、体质量约12~16 g 的SD 大鼠,购于解放军总医院实验动物中心,高糖DMEM (Gibco)、胎牛血清(Hyclone)、四甲基偶氮唑盐(MTT, Hyclone)、利拉鲁肽(诺和诺德公司提供)、荧光抗体Ⅷ 因子、CD31(Abcam)、PI3K/Akt 信号阻断剂LY294002 (Sigma)、MAPK/ERK 信号通路阻断剂PD98059 (Sigma)、一抗Akt、p-Akt、ERK、p-ERK(Cell Signaling Technology)、相应二抗(Santa Cruze)、Brdu 试剂盒(上海杰美基因公司)、酶标仪(Biotek)。
1.2 实验方法 1.2.1 微血管内皮细胞的分离与培养方法参照Nishida.等的双酶消化分离原代细胞[11],并在此基础上进行了改良。简述如下:5只乳鼠处死后取出左心室,眼科镊分离心外膜、心外膜1/3 组织及心内膜,75%乙醇中浸泡15 s,清洗后剪碎0.5 mm×0.5 mm×0.5 mm 的组织块,Ⅰ型胶原酶和胰蛋白酶37 度水浴各消化10 min,离心后重悬于培养液中,37 ℃、5% CO2、饱和湿度培养箱中培养4 h,去除悬浮未贴壁的细胞,继续培养待细胞至80%融合生长后,胰蛋白酶消化传代。根据实验需要使用第1或第2代细胞。
1.2.2 心肌微血管内皮细胞的鉴定细胞接种于盖玻片上;多聚甲醛固定细胞,TritonX-100 通透细胞;封闭30 min;2 张爬片上滴加兔抗大鼠Ⅷ因子多克隆抗体(1∶100)和小鼠抗大鼠CD31 单克隆抗体(1∶100),阴性对照爬片滴加等量PBS,4 ℃孵育过夜;隔夜后滴加山羊二抗,37 ℃ 避光孵育30 min;立即于倒置荧光显微镜下观察,每张爬片计数3个视野,计算其平均数。
1.2.3 实验分组在MTT 探究最适内皮细胞生长的浓度和时间的实验中,设置0、1、10、100、1000 nmol/L 五个浓度梯度的利拉鲁肽干预组。探究通路对细胞增殖迁移影响的实验,设置正常细胞组(0 nmol/L 组)、 100 nmol/L 利拉鲁肽组、100 nmol/L 利拉鲁肽+ LY294002 组、100 nmol/L 利拉鲁肽+PD98059 组。药物作用时间为利拉鲁肽预干预贴壁后的细胞24 h。通路阻断实验,LY294002(10 μm/L)、PD98059(10 μm/L)预处理1 h[12]。
1.2.4 MTT法绘制细胞生长曲线分成5 组每组每天3个复孔,连续检测7 d,贴壁后每组给与不同浓度利拉鲁肽干预。每孔按5×103 细胞密度接种于96 孔板中培养24 h,加入MTT 溶液10 µL,37 ℃复箱中继续培养4 h;后每孔加入150 µL DMSO,于酶标仪570 nm 检测光吸收值。计算每天各组3 个复孔吸光度平均值并绘制细胞生长曲线。
1.2.5 Western blot检测Akt以及ERK的磷酸化水平各组处理结束后,提取总蛋白。10% SDS-聚丙烯酰胺凝胶电泳分离,PVDF 膜湿转后室温封闭1 h,加入相应一抗4 ℃孵育过夜,TBST 洗膜后HRP 标记的二抗(1∶3000)室温反应60 min,暗室曝光,以β-actin 作为内参。采用Quantity One软件采集信号和灰度扫描。实验重复3次。
1.2.6 Brdu 检测细胞增殖情况各组处理完后,加入含Brdu(reagent A)的培养液与细胞共培养6 h,固定液(reagent C)固定20 min,封阻液(reagent D)封闭30 min,加入抗体液(reagent E)的细胞置37 ℃培养箱30 min,荧光液(reagent F)避光30 min,最后加入复染液(reagent G)以及抗荧光淬灭剂(reagent H),随后置于倒置荧光显微镜下计数各组的红色荧光数,每组计数3 个视野算得平均值。
1.2.7 划痕实验检测细胞迁移情况将第1 代细胞种于细胞培养皿上,予以通路阻断剂和利拉鲁肽预处理完之后,待细胞生长至80%~90%,进行实验。将划痕过后的细胞继续培养24 h,于倒置显微镜下观测各组细胞向划痕区域迁移的距离。
1.2.8 统计学分析采用SPSS 17.0进行统计分析,数据用均数±标准差表示,两组间比较用t 检验或方差分析,P<0.05为差异具有统计学意义。
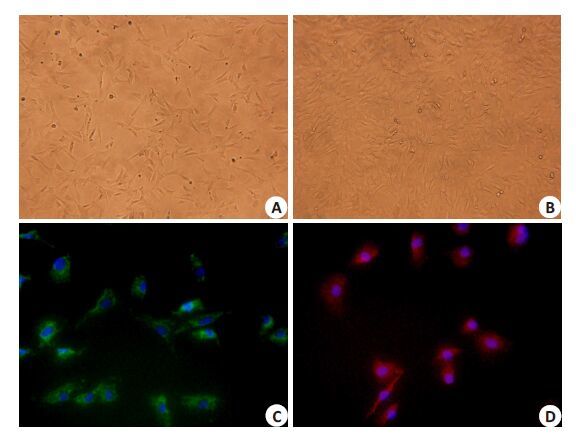
2 结果 2.1 微血管内皮细胞原代培养的形态学观察原代微血管内皮细胞贴壁培养24 h 后(图 1A),至于倒置显微镜下观察,细胞体积较小,形态未完全伸展开,呈短梭状散在分布培养瓶内,48 h 后,细胞数量增多,逐渐铺展开来体积变大,细胞呈现梭形、三角形或多角形聚集管腔样生长。72~96 h 细胞长满瓶底,呈典型铺路石样结构(图 1B)。
2.2 微血管内皮细胞的鉴定于倒置荧光显微镜下观察,Ⅷ因子多克隆抗体和CD31单克隆抗体染色,细胞内分别呈红色和绿色荧光,双阳性率>95%(图 1C、D)证实微血管内皮细胞。阴性对照细胞不能观察到荧光。
|
图 1 大鼠原代心肌微血管内皮细胞的形态学观察及细胞鉴定 Figure 1 Morphology of primary myocardial microvascular endothelial cells (CMECs) and its identification. A,B: CMECs under inverted microscope at 24 and 96 h,respectively (Original magnification: ×200); C,D: CD31 and factor VIII immunocytochemistry of CMECs(Original magnification: ×400). |
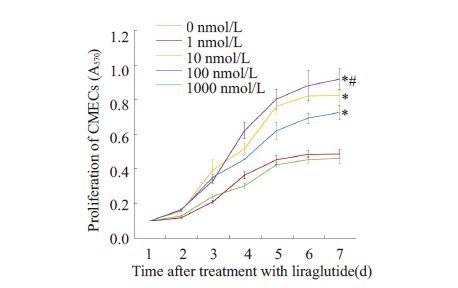
待细胞贴壁24 h 后,分别使用0、1、10、100、 1000 nmol/L 的利拉鲁肽干预第1 代细胞,每24 h 测量各组A570值,MTT 绘制细胞的生长曲线(图 2)。结果提示,同一时间点上A值随利拉鲁肽药物浓度增加而显著升高,于100 nmol/L组达到最高促生长浓度(P<0.05),过高药物浓度1000 nmol/L 不利于细胞的生长达到最优化(P<0.05)。不同时间点上,总体趋势提示细胞于种植2 d 后出现对数生长期,于第5 天后进入生长平台期。故选用100 nmol/L 利拉鲁肽干预贴壁后的细胞24 h 作为后期实验的干预条件。
|
图 2 MTT法绘制不同浓度利拉鲁肽对CMECs增殖能力影响 Figure 2 Growth curve of CMECs treated with different concentrations (0-1000 nmol/L) of liraglutide drawn by MTT. *P<0.05 vs Normal group (0 nmol/L) #P<0.05 vs 10 nmol/L liraglutide group. |
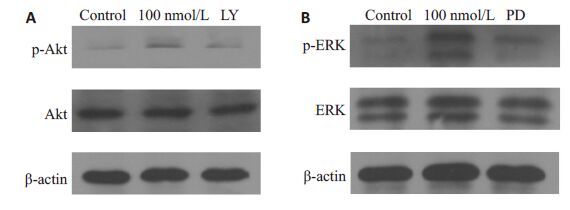
本团队既往研究已证实在干细胞中GLP-1 是PI3K/Akt 和MAPK/ERK 信号通路的上游激活剂[13],本实验Western blot 结果示(图 3A、B),相较于正常细胞组,利拉鲁肽组细胞内的p-Akt 和p-ERK 水平显著升高(1.067 ± 0.047 vs 0.487 ± 0.015,P<0.05)(1.23 ± 0.075 vs 0.513±0.031,P<0.05)。为进一步验证激活作用,本实验使用了通路阻断剂,相较于利拉鲁肽组,利拉鲁肽+ LY294002 组和利拉鲁肽+PD98059 组Akt 和ERK 的磷酸化水平显著降低(0.48 ± 0.017 vs 1.067 ± 0.047,P< 0.05)(0.447±0.015 vs 1.23±0.075,P<0.05)。
|
图 3 Western blot 检测利拉鲁肽对PI3K/Akt 和MAPK/ERK通路的激活作用 Figure 3 Effect of liraglutide on Akt and ERK evaluated by Western blotting. A: Phospho-Akt in PI3K/Akt pathway; B: Phospho-ERK in MAPK/ERK pathway. LY group: 100 nmol/L liraglutide + LY294002 group; PD group: 100 nmol/L liraglutide+PD98059 group. |
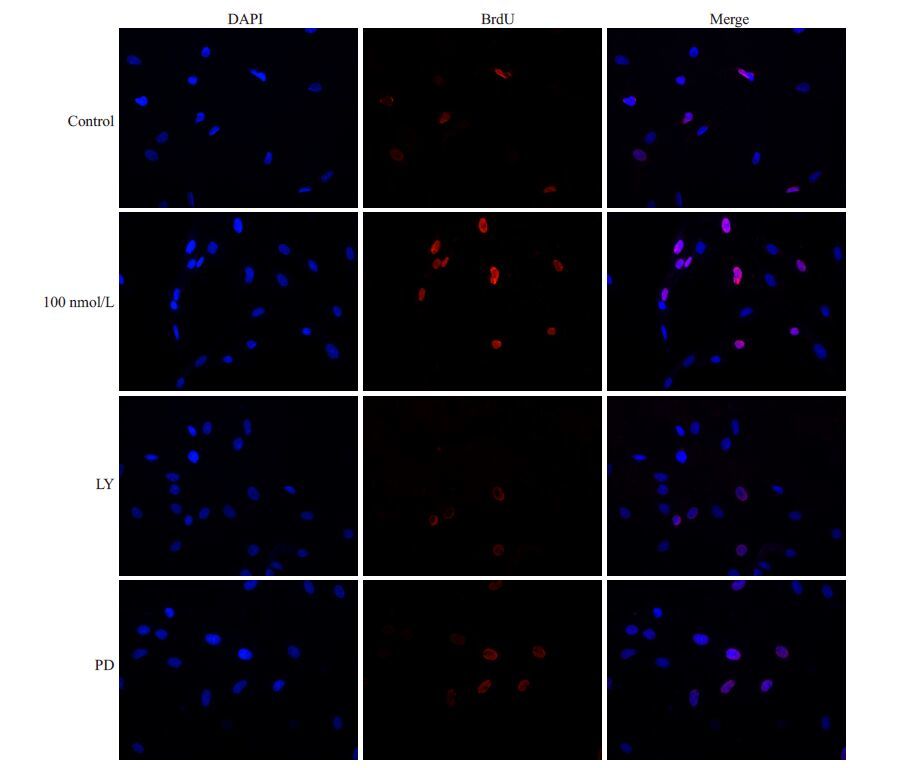
BrdU结果见图 4。根据细胞荧光数计算,相较于正常细胞组,100 nmol/L利拉鲁肽组增殖细胞呈显著性增加(42%±8.2% vs 26.3%±0.66%,P<0.05)。予以通路阻断剂预处理后,利拉鲁肽+LY294002 组和利拉鲁肽+ PD98059 组增殖细胞明显低于利拉鲁肽组(22%±1.9% vs 42% ± 8.2%,P<0.05)(22.4% ± 3% vs 42% ± 8.2%,P< 0.05)。
|
图 4 BrdU检测利拉鲁肽对细胞增殖能力的影响及其机制 Figure 4 Effect of liraglutide on CMEC proliferation evaluated by BrdU assay (Original magnification: ×400). LY group: 100 nmol/L liraglutide+LY294002 group PD group: 100 nmol/L liraglutide+PD98059 group. |
既往研究示PI3K/ Akt 和MAPK/ERK 通路在细胞迁移过程中起到关键作用[14]。本实验观察示(图 5),相较于正常细胞组,100 nmol/L利拉鲁肽组可以明显促进CMECs 向划痕空白区域的迁移生长(20±2.6 vs 8±0.5,P<0.05)。予以通路阻断剂预处理后,利拉鲁肽+LY294002 组和利拉鲁肽+PD98059 组增殖细胞显著低于仅用利拉鲁肽组(6±0.36 vs 8±0.5,P<0.05)(6.5±0.36 vs 8±0.5,P<0.05)。

|
图 5 划痕实验检测利拉鲁肽对细胞迁移能力的影响及其机制 Figure 5 Effect of liraglutide on CMEC migration evaluated by scratch assay (Original magnification: × 200). LY group: 100 nmol/L liraglutide+LY294002 group PD group: 100 nmol/L liraglutide+PD98059 group. |
在本次研究中,我们证实了利拉鲁肽可以通过激活PI3K/Akt 和MAPK/ERK 通路促进心肌微血管内皮细胞的增殖和迁移,并且在使用PI3K/Akt 和MAPK/ERK 的通路阻断剂LY294002 和PD98059 预处理后利拉鲁肽促增殖和迁移的效果显著减弱,更加确定地说明了药物对心肌微血管内皮细胞的作用。
微血管是指直径小于200 µm 的血管,微血管内皮细胞是血液和周围组织之间交换的主要屏障,其总的细胞量占到了整个左心室的1/3[15],能够合成和分泌多种生物活性物质,起到抗炎、再生血管供给受损组织充足血供等重要功能,因为微循环的血液灌注对于组织维持正常新陈代谢具有重要意义[16]。一般情况下,内皮的增殖能力处于较缓慢平稳状态[17],但是在特殊情况下它具有增殖和迁移、并参与到受损组织再血管化修复的强大储备能力,多项研究表明内皮细胞的增殖和迁移在生理或病理性的再血管化修复过程中起到不可替代的始动环节[18]。所以我们的研究着眼于利拉鲁肽这种安全有效的临床用药能够通过促进CMECs再生并增强其运动能力,在受损组织中重塑内皮的功能。GLP-1最早在糖尿病中发现可以促进β细胞和胰腺小岛的内皮细胞增殖[19],近年来GLP-1 的研究聚焦于心血管病的防治。Erdogdu团队发现GLP-1受体在HCAECs上有表达,并进一步证实GLP-1类似物exendin-4通过GLP-1受体依赖的途径激活PKA-PI3K/Akt-eNOS 通路促进HCAECs 的细胞DNA 以及数量增多,这种促增殖作用呈明显的浓度和时间依赖性,于10 nmol/L作用24~48 h 差异最显著[20]。本研究采用的是GLP-1 受体激动剂利拉鲁肽,一种已进入临床用药指南的心血管保护药物,其浓度范围参考其他研究中利拉鲁肽对内皮细胞作用的有效剂量[10, 21]。本实验证实100 nmol/L 的利拉鲁肽作用24 h 可以促进CMECs 的增殖和迁移,其可能机制与促细胞存活通路MAPK/ERK-和PI3K/Akt-相关,进而为围手术期的保护性用药提供理论依据。
再血管化在创伤性血管疾病或冠脉疾病修复过程中占有主导性地位,其中内皮增殖、迁移能力增强、促管状结构形成以及胞外基质降解是再血管化的主要组成部分[22]。Kang 等[23]从体内和体外实验均证实GLP-1 可以通过受体依赖的途径促进HUVECs 细胞在划痕实验中的迁移以及Matrigel 基质中管样结构形成,但此研究并未做机制的深入探讨。所以,对正常或损伤后的内皮细胞进行有效安全的药物干预,使其更多的进入增殖周期,是缺血性心脏病中再血管化治疗的一个重要靶点。
不同信号通路对内皮细胞增殖、促存活作用已经有明确的阐述[24-25]。PI3K/Akt 通路广泛存在于细胞中,参与细胞生长、增殖的信号转导通路。Akt作为一种丝/苏氨酸蛋白激酶是PI3K 重要的下游靶激酶,对Ser473 或Thr308 位点的磷酸化是Akt 激活的必要条件。PI3K/ Akt 下游能够通过激活细胞周期依赖性蛋白激酶2 和4(CDK2/4),促使细胞进入S 期。MAPKs 家族被证实可以促进血管内皮细胞增殖和新血管生成[26]。ERK 作为其亚族通过磷酸化底物Thr202或Tyr204位点来发挥作用。PI3K/Akt和MAPK通路参与了细胞周期的调节来促细胞增殖[27]。Cyclin D 主要被促有丝分裂生长因子激活并调节其活性的蛋白,最早是在肿瘤疾病中被发现[28]。MAPK和PI3K通路被证实能参与到Cyclin D1 促进细胞由G1期向S期的转换过程中[29]。Cyclin D1 的表达增加可以活化蛋白激酶CDK4-cyclin D1复合物的形成,此复合物可以磷酸化Rb 蛋白,并进一步激活E2F-1 并促进其向核内转移,增加cyclin E 的表达[30]。这种循环在研究中证实可以被PI3K/Akt和MAPK的阻断剂所阻断[27]。本实验仅证实了利拉鲁肽在CMECs中可以激活这两条经典通路,其下游的促增殖机制可能与本文讨论的由核外向核内传递的细胞周期调节蛋白密切相关,需进一步实验明确。
Akt 促内皮细胞迁移、出芽的上游通路可能与血管生成素1(Ang1)相关。Ang1/Tie2 其与下游信号分子Akt、Dok-R 的结合,进一步激活Nck、Crk 小分子物质触发瀑布式连锁反应[31-32],GLP-1 在其中的作用需要进一步探究。细胞因子在促内皮增殖和再血管化有不可替代的作用[24, 33-34]。本团队前期研究也证实exendin-4 可以通过促进脂肪干的旁分泌作用来提高增殖能力。GLP-1 在微血管内皮细胞中是否有促细胞因子分泌的作用并作用于自身,有待进一步研究。
综上所述,本研究证实利拉鲁肽可以通过激活PI3K/Akt 和MAPK/ERK 通路促进心肌微血管内皮细胞的增殖和迁移。GLP-1 能否逆转缺血缺氧损伤后已经凋亡或老化的细胞,使其重新进入增殖周期,又是另一急待解决的难题。此研究提示利拉鲁肽不仅可以作为一种降糖减脂药,而且在心血管方向也具应用前景,为直接PCI 术的围手术期的再血管化治疗提供了可靠的理论保障。
| [1] | Niccoli G, Kharbanda RK, Crea F, et al. No-reflow: again prevention is better than treatment[J]. Eur Heart J,2010, 31 (20) : 2449-55. DOI: 10.1093/eurheartj/ehq299. |
| [2] | Schwartz BG, Kloner RA. Coronary no reflow[J]. J Mol Cell Cardiol,2012, 52 (4) : 873-82. DOI: 10.1016/j.yjmcc.2011.06.009. |
| [3] | Scarabelli T, Stephanou A, Rayment N, et al. Apoptosis of endothelial cells precedes myocyte cell apoptosis in ischemia/reperfusion injury[J]. Circulation,2001, 104 (3) : 253-6. DOI: 10.1161/01.CIR.104.3.253. |
| [4] | Sanada S, Komuro I, Kitakaze M. Pathophysiology of myocardial reperfusion injury: preconditioning, postconditioning, and translational aspects of protective measures[J]. Am J Physiol Heart Circ Physiol,2011, 301 (5) : H1723-41. DOI: 10.1152/ajpheart.00553.2011. |
| [5] | Ryder RE. The potential risks of pancreatitis and pancreatic cancer with GLP-1-based therapies are far outweighed by the proven and potential (cardiovascular) benefits[J]. Diabet Med,2013, 30 (10) : 1148-55. DOI: 10.1111/dme.2013.30.issue-10. |
| [6] | Tomas E, Habener JF. Insulin-like actions of glucagon-like peptide-1: a dual receptor hypothesis[J]. Trends Endocrinol Metab,2010, 21 (2) : 59-67. DOI: 10.1016/j.tem.2009.11.007. |
| [7] | Monami M, Dicembrini I, Nardini C, et al. Effects of glucagon-like peptide-1 receptor agonists on cardiovascular risk: a meta-analysis of randomized clinical trials[J]. Diabetes Obes Metab,2014, 16 (1) : 38-47. DOI: 10.1111/dom.2014.16.issue-1. |
| [8] | Monami M, Cremasco F, Lamanna C, et al. Glucagon-like peptide-1 receptor agonists and cardiovascular events: a meta-analysis of randomized clinical trials[J]. Exp Diabetes Res,2011 : 215764. |
| [9] | Bose AK, Mocanu MM, Carr RD, et al. Glucagon-like peptide 1 can directly protect the heart against ischemia/reperfusion injury[J]. Diabetes,2005, 54 (1) : 146-51. DOI: 10.2337/diabetes.54.1.146. |
| [10] | Wang D, Luo P, Wang Y, et al. Glucagon-like peptide-1 protects against cardiac microvascular injury in diabetes via a cAMP/PKA/ Rho-dependent mechanism[J]. Diabetes,2013, 62 (5) : 1697-708. DOI: 10.2337/db12-1025. |
| [11] | Nishida M, Carley WW, Gerritsen ME, et al. Isolation and characterization of human and rat cardiac microvascular endothelial cells[J]. Am J Physiol,1993, 264 (2 Pt 2) : H639-52. |
| [12] | Favaro E, Granata R, Miceli I, et al. The ghrelin gene products and exendin-4 promote survival of human pancreatic islet endothelial cells in hyperglycaemic conditions, through phosphoinositide 3-kinase/Akt, extracellular signal-related kinase (ERK)1/2 and cAMP/protein kinase A (PKA) signalling pathways[J]. Diabetologia,2012, 55 (4) : 1058-70. DOI: 10.1007/s00125-011-2423-y. |
| [13] | Liu J, Wang H, Wang Y, et al. The stem cell adjuvant with Exendin-4 repairs the heart after myocardial infarction via STAT3 activation[J]. J Cell Mol Med,2014, 18 (7) : 1381-91. DOI: 10.1111/jcmm.2014.18.issue-7. |
| [14] | Camenisch G, Pisabarro MT, Sherman D, et al. ANGPTL3 stimulates endothelial cell adhesion and migration via integrin alpha vbeta 3 and induces blood vessel formation in vivo[J]. J Biol Chem,2002, 277 (19) : 17281-90. DOI: 10.1074/jbc.M109768200. |
| [15] | Mayr A, Klug G, Schocke M, et al. Late microvascular obstruction after acute myocardial infarction: relation with cardiac and inflammatory markers[J]. Int J Cardiol,2012, 157 (3) : 391-6. DOI: 10.1016/j.ijcard.2010.12.090. |
| [16] | Ince C. The microcirculation is the motor of sepsis[J]. Crit Care,2005, 9 (Suppl 4) : S13-9. DOI: 10.1186/cc3753. |
| [17] | Antolin AJ, Aguiar MJ, Amerigo GM, et al. Association of a thoracic carcinoid tumor and hyperparathyroidism[J]. Rev Clin Esp,1986, 179 (7) : 385. |
| [18] | Hofer E, Schweighofer B. Signal transduction induced in endothelial cells by growth factor receptors involved in angiogenesis[J]. Thromb Haemost,2007, 97 (3) : 355-63. |
| [19] | Klinger S, Poussin C, Debril MB, et al. Increasing GLP-1-induced beta-cell proliferation by silencing the negative regulators of signaling cAMP response element modulator-alpha and DUSP14[J]. Diabetes,2008, 57 (3) : 584-93. DOI: 10.2337/db07-1414. |
| [20] | Erdogdu O, Nathanson D, Sj?holm A, et al. Exendin-4 stimulates proliferation of human coronary artery endothelial cells through eNOS-, PKA- and PI3K/Akt-dependent pathways and requires GLP-1 receptor[J]. Mol Cell Endocrinol,2010, 325 (1/2) : 26-35. |
| [21] | Dai Y, Mehta JL, Chen M. Glucagon-like peptide-1 receptor agonist liraglutide inhibits endothelin-1 in endothelial cell by repressing nuclear factor-kappa B activation[J]. Cardiovasc Drugs Ther,2013, 27 (5) : 371-80. DOI: 10.1007/s10557-013-6463-z. |
| [22] | Xie F, Feng L, Cai W, et al. Vaccarin promotes endothelial cell proliferation in association with neovascularization in vitro and in vivo[J]. Mol Med Rep,2015, 12 (1) : 1131-6. |
| [23] | Kang HM, Kang Y, Chun HJ, et al. Evaluation of the in vitro and in vivo angiogenic effects of exendin-4[J]. Biochem Biophys Res Commun,2013, 434 (1) : 150-4. DOI: 10.1016/j.bbrc.2013.03.053. |
| [24] | Muñoz-Chápuli R, Quesada AR, ángel Medina M. Angiogenesis and signal transduction in endothelial cells[J]. Cell Mol Life Sci,2004, 61 (17) : 2224-43. |
| [25] | 曹玉净, 吕秋霞. 类表皮生长因子域7通过ERK信号通路促进内皮细胞迁移及血管生成[J]. 中华病理学杂志,2015, 44 (4) : 270-3. |
| [26] | Chen WL, Turlova E, Sun CL, et al. Xyloketal B suppresses glioblastoma cell proliferation and migration in vitro through inhibiting TRPM7-regulated PI3K/Akt and MEK/ERK signaling pathways[J]. Mar Drugs,2015, 13 (4) : 2505-25. DOI: 10.3390/md13042505. |
| [27] | Qiu C, Xie Q, Zhang D, et al. GM-CSF induces cyclin D1 expre- ssion and proliferation of endothelial progenitor cells via PI3K and MAPK signaling[J]. Cell Physiol Biochem,2014, 33 (3) : 784-95. DOI: 10.1159/000358652. |
| [28] | Musgrove EA. Cyclins: roles in mitogenic signaling and oncogenic transformation[J]. Growth Factors,2006, 24 (1) : 13-9. DOI: 10.1080/08977190500361812. |
| [29] | Herber B, Truss M, Beato M, et al. Inducible regulatory elements in the human cyclin D1 promoter[J]. Oncogene,1994, 9 (4) : 1295-304. |
| [30] | Caldon CE, Sutherland RL, Musgrove E. Cell cycle proteins in epithelial cell differentiation: implications for breast cancer[J]. Cell Cycle,2010, 9 (10) : 1918-28. DOI: 10.4161/cc.9.10.11474. |
| [31] | Koh GY. Orchestral actions of angiopoietin-1 in vascular regeneration[J]. Trends Mol Med,2013, 19 (1) : 31-9. DOI: 10.1016/j.molmed.2012.10.010. |
| [32] | Augustin HG, Koh GY, Thurston G, et al. Control of vascular morphogenesis and homeostasis through the angiopoietin-Tie system[J]. Nat Rev Mol Cell Biol,2009, 10 (3) : 165-77. |
| [33] | Dimmeler S, Zeiher AM. Akt takes center stage in angiogenesis signaling[J]. Circ Res,2000, 86 (1) : 4-5. DOI: 10.1161/01.RES.86.1.4. |
| [34] | Wu LW, Mayo LD, Dunbar JD, et al. Utilization of distinct signaling pathways by receptors for vascular endothelial cell growth factor and other mitogens in the induction of endothelial cell proliferation[J]. J Biol Chem,2000, 275 (7) : 5096-103. DOI: 10.1074/jbc.275.7.5096. |
 2015, Vol. 35
2015, Vol. 35
