2. 河北医科大学第二医院妇产科, 河北 石家庄 050000
2. Department of Gynecology and Obstetrics, Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
卵巢癌是目前最常见的妇科恶性肿瘤之一,因其发病隐匿,病因和发病机制尚不清楚,多数患者发现即是晚期。临床上目前仍以手术和化疗作为卵巢癌治疗的主要手段,研究发现,目前的治疗方法对提高患者5年生存率无明显改观,卵巢癌仍是目前死亡率最高的妇科恶性肿瘤,卵巢癌腹腔转移是卵巢癌患者复发和死亡的主要原因[1-5]。研究卵巢癌腹腔转移发病机制,寻找更有效的预防和治疗途径是目前相关研究和临床工作中丞待解决的棘手问题。
Survivin 即BIRC5,是1997 年发现的凋亡抑制蛋白家族(IAP)中的重要成员,大量的研究均证实其具有肿瘤表达的特异性,不仅能通过抑制肿瘤细胞凋亡及调节肿瘤细胞周期促进包括卵巢癌在内的多种恶性肿瘤发生和发展,而且其在包括卵巢癌在内的多种恶性肿瘤的转移中也起着重要作用,从而成为监测这些恶性肿瘤预后的重要指标之一[1, 6-8]。我们的前期研究[9]和近年来相关研究结果均证实survivin是卵巢癌发病及影响预后的重要癌基因,靶向survivin途径能有效抑制包括卵巢癌在内多种肿瘤的生长,因而将成为多种恶性肿瘤生物治疗的重要手段[9-12]。但其对卵巢癌腹腔转移的影响及其作用机制目前尚不清楚。
基于上述原因,在我们前期研究的基础上[9],以已有相关研究经验为基础[10, 12-13],结合我们的预实验,成功建立人卵巢癌细胞株裸鼠腹腔移植瘤模型。通过survivin ASODN进行干预,在活体内探讨靶向抑制存活素途径对卵巢癌腹腔转移的影响,并通过分析其对IL-6/STAT3 信号通路(近年来相关研究证实与卵巢癌发生和转移密切相关的重要信号转导通路[2, 4-5, 14])的影响,进一步探讨卵巢癌的发病机制以及靶向抑制存活素途径可能的作用机制,为解决相关临床难题提供更多的理论基础。
1 材料和方法 1.1 主要试剂细胞培养基DMEM/F-12 购自Gibco 公司;survivin ASODN:根据Olie,RA等报道[15]由上海捷瑞生物公司合成点硫代修饰的survivin ASOND,序列:5'>CCCAGCCTTCCAGCTCCTTG<3'经计算机网上检索证实与人类其它已知基因无同源性;兔抗人IL-6多克隆抗体(YT5348)immunoway公司;兔抗人STAT3多克隆抗体(YT4445)immunoway公司;兔抗人p-STAT3多克隆抗体(YP0250)immunoway公司;兔抗人survivin 多克隆抗体购自美国cell signaling 公司,内参兔抗人β-actin多克隆抗体购自immunoway公司,辣根过氧化物酶标记山羊抗兔IgG 由北京中杉公司进口分装,预染蛋白分子量marker 购自美国NEB 公司,ECL 增强化学发光试剂盒(天根生物技术有限公司)。
1.2 人卵巢癌细胞株裸鼠腹腔转移瘤模型的建立及干预在成功的预实验基础上,选用4周龄雌性BALB/C裸鼠12只(北京维通利华公司),严格按照SPF级动物饲养规范进行饲养,体质量17~19 g,将体质量接近的2只裸鼠分到一组,共6 组,将每组甲列入实验组(共6只),将每组乙分入对照组(共6只)。人卵巢癌细胞株SKOV3由河北医科大学第四医院肿瘤研究所保存,经DMEM/F-12培养液,置于37 ℃、饱和湿度、5% CO2条件下培养。待细胞进入对数生长期后,用0.25%胰蛋白酶消化细胞,PBS液洗涤后,调节成相应的细胞浓度为5×107/mL的细胞悬液。于每只去胸腺雌性裸鼠左下腹进针,回抽无血腹腔注入0.2 mL该细胞悬液。观察至19 d均成功荷瘤后,实验组(共6只):向荷瘤裸鼠腹腔内多点注射生理盐水稀释的survivin ASODN,0.2 mg/只/次,每只总体积0.2 mL,隔日1次,共7次。于第7次给药后1周断头处死。对照组(共6只):向荷瘤裸鼠腹腔内多点注射生理盐水,每只总体积0.2 mL,隔日1次,共7次。于第7次干预后1周断头处死。全部动物无意外死亡,均预期完成实验,动物断头处死后立即拍照,观察两组动物体质量、腹围、腹水形成、腹腔转移瘤瘤数量和质量、范围的情况。腹腔转移瘤组织保存,液氮冻存,以备进一步实验室检测。
1.3 蛋白印记法检测IL-6、STAT3、P-STAT3、survivin蛋白表达提取组织总蛋白,二羧基二喹啉(BCA)试剂盒(北京Solarbio 有限公司)测定总蛋白浓度。每泳道每标本加总蛋白30 μg,于垂直电泳槽和转移电泳仪(北京市六一仪器厂)行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至聚偏二氟乙烯膜(PVDF)(美国Milipore 公司)上,5%脱脂奶粉中37 ℃孵育1 h 封膜后,分别加入目的蛋白一抗:兔抗人IL-6多克隆抗体(1∶1000),兔抗人STAT3 多克隆抗体(1∶1000),兔抗人p-STAT3 多克隆抗体(1∶1000),兔抗人survivin 多克隆抗体(1∶1000),标准内参一抗兔抗人β-actin 多克隆抗体(1∶1000),4 ℃过夜。室温洗膜,每次8 min,洗5次。洗膜后加辣根酶标记的山羊抗兔IgG(1∶4000)于37 ℃孵育1 h。室温洗膜,每次8 min,洗5 次。用ECL增强化学发光试剂盒显色。用Odyssey 近红外双色激光成像系统(美国基因公司)观察蛋白显影条带并测得每个蛋白条带的积分光密度IOD 值。目的蛋白与β-actin蛋白的IOD 值比值为目的蛋白的相对表达量。
1.4 统计学处理所有数据用均数±标准差表示,采用SPSS 19.0软件对数据进行分析,计量资料采用t检验,以P<0.05为差异有统计学意义。
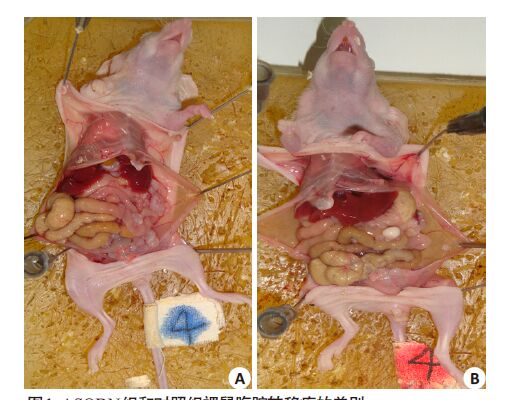
2 结果 2.1 Survivin ASODN对卵巢癌细胞系SKOV3裸鼠腹腔转移瘤生长的影响12只BALB/C裸鼠人卵巢癌细胞系SKOV3 腹腔转移瘤模型均成瘤,移植瘤分布于腹膜、肠系膜、肠管表面,肝脏特别是肝门周围(图 1)。经survivin ASODN干预后移植瘤数量较对照组明显减少(t=12.36,P<0.01);经survivin ASODN干预后移植瘤质量较对照组也明显减少(t=3.00,P<0.05,表 1)。
|
图 1 ASODN组和对照组裸鼠腹腔转移瘤的差别 Figure 1 Comparison of intraperitoneal xenografts between ASODNgroup and control group. A: ASODN group; B: Control group. |
| 表 1 Survivin ASODN对SKOV3细胞系裸鼠腹腔转移瘤生长的影响 Table 1 Effect of ASODN on peritoneal metastatic growth ofovarian cancer cell line SKOV3 in nude mice (Mean±SD,n=6) |
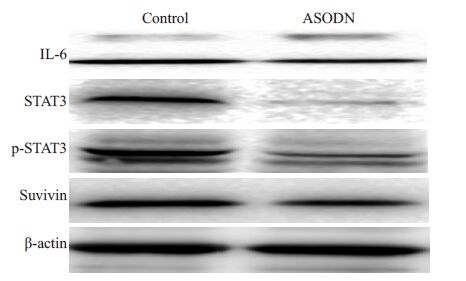
经ASODN干预后SKOV3细胞裸鼠腹腔移植瘤组织中IL-6、STAT3、p-STAT3、survivin蛋白表达均明显降低(t=2.80,P<0.05;t=2.72,P<0.05;t=3.19,P<0.01;t=2.32,P<0.05,图 2,表 2)。
|
图 2 ASODN组和对照组裸鼠腹腔转移瘤中IL-6、STAT3、p-STAT3、survivin蛋白表达的改变 Figure 2 IL-6,STAT3,p-STAT3,and survivin protein inthe tumors in ASODN group and control group |
| 表 2 Survivin ASODN对SKOV3细胞系裸鼠腹腔转移瘤IL-6、STAT3、p-STAT3、survivin蛋白表达的影响 Table 2 Effect of ASODN on expressions of IL-6,STAT3,p-STAT3,and survivin protein in theintraperitoneal xenografts in ASODN group and control group (Mean±SD,n=6) |
近年来大量研究已证实靶向survivin途径不仅能明显抑制包括卵巢癌在内的多种肿瘤细胞的生长,并且能降低耐药的肿瘤细胞对化疗药物的敏感性。靶向survivin途径有多种方式:反义寡核苷酸、小干扰、微小RNA、拮抗剂和疫苗等,其中survivin ASODN治疗已被证实是其中最为成熟的靶向治疗方法[8, 10, 16-17],相关研究已经进入临床试验阶段,并已取得了可靠的数据支持survivin ASODN在人体内用于抗肿瘤治疗的安全性和有效性[17]。因此survivin ASODN途径是目前离临床最近的靶向干预途径,但其对卵巢癌腹腔转移的影响尚不清楚。因此,我们在前期活体外研究证实了survivinASODN能抑制卵巢癌细胞转移能力的实验基础上[9],进一步通过建立人卵巢癌SKOV3细胞株裸鼠腹腔移植瘤模型[13],参考Morrison等[12]和Rosa等[10]的实验方法,结合我们自己摸索出的实验条件,实施survivinASODN腹腔干预,结果发现:经survivin ASODN干预组较对照组无论是裸鼠腹腔移植瘤数量还是质量都较对照组均明显减小(P<0.01;P<0.05);通过免疫印迹方法检测两组移植瘤组织中survivin蛋白表达情况,结果发现:survivin ASODN干预组较对照组移植瘤组织中survivin 蛋白表达明显下降(P<0.05)。这说明在活体内,survivin ASODN也可通过靶向抑制存活素途径,抑制人卵巢癌细胞裸鼠腹腔种植性转移能力。从而证实了survivin ASODN腹腔干预对卵巢癌腹腔移植瘤生长的抑制作用,也进一步在活体内反向证实了survivin是卵巢癌腹腔转移的关键性癌基因。
同我们的研究结果相同,近年来的大量研究也证实了survivin在包括卵巢癌在内的多种肿瘤的发生和发展中的作用以及靶向抑制其表达可有效抑制多种肿瘤的发生和发展[1, 6-12, 15-17]。但其对卵巢癌腹腔转移的影响未见报道,其作用机制也尚不清楚。卵巢癌腹腔转移的发病机制也尚不清楚。
作为卵巢癌发病的重要癌基因,survivin的表达是受多种因素调节的,近年来研究发现多种细胞因子可通过一定的信号转导通路影响包括survivin在内多种癌基因的表达,从而促进包括卵巢癌在内的多种肿瘤发生和发展[2, 5, 14, 17]。相关研究虽正处于起步阶段,但已成为目前研究的热点。其中IL-6是其中研究的焦点之一。已有研究发现,正常情况下IL-6由卵巢表面的上皮细胞生成,其在肿瘤细胞内分泌明显升高,IL-6可通过激活下游细胞内和细胞外多种信号途径影响卵巢癌的发生、发展。一方面IL-6可改变卵巢癌免疫微环境促进卵巢癌细胞增殖、分化、血管生成,另一方面还可以诱导卵巢癌细胞粘附及侵袭能力,同时也是重要的卵巢癌预后监测指标。其中IL-6可通过诱导细胞内STAT3磷酸化引起一系列级联反应促进其下游相关功能基因如survivin等表达改变,从而调节卵巢癌细胞的增殖、抑制细胞凋亡、促进微环境血管生成、促进转移及增加肿瘤细胞的耐药性[2, 5, 14, 16]。近来新的研究成果也证实阻断IL-6/STAT3信号通路的活性,可通过降低survivin、VEGF等致癌基因的表达,有效抑制卵巢癌生长和血管生成、促进凋亡,减少转移,并可以改善耐药的卵巢癌细胞对化疗敏感性,从而证实了IL-6/STAT3信号通路可能在卵巢癌发病机制和治疗中的重要意义[4-5, 16]。上述研究结果表明survivin与IL-6/STAT3信号通路见存在紧密的功能联系。因此,我们推测survivin ASODN可能也通过抑制某一重要的信号转导通路活性并影响survivin等癌基因的表达起作用的。本研究虽证实了survivinASODN在活体内抑制人卵巢癌细胞裸鼠腹腔种植性转移能力的作用,但其作用机制不清楚。因此,我们进一步采用蛋白印迹方法分析了两组裸鼠卵巢癌腹腔移植瘤组织中相关蛋白的变化,结果发现:survivinASODN组人卵巢癌细胞裸鼠腹腔移植瘤组织中IL-6、STAT3、p-STAT3、survivin蛋白表达较对照组均明显下降(P<0.05;P<0.05;P<0.01;P<0.05),这一结果表明在活体内survivin ASODN能通过抑制卵巢癌细胞IL-6蛋白的表达,降低了细胞内STAT3及其磷酸化STAT3蛋白的水平,从而降低了IL-6/STAT3信号通路活性,进一步降低了下游功能基因survivin的蛋白表达,从而起到抑制卵巢癌细胞腹腔转移的作用。这一结果一方面进一步证实了IL-6/STAT3信号通路在卵巢癌腹腔转移发病机制中的作用,另一方面也为揭示了survivinASODN腹腔干预在防治卵巢癌腹腔种植性转移中的作用机制,即:这一作用可能是通过抑制卵巢癌细胞及其微环境中IL-6/STAT3信号通路活性从而进一步抑制下游癌基因表达来完成的。研究结果尚未见相关报道,本研究必然会为解决相关领域中的难题提供重要理论基础。
通过实验证实了针对survivin设计的ASODN能有效地减少卵巢癌的腹腔转移,这一作用与其抑制IL-6/STAT3 信号通路的活性密切相关。因此,腹腔注射survivin ASODN可能成为复发性和难治性卵巢癌新的防治途径。通过调节IL-6/STAT3信号通路的活性改变卵巢癌细胞种植性转移能力,影响腹腔转移瘤形成,可能是卵巢癌腹腔转移复发以及针对survivin靶向基因治疗的重要机制。相关研究结果为进一步探明卵巢癌腹腔转移发病机制和找到更好的临床防治方法奠定了重要理论基础。
| [1] | Chen L, Liang L, Yan X, et al. Survivin status affects prognosis and chemosensitivity in epithelial ovarian cancer[J]. Int J Gynecol Cancer,2013, 23 (2) : 256-63. DOI: 10.1097/IGC.0b013e31827ad2b8. |
| [2] | Kumar J, Fraser FW, Riley C, et al. Granulocyte colony-stimulating factor receptor signalling via Janus kinase 2/signal transducer and activator of transcription 3 in ovarian cancer[J]. Br J Cancer,2014, 110 (1) : 133-45. DOI: 10.1038/bjc.2013.673. |
| [3] | Paul BT, Blanchard Z, Ridgway M, et al. BRCA1-IRIS inactivation sensitizes ovarian tumors to cisplatin[J]. Oncogene,2015, 34 (23) : 3036-52. DOI: 10.1038/onc.2014.237. |
| [4] | Suh YA, Jo SY, Lee HY, et al. Inhibition of IL-6/STAT3 axis and targeting Axl and Tyro3 receptor tyrosine kinases by apigenin circumvent taxol resistance in ovarian cancer cells[J]. Int J Oncol,2015, 46 (3) : 1405-11. |
| [5] | Kumar J, Ward AC. Role of the interleukin 6 receptor family in epithelial ovarian cancer and its clinical implications[J]. Biochim Biophys Acta,2014, 1845 (2) : 117-25. |
| [6] | No JH, Jeon YT, Kim YB, et al. Quantitative detection of serum survivin and its relationship with prognostic factors in ovarian cancer[J]. Gynecol Obstet Invest,2011, 71 (2) : 136-40. DOI: 10.1159/000316049. |
| [7] | Kuşku Cabuk F, Yığıt S, Demır L, et al. Correlation of survivin and MMP9 expressions with prognosis and clinicopathological parameters in surface epithelial ovarian carcinomas[J]. Turk Patoloji Derg,2014, 30 (1) : 30-7. |
| [8] | R?del F, Sprenger T, Kaina B, et al. Survivin as a prognostic/ predictive marker and molecular target in cancer therapy[J]. Curr Med Chem,2012, 19 (22) : 3679-88. DOI: 10.2174/092986712801661040. |
| [9] | 孙艳, 李勇, 范立侨, 等. Survivin反义寡核苷酸对卵巢癌细胞株凋 亡和侵袭、迁移的影响[J]. 肿瘤,2007, 27 (9) : 694-7. |
| [10] | Carrasco RA, Stamm NB, Marcusson E, et al. Antisense inhibition of survivin expression as a cancer therapeutic[J]. Mol Cancer Ther,2011, 10 (2) : 221-32. DOI: 10.1158/1535-7163.MCT-10-0756. |
| [11] | Altieri DC. Targeting survivin in cancer[J]. Cancer Lett,2013, 332 (2) : 225-8. DOI: 10.1016/j.canlet.2012.03.005. |
| [12] | Morrison DJ, Hogan LE, Condos G, et al. Endogenous knockdown of survivin improves chemotherapeutic response in ALL models[J]. Leukemia,2012, 26 (2) : 271-9. DOI: 10.1038/leu.2011.199. |
| [13] | Takakura M, Nakamura M, Kyo S, et al. Intraperitoneal administration of telomerase-specific oncolytic adenovirus sensitizes ovarian cancer cells to cisplatin and affects survival in a xenograft model with peritoneal dissemination[J]. Cancer Gene Ther,2010, 17 (1) : 11-9. DOI: 10.1038/cgt.2009.44. |
| [14] | Ataie-Kachoie P, Morris DL, Pourgholami MH. Minocycline suppresses interleukine-6, its receptor system and signaling pathways and impairs migration, invasion and adhesion capacity of ovarian cancer cells: in vitro and in vivo studies[J]. PLoS One,2013, 8 (4) : e60817. DOI: 10.1371/journal.pone.0060817. |
| [15] | Olie RA, Simões-Wüst AP, Baumann B. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy[J]. PLoS One,2013, 8 (4) : e60817. DOI: 10.1371/journal.pone.0060817. |
| [16] | Groner B, Weiss A. Targeting survivin in cancer: novel drug development approaches[J]. PLoS One,2013, 8 (4) : e60817. DOI: 10.1371/journal.pone.0060817. |
| [17] | Tanioka M, Nokihara H, Yamamoto N. Phase I study of LY2181308, an antisense oligonucleotide against survivin, in patients with advanced solid tumors [J]. PLoS One,2013, 8 (4) : e60817. DOI: 10.1371/journal.pone.0060817. |
 2015, Vol. 35
2015, Vol. 35
