2. 遵义医学院附属医院1输血科, 贵州 遵义 563003 ;
3. 遵义市第一人民医院检验科, 贵州 遵义 563002
2. Department of Blood Transfusion, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China ;
3. Department of Clinical Laboratory, First People's Hospital of Zunyi, Zunyi 563002, China
肺炎链球菌(Streptococcus pneumoniae,S.pn)是引起细菌性肺炎、中耳炎、脑膜炎等疾病的一种重要致病菌,其在婴幼儿及老年人中具有很高的发病率与死亡率,每年全球约有160万人死于S.pn感染[1]。近年来随着耐药菌株的出现及流行,给S.pn治疗带来严峻挑战[2]。因此,开展肺炎链球菌致病机制的研究,对研发有效的肺炎链球菌蛋白疫苗及抗菌药物显得尤为重要。
spd1672 基因是本课题组在肺炎链球菌中通过体内诱导技术筛选出来的潜在毒力因子,该基因在不同荚膜血清型肺炎链球菌间高度保守,前期研究结果显示该基因敲除后肺炎链球菌磷壁酸合成显著减少,但其在致病过程中的作用尚不完全清楚[3-4]。因此,本研究拟在腹腔感染模型上研究spd1672基因敲除对肺炎链球菌毒力的影响及可能机制。
1 材料与方法 1.1 材料肺炎链球菌D39 菌株及D39 菌spd1672 基因敲除菌株(D39△1672),A549 细胞为本室保存。SPF 级BALB/c小鼠,新西兰大白兔由重庆医科大学实验动物中心提供。
1.2 小鼠腹腔毒力实验将5周龄的雌性BALB/c小鼠随机分成2组,每组8只,经腹腔注射100 μL浓度为1×108 CFU的肺炎链球菌D39及D39△1672菌液,记录小鼠死亡时间。本研究还进一步做了菌浓度为106 CFU的小鼠腹腔毒力实验,方法同前。
1.3 腹腔攻毒后细菌小鼠血细菌载量分析将5周龄的雌性BALB/c小鼠按每个时间点2组分配,每组6只,共3个时间点。然后经腹腔注入菌量为1×106 CFU的肺炎链球菌D39、D39△1672菌株,于8、12、24 h时,将小鼠用乙醚麻醉,无菌条件经心脏取血,培养计数。
1.4 粘附实验24 孔板培养A549 细胞至铺满孔底(约2×105/孔)。同步培养肺炎链球菌D39、D39△1672菌株至对数生长期,用1 mL DMEM(10%FCS)稀释菌密度为107 CFU/mL。取稀释好的细菌与细胞按100∶1的比例孵育1 h后,PBS洗去未粘附的细菌。胰酶消化细胞后稀释铺板,培养计数细菌菌落数。
1.5 侵袭实验24孔板培养A549细胞至铺满孔底(约2×105/孔)。同步培养肺炎链球菌D39、D39△1672 菌株至对数生长期,用1 mL DMEM(10%FCS)稀释菌密度为107 CFU/mL。取稀释好的细菌与细胞按100∶1的比例孵育1 h后,PBS洗去未粘附的细菌。加入1 mL含有10%FCS、氨苄青霉素(100 U/mL)和庆大霉素(100 μg/mL)的DMEM到24孔板中同细胞孵育1 h,杀死细胞外的细菌。胰酶消化细胞后稀释铺板,培养计数细菌菌落数。
1.6 全血细胞杀菌实验[5]收集对数生长期的肺炎链球菌D39 和D39△1672 菌株,PBS洗涤细菌后,调节细菌菌量为约100 CFU/10 μL。抽取新西兰大白兔新鲜肝素抗凝全血,将90 μL抗凝血与10 μL菌液混匀后,在37 ℃水浴孵育1 h,2 h,3 h后铺板计数,每个时间点做5个平行孔。
1.7 细胞因子测定培养肺炎链球菌D39、D39△1672菌株至对数生长中期,调节细菌菌量为1×106 CFU/100 μL。将5周龄的BALB/c小鼠按每个时间点2组分配,每组4只,分别设置4、8、12、24 h四个时间点。进行腹腔攻毒,每只攻毒剂量为100 μL。然后分别在4、8、12、24 h通过眼眶取血法取小鼠全血,分离血清用于细胞因子水平检测。
1.8 数据分析处理两组间比较采用t检验,多组间显著性检验采用单因素方差分析,P<0.05为差异有统计学意义。
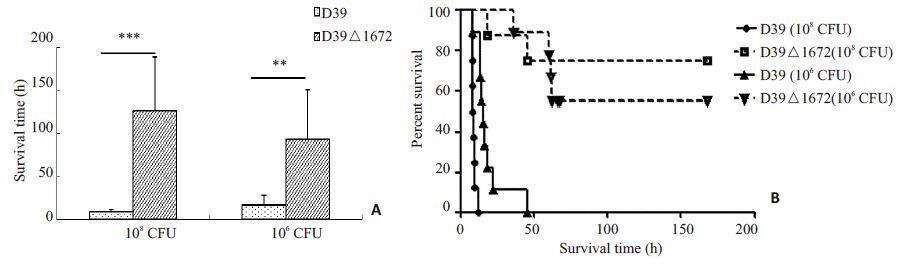
2 结果 2.1 腹腔攻毒后小鼠生存实验在腹腔攻毒菌量为108CFU时,感染D39菌株的小鼠中位生存时间为9.4 h,而感染D39△1672菌株的小鼠中位生存时间为126.6 h,感染D39△1672菌的小鼠生存时间显著高于D39菌株(P<0.001);当感染菌量为106CFU时,感染D39△1672菌的小鼠生存时间同样显著高于感染D39菌株的小鼠(93.6 h vs 16.7 h,P<0.01),见图 1A。从小鼠生存率来看,无论是感染菌量为108CFU还是106CFU,感染D39△1672菌的小鼠生存率都要著高于D39菌感染组(图 1B)。
|
图 1 BALB/c小鼠腹腔感染毒力实验 Figure 1 Virulence assessment of D39 and D39 △ 1672 strains in BALB/c mice. A: Survial time of mice infected with 106 and 108 CFU S.pn; B: Survial rate of the mice. **P<0.01; ***P<0.001. |
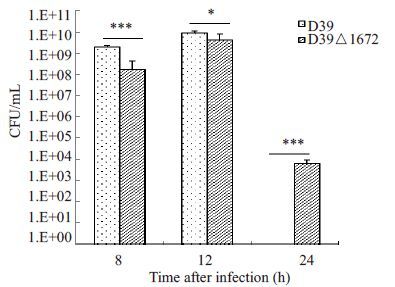
BALB/c小鼠经腹腔感染1×106 CFU菌12 h时,血中细菌载量达到峰值,在8 h和12 h时,D39△1672入血菌量显著少于D39菌株(P<0.05);感染D39菌株的小鼠在24 h时已全部死亡,而感染D39△1672菌株的小鼠血中菌量在24 h时较8 h和12 h显著减少(图 2)。
|
图 2 腹腔攻毒后小鼠血中细菌载量 Figure 2 Blood bacterial load after intraperitoneal infection of the two strains in mice. *P<0.05; ***P<0.001. |
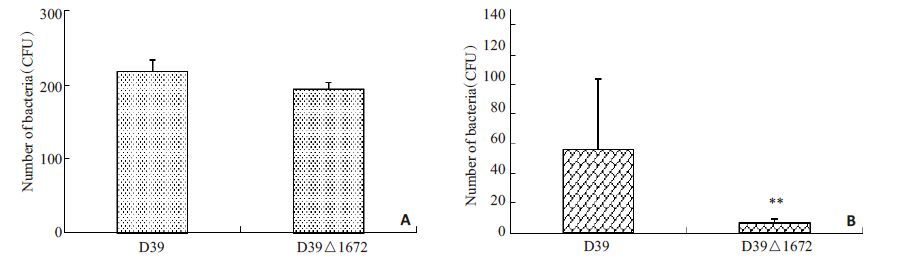
D39菌和D39 △1672菌对A549细胞的粘附能力无差异(图 3A)。而侵袭实验结果显示,D39 △1672菌对A549细胞的侵袭力较D39菌显著减弱(P<0.05,图 3B)。
|
图 3 D39和D39△1672对A549细胞的粘附(A)及侵袭(B)实验 Figure 3 Adhesion (A) and invasion (B) assays of D39 and D39△1672 strains in A549 cells. **P<0.01. |
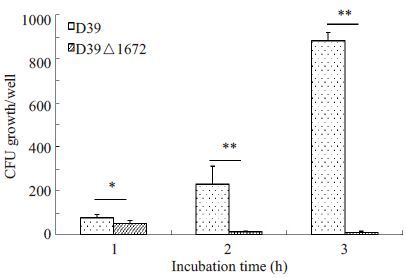
D39△1672 菌与全血细胞孵育后,随着孵育时间的延长,存活率呈现逐渐下降趋势,相反,D39菌株呈现逐步增殖上升的趋势,D39△1672菌对全血细胞的杀菌作用的抵抗能力较D39菌显著减弱(P<0.05,图 4)。
|
图 4 全血杀菌实验 Figure 4 Bactericidal assays of rabbit whole blood for D39 and D39△1672 strains. *P<0.05;**P<0.01. |
在D39、D39△1672 菌感染的小鼠后,细胞因子IL12、TNF-α、IFN-γ水平呈逐渐升高的趋势,12 h 达到峰值,D39△1672感染小鼠在24 h时细胞因子水平均下降,而D39感染小鼠在20 h内全部死亡;从细胞因子水平整体趋势来看,D39 感染小鼠后诱导产生的IL12、TNF-α、IFN-γ水平呈现出高于D39△1672菌感染组的趋势(图 5)。
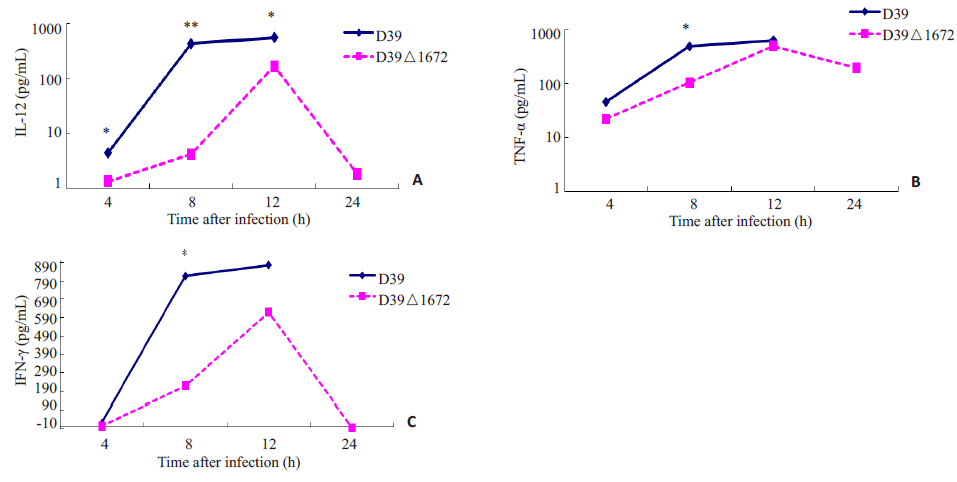
|
图 5 细胞因子水平测定 Figure 5 Serum levels of cytokines in mice with pneumococcal infection. *P<0.05; **P<0.01. |
磷壁酸是革兰阳性菌细胞表面的一种多糖聚合物,根据其锚定部位不同,可以分为壁磷壁酸和脂磷壁酸,它在细菌生长繁殖、生理功能的维持及致病等过程中有重要作用[6-8]。研究发现基因敲除的D39△1672菌株经腹腔感染小鼠后,小鼠中位生存时间及生存率显著高于D39野生菌组。提示spd1672基因敲除后会导致肺炎链球菌毒力显著降低,是一种重要的毒力因子。为了观察其在S.pn致病过程可能的作用机制,本研究进一步对基因敲除前后细菌侵袭入血能力进行了分析,结果显示D39△1672菌感染小鼠后其侵袭入血能力较D39野生菌株显著降低,这可能与D39△1672菌株磷壁酸合成减少相关。目前研究显示,磷壁酸是细菌感染致病过程中重要的毒力因子,能与宿主分子发生相互作用。如金黄色葡萄球菌壁磷壁酸能与F 型清道夫受体SREC-I相互作用,介导细菌对上皮细胞的粘附及在鼻咽部的定植[9-10]。而在肺炎链球菌中,其脂磷壁酸能与宿主血小板活化因子受体相互作用,以增加肺炎链球菌对上皮细胞与内皮细胞的侵袭能力[11]。此外,肺炎链球菌磷壁酸中的磷酸胆碱还是胆碱结合蛋白的锚定部位,该家族蛋白是在细菌粘附、侵袭等致病过程中发挥着重要作用[12-13]。而磷壁酸合成减少会影响细菌表面胆碱结合蛋白的表达[14]。在本研究中,D39△1672菌株磷壁酸合成减少故其对A549细胞的侵袭能力显著降低。此外,全血杀菌实验还证明spd1672基因敲除能显著影响肺炎链球菌对宿主全血细胞杀菌作用的抵抗力,从而影响其在宿主体内的存活能力。通过分析细菌入血载量发现,D39△1672菌在感染24 h时较12 h显著下降,提示D39△1672更易被宿主防御细胞清除,这与全血杀菌实验结果相符。通过对血中细胞因子水平分析发现,D39△1672菌感染后,小鼠体内炎性细胞因子的分泌水平低于D39菌感染组,在感染24 h时较12 h小鼠体内炎症细胞炎症水平显著降低。D39野生菌感染小鼠表现出更高的炎性细胞因子水平,可能与脂磷壁酸本身能够诱导IL-12、TNF-α、IL1-β等细胞因子的产生有关[15]。
综上所述,spd1672基因是肺炎链球菌中一种重要的毒力因子,其通过调控磷壁酸的合成而显著影响细菌的毒力,与细菌侵袭、抵抗宿主、致炎反应等致病过程相关。
| [1] | Isaacman DJ, Mcintosh ED, Reinert RR. Burden of invasivepneumococcal disease and serotype distribution amongStreptococcus pneumoniae isolates in young children in Europe:impact of the 7-valent pneumococcal conjugate vaccine andconsiderations for future conjugate vaccines[J]. Int J Infect Dis,2010, 14 (3) : e197-209. DOI: 10.1016/j.ijid.2009.05.010. |
| [2] | Geng Q, Zhang T, Ding Y, et al. Molecular characterization andantimicrobial susceptibility of Streptococcus pneumoniae isolatedfrom children hospitalized with respiratory infections in Suzhou,China[J]. PLoS One,2014, 9 (4) : e93752. DOI: 10.1371/journal.pone.0093752. |
| [3] | Meng JP, Yin YB, Zhang XM, et al. Identification of Streptococcuspneumoniae genes specifically induced in mouse lung tissues[J]. Can J Microbiol,2008, 54 (1) : 58-65. DOI: 10.1139/W07-117. |
| [4] | Wu K, Huang J, Zhang Y, et al. A novel protein, RafX, is importantfor common cell wall polysaccharide biosynthesis in Streptococcuspneumoniae: implications for bacterial virulence[J]. J Bacteriol,2014, 196 (18) : 3324-34. DOI: 10.1128/JB.01696-14. |
| [5] | Yamaguchi M, Minamide Y, Terao Y, et al. Nrc of Streptococcuspneumoniae suppresses capsule expression and enhancesanti-phagocytosis[J]. Biochem Biophys Res Commun,2009, 390 (1) : 155-60. DOI: 10.1016/j.bbrc.2009.09.099. |
| [6] | Swoboda JG, Campbell J, Meredith TC, et al. Wall teichoic acidfunction, biosynthesis, and inhibition[J]. Chembiochem,2010, 11 (1) : 35-45. |
| [7] | Gehre F, Spisek R, Kharat AS, et al. Role of teichoic acid cholinemoieties in the virulence of Streptococcus pneumoniae[J]. InfectImmun,2009, 77 (7) : 2824-31. |
| [8] | Sewell EW, Brown ED. Taking aim at wall teichoic acid synthesis:new biology and new leads for antibiotics[J]. J Antibiot (Tokyo),2014, 67 (1) : 43-51. DOI: 10.1038/ja.2013.100. |
| [9] | Weidenmaier C, Kokai-Kun JF, Kristian SA, et al. Role of teichoicacids in Staphylococcus aureus nasal colonization, a major riskfactor in nosocomial infections[J]. Nat Med,2004, 10 (3) : 243-5. DOI: 10.1038/nm991. |
| [10] | Baur S, Rautenberg M, Faulstich M, et al. A nasal epithelial receptorfor Staphylococcus aureus WTA governs adhesion to epithelial cellsand modulates nasal colonization[J]. PLoS Pathog,2014, 10 (5) : e1004089. DOI: 10.1371/journal.ppat.1004089. |
| [11] | Iovino F, Brouwer MC, Van De Beek D, et al. Signalling or binding:the role of the platelet-activating factor receptor in invasivepneumococcal disease[J]. Cell Microbiol,2013, 15 (6) : 870-81. DOI: 10.1111/cmi.2013.15.issue-6. |
| [12] | Swiatlo E, Champlin FR, Holman SC, et al. Contribution ofcholine-binding proteins to cell surface properties of Streptococcuspneumoniae[J]. Infect Immun,2002, 70 (1) : 412-5. DOI: 10.1128/IAI.70.1.412-415.2002. |
| [13] | Molina R, González A, Stelter M, et al. Crystal structure of CbpF, abifunctional choline-binding protein and autolysis regulator fromStreptococcus pneumoniae[J]. EMBO Rep,2009, 10 (3) : 246-51. DOI: 10.1038/embor.2008.245. |
| [14] | Kim JO, Weiser JN. Association of intrastrain phase variation inquantity of capsular polysaccharide and teichoic acid with thevirulence of Streptococcus pneumoniae[J]. J Infect Dis,1998, 177 (2) : 368-77. DOI: 10.1086/jid.1998.177.issue-2. |
| [15] | Hirose Y, Murosaki S, Fujiki T, et al. Lipoteichoic acids onLactobacillus plantarum cell surfaces correlate with induction ofinterleukin-12p40 production[J]. Microbiol Immunol,2010, 54 (3) : 143-51. DOI: 10.1111/j.1348-0421.2009.00189.x. |
 2015, Vol. 35
2015, Vol. 35
