2. 广州军区广州总医院ICU科, 广东 广州 510100 ;
3. 郑州市第三人民医院血液净化科, 河南 郑州 450000
2. Department of ICU of General Hospital of Guangzhou Military Command, Guangzhou 510010, China; ;
3. Department of Blood purification of The Third People Hospital of Zhengzhou, Zhengzhou 450000, China
脓毒症病情凶险,已成为重症监护室病人死亡的主要原因[1]。血管内皮细胞通透性增高是脓毒症休克的重要发病机制。内皮细胞层的完好无损对于维持其屏障完整,保护组织器官功能至关重要。炎性细胞因子或者氧自由基增多等多种原因均可使细胞骨架F-actin收缩使细胞间隙增大、增多,形成细胞旁通路,导致血管通透性升高,进而导致血管内液外渗,组织水肿,微循环衰竭[2]。临床上针对血管通透性增高的治疗多是针对相应的刺激物所引发的不同细胞转导通路给予相应的药物进行抑制,或者采取血液滤过手段清除血中毒性物质。
连续静脉-静脉血液滤过(CVVH)和乌司他丁(ULI)能够改善脓毒症患者的预后,是潜在的治疗脓毒症的有效手段。血液滤过可以降低血清中血管性血友病因子(vWF)水平,改善内皮细胞功能[3]。乌司他丁可减轻脓毒症所引起的内皮细胞损伤和通透性[4-5]。然而,尚无血液滤过和乌司他丁联合治疗的相关研究,且二者联合作用对脓毒性休克患者内皮细胞通透性影响的机制目前仍不太清楚。
p38 信号通路为丝裂原活化蛋白激酶(MAPK)家族的重要成员,不仅在炎症、应激反应中具有重要作用,还参与细胞的存活、分化和凋亡等过程,是细胞众多信号转导通路的中转站。且p38信号通路的激活在内皮细胞通透性增高中起着重要的作用[2]。因此,本研究假设脓毒症患者内皮细胞p38信号通路被激活,导致内皮细胞通透性增高,而ULI和CVVH治疗可通过抑制p38信号通路,减轻脓毒症患者内皮细胞的高通透性,从而起到治疗作用。
1 材料与方法 1.1 细胞株及主要试剂人脐静脉内皮细胞(HUVECs)(Sciencell)、DMEM/F12培养基、胎牛血清(FBS)、胰酶、青霉素和链霉素购自Gibco。磷酸化p38、总p38 抗体和二抗购自Santa Cruz。FITC 标记的白蛋白和p38 抑制剂SB203580购自Sigma,罗丹明-鬼笔环肽购自MolecularProbe,微孔小皿以及transwell小皿购自Corning。
1.2 人血清分离分别抽取正常人群(control)、脓毒性休克常规治疗(CT)及脓毒性休克连续静脉-静脉血液滤过(CVVH)和乌司他丁(ULI)治疗(CVVH-ULI)患者全血,静置30 min后,1000 g离心15 min,取上清,置于-80 ℃冰箱保存,使用时用DMEM/F12培养基稀释成5%的浓度。
1.3 人脐静脉内皮细胞培养及实验分组处理将HUVECs 培养于DMEM/F12,并添加10%FBS,置于含有5% CO2的细胞培养箱内。当HUVECs长至90%融合时,换用无血清培养基继续培养12 h,然后分别换用5% CT组和CVVH-ULI组患者血清(培养基稀释)5 mL继续培养6 h。
1.4 F-actin染色将HUVECs按l×105/mL接种于微孔小皿中,待细胞长满融合后,去血清饥饿12 h,按上述实验分组处理,用冷的PBS 液漂洗2 min 并重复3 次,3.7%多聚甲醛4 ℃孵育l0 min,用PBS液漂洗3 次,再用0.5% Triton-100 4 ℃孵育l5 min,PBS液漂洗3次,最后用2 U/mL的罗丹明-鬼笔环肽室温避光孵育l h,继以PBS液漂洗3次。加入DAPI染色5 min后,PBS液漂洗3次。染色结束后立即用激光共聚焦显微镜观察细胞F-actin形态改变。
1.5 内皮细胞通透性检测内皮细胞通透性检测采用FITC标记的白蛋白,参照文献[6]进行。将HUVECs接种于transwell 小皿顶层小室微孔膜上(直径6.5 mm,孔径为0.4 mm),待细胞长至融合后,无血清饥饿培养12 h。按实验分组进行处理后,加200 μL(1 mg/mL)的FITC标记的白蛋白于顶层小室,5% CO2,37 ℃孵育45 min。在每个双层小室的顶室和底室分别取样品l00 μL,置于黑色96孔板,用多孔板高效阅读器(HTS 7000,日本)检测样品的荧光强度,激发光波长485 nm,发射光波595 nm。同时测量底室液体量。内皮细胞单层对蛋白通透性大小用通透系数Pa表示,按以下公式计算:Pa=[A]/t×l/A×v/[L]。式中[A]为顶层蛋白浓度(以荧光强度表示),t为时间,以秒汁算,A是滤膜积,以cm2计算,v为底室液体,[L]为底室蛋白浓度。实验结果Pa百分比变化表示,Pa%=(实验样品Pa/对照样品Pa)×l00。
1.6 Western blot细胞总蛋白的提取按说明书进行,采用BCA 法测定蛋白浓度,将20 μg 总蛋白与上样缓冲液混合后100 ℃变性5 min,12%聚丙烯酰胺凝胶电泳,100 mA湿转转膜80 min,5% BSA室温封闭1 h,分别与兔抗人p-p38和p38抗体(1∶1000)4℃ 孵育过夜,辣根过氧化物酶标记山羊抗兔IgG(1∶6000)室温孵育1 h,TBST洗3次,化学发光剂ECL 作用1 min,用Image Station2000R图像工作站取像,Image J图像分析软件分析目标条带光密度值。
1.7 统计分析所有实验均重复3次以上,数据以均数±标准差表示,采用SPSS 13.0软件进行统计分析。多组之间的比较采用方差分析,组间的差异采用LSD-t检验,P<0.05表示有统计学意义。
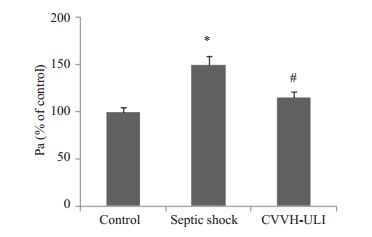
2 结果 2.1 内皮细胞通透性检测分别以control、CT 及CVVH-ULI 组血清刺激HUVECs 6 h,然后用FITC标记白蛋白渗漏法检测内皮细胞通透性。研究发现,CT组血清刺激内皮细胞对FITC标记的白蛋白渗漏显著增加,而CVVH-ULI组血清刺激内皮细胞对FITC标记白蛋白渗漏明显减轻(图 1)。
|
图 1 治疗方式对脓毒性休克诱导的血管内皮细胞通透性的影响 Figure 1 Effect of therapeutic regimen on the vascular endothelial hyperpermeability induced by septic shock. *P<0.05 vs control; #P<0.05 vs CT. |
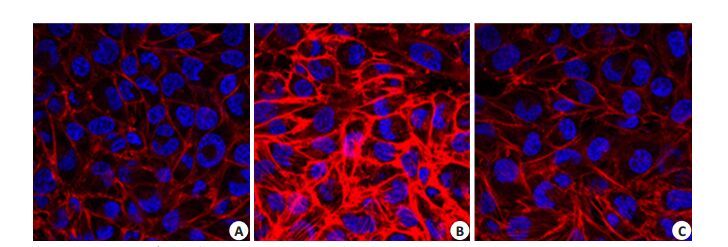
按上述分组处理内皮细胞6 h后,用罗丹明-鬼笔环肽染色F-actin。与control组比较,CT组患者血清处理的内皮细胞F-actin 结构紊乱,应力纤维生成。而CVVH-ULI 组则显著改善上述F-actin 的形态学改变(图 2)。
|
图 2 治疗方式对脓毒性休克诱导的F-actin的形态学改变的影响 Figure 2 Effect of therapeutic regimen on the morphological changes of F-actin induced by septic shock (Original magnification: × 200 ). Cells were stained with rhodamine-phalloidin(F-actin, red)and DAPI (nuclei, blue). A: Control; B: CT; C: CVVH-ULI. |
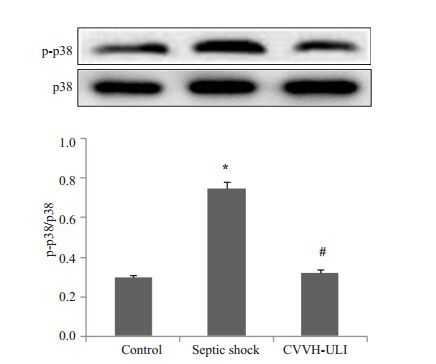
按上述分组处理内皮细胞6 h后,提取蛋白,检测p38磷酸化水平的改变。CT组p38磷酸化水平显著增加,而CVVH-ULI组p38磷酸化水平则显著低于CT组(图 3)。
|
图 3 治疗方式对脓毒性休克诱导p38磷酸化的影响 Figure 3 Effect of therapeutic regimen on T p38 phosphorylation induced by septic shock. *P<0.05 vs control, #P<0.05 vs CT. |
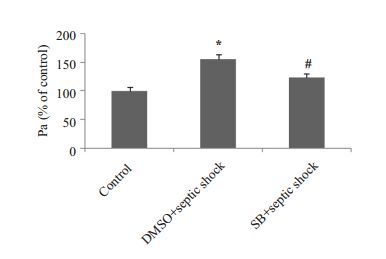
用p38 抑制剂SB203580 及DMSO 预处理HUVECs 30 min后,再用CT组患者血清处理内皮细胞6 h。p38抑制剂可显著抑制脓毒性休克所引起的内皮细胞通透性增加(图 4)。
|
图 4 p38MAPK在脓毒性休克引起的内皮细胞通透性改变中的作用 Figure 4 The role of p38 MAPK in endothelial hyperpermeability induced by septic shock. *P<0.05 vs control, #P<0.05 vs CT. |
实验分组同上。p38抑制剂可显著抑制脓毒性休克所诱导的内皮细胞F-actin形态的改变。
3 讨论微血管通透性增高及渗漏是脓毒性休克的重要病理生理机制。CVVH和ULI可以改善脓毒症患者预后[7-12]。其机制主要基于CVVH和ULI治疗可以清除炎症介质,减轻脓毒症患者的炎症反应。近年来的研究发现[13-16],CVVH和ULI可以改善脓毒症患者的内皮细胞功能,然而其机制仍不清楚。本研究发现,CVVH和ULI联合治疗可以显著减轻脓毒性休克所引起的内皮细胞通透性增高,抑制细胞骨架的重排,其机制可能是通过抑制p38磷酸化影响细胞骨架结构,进而影响内皮细胞的屏障功能。
p38 MAPK信号在内皮细胞通透性的调控中起着重要的作用[2, 17]。p38磷酸化后可激活小热休克蛋白27(Hsp27),磷酸化的Hsp27无法与G-肌动蛋白结合,从而使内皮细胞中G-肌动蛋白聚集成F-肌动蛋白并呈长束条状改变,密度增加、变厚,集中在细胞的边缘,使内皮细胞通透性增加[18-21]。本研究发现,CVVH-ULI治疗可以抑制p38磷酸化,并且显著减轻脓毒性休克所引起的内皮细胞F-actin的重排,从而降低内皮细胞通透性。这些结果提示,CVVH-ULI治疗可能是通过抑制p38磷酸化,进而抑制F-actin重排来降低脓毒性休克所引起的内皮细胞通透性增高。
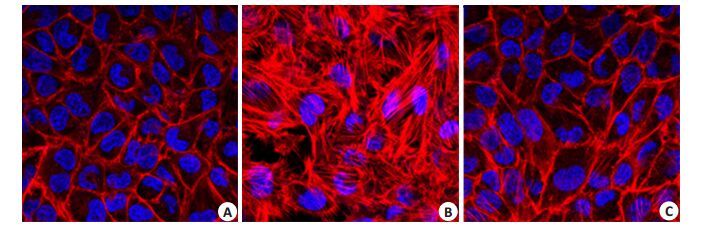
|
图 5 p38MAPK在脓毒性休克诱导的F-actin的形态学改变中的作用 Figure 5 The role of p38 MAPK in the morphological changes of F-actin induced by septic shock(Originalmagnification: × 200 ). Cells were stained with rhodamine-phalloidin(F-actin, red)and DAPI(nuclei,blue). A: Control; B: DMSO+CT; C: SB203580+CT. |
脓毒症患者内皮细胞p38信号的激活与内皮细胞活化或失功,血管通透性增高及脓毒症引起的心功能障碍密切相关[22-24]。脂多糖(LPS)和肿瘤坏死因子α(TNF-α)是脓毒症患者常见的炎症介质,均可激活内皮细胞p38信号通路。有研究证实[25],在LPS诱导的大鼠急性肺损伤时给予ULI可有效降低p38的磷酸化,并进而减轻LPS诱导的肺内皮及上皮细胞通透性增高所引发的急性肺水肿,而CVVH和ULI可清除脓毒症患者循环血中的LPS 和TNF-α。因此,本研究所证实的CVVH和ULI联合治疗可抑制p38信号通路,可能与其清除循环血中的LPS和TNF-α相关。本研究采用临床病人的血清刺激人血管内皮细胞,不仅进一步验证了CVVH和ULI联合应用改善内皮细胞功能确实是通过清除LPS等炎症介质,并进而抑制p38通路活化来起作用,而且对于指导临床治疗也有意义。
| [1] | Lever A, Mackenzie I. Sepsis: definitiondefinition,epidemiology,anddiagnosis[J]. BMJ,2007, 335 . |
| [2] | Guo X, Wang L, Chen B, et al. ERM protein moesin isphosphorylated by advanced glycation end products and modulatesendothelial permeability[J]. Am J Physiol Heart Circ Physiol,2009, 297 . |
| [3] | 姜福富, 覃纲, 韦柳青, 等. 连续性静脉血液滤过对脓毒症患者内皮功能的作用[J]. 实用临床医药杂志,2011, 15 . |
| [4] | 俞兆希, 石松菁, 沈阳辉. 乌司他丁对脓毒症大鼠血管内皮细胞功能保护作用研究[J]. 中华实用诊断与治疗杂志,2013, 27 . |
| [5] | 董晓敏, 余又新, 方林森. 乌司他丁对脓毒症大鼠血管内皮细胞的影响[J]. 安徽医药,2013 (07) : 1095-6. |
| [6] | 郭晓华, 黄巧冰, 陈波. 晚期糖化终产物诱导内皮细胞通透性增高[J]. 生理学报,2005 (02) : 205-10. |
| [7] | Sun Z, Ye H, Shen X, et al. Continuous venovenous hemofiltrationversus extended daily hemofiltration in patients with septic acutekidney injury: a retrospective cohort study[J]. Crit Care,2014, 18 : 70. |
| [8] | Dabrowski W, Kotlinska-Hasiec E, Schneditz D, et al. Continuousveno-venous hemofiltration to adjust fluid volume excess in septicshock patients reduces intra-abdominal pressure[J]. Clin Nephrol,2014, 82 : 41-50. |
| [9] | Servillo G, Vargas M, Pastore A, et al. Immunomodulatory effect ofcontinuous venovenous hemofiltration during sepsis: preliminarydata[J]. Biomed Res Int,2013, 14 : 108951. |
| [10] | Honoré PM, Jacobs R, Boer W, et al. New insights regardingrationale, therapeutic target and dose of hemofiltration and hybridtherapies in septic acute kidney injury[J]. Blood Purif,2012, 33 : 44-51. DOI: 10.1159/000333837. |
| [11] | Linder A, Russell JA. An exciting candidate therapy for sepsis:ulinastatin, a urinary protease inhibitor[J]. Intensive Care Med,2014, 40 : 1164-7. DOI: 10.1007/s00134-014-3366-9. |
| [12] | Saigal S, Kapoor G. Ulinastatin: is it worth using in severe sepsis?[J]. Intensive Care Med,2014, 40 : 1185. DOI: 10.1007/s00134-014-3341-5. |
| [13] | Tanaka R, Fujita M, Tsuruta R, et al. Urinary trypsin inhibitorsuppresses excessive Generation of superoxide anion radical,systemic inflammation, oxidative stress, and endothelial injury inendotoxemic rats[J]. Inflamm Res,2010, 59 : 597-606. DOI: 10.1007/s00011-010-0166-8. |
| [14] | Li G, Li T, Li Y, et al. Ulinastatin inhibits oxidant-inducedendothelial hyperpermeability and apoptotic signaling[J]. Int J ClinExp Pathol,2014, 7 : 7342-50. |
| [15] | Abdelhafeez AH, Jeziorczak PM, Schaid TR, et al. Clinical cvvhmodel removes endothelium-derived microparticles from circulation[J]. J Extracell Vesicles,2014, 17 : 89. |
| [16] | Bellien J, Fréguin-Bouilland C, Joannidès R, et al. High-efficiencyon-line haemodiafiltration improves conduit artery endothelialfunction compared with high-flux haemodialysis in end-stage renaldisease patients[J]. Nephrol Dial Transplant,2014, 29 : 414-22. DOI: 10.1093/ndt/gft448. |
| [17] | Wolfson RK, Chiang. Hmgb1 induces human lungendothelial cell cytoskeletal rearrangement and barrier disruption[J]. Microvasc Res,2011, 81 (2) : 189-97. DOI: 10.1016/j.mvr.2010.11.010. |
| [18] | Pichon S, Bryckaert M, Berrou E. Control of actin dynamics by p38MAP kinase - Hsp27 distribution in the lamellipodium of smoothmuscle cells[J]. J Cell Sci,2004, 117 : 2569-77. DOI: 10.1242/jcs.01110. |
| [19] | Nguyen A, Chen P, Cai H. Role of CaMKII in Hydrogen peroxideactivation of ERK1/2, p38 MAPK, HSP27 and actin reorganizationin endothelial cells[J]. FEBS Lett,2004, 572 : 307-13. DOI: 10.1016/j.febslet.2004.06.061. |
| [20] | Hirano S, Rees RS, Yancy SL, et al. Endothelial barrier dysfunctioncaused by LPS correlates with phosphorylation of HSP27 in vivo[J]. Cell Biol Toxicol,2004, 20 : 1-14. DOI: 10.1023/B:CBTO.0000021019.50889.aa. |
| [21] | Huot J, Houle F, Marceau F, et al. Oxidative stress-induced actinreorganization mediated by the p38 mitogen-activated proteinkinase/heat shock protein 27 pathway in vascular endothelial cells[J]. Circ Res,1997, 80 : 383-92. DOI: 10.1161/01.RES.80.3.383. |
| [22] | Chen G, Zhao J, Yin Y, et al. C-type natriuretic peptide attenuatesLPS-induced endothelial activation: involvement of p38, Akt, andNF-κB pathways[J]. Amino Acids,2014, 46 : 2653-63. DOI: 10.1007/s00726-014-1816-x. |
| [23] | Coquerel D, Neviere R, Delile E, et al. Gene deletion of proteintyrosine phosphatase 1B protects against Sepsis-Inducedcardiovascular dysfunction and mortality[J]. Arterioscler ThrombVasc Biol,2014, 34 : 1032-44. DOI: 10.1161/ATVBAHA.114.303450. |
| [24] | Liang Y, Li X, Zhang X, et al. Elevated levels of plasma TNF-α areassociated with microvascular endothelial dysfunction in patientswith sepsis through activating the NF-κB and p38 mitogenactivatedprotein kinase in endothelial cells[J]. Shock,2014, 41 : 275-81. DOI: 10.1097/SHK.0000000000000116. |
| [25] | Zhang X, Liu F, Liu H, et al. Urinary trypsin inhibitor attenuateslipopolysaccharide-induced acute lung injury by blocking theactivation of p38mitogen-activated protein kinase[J]. Inflamm Res,2011, 60 : 569-75. DOI: 10.1007/s00011-010-0305-2. |
 2015, Vol. 35
2015, Vol. 35
