2. 广州军区广州总医院整形美容外科, 广东 广州 510010 ;
3. 南方医科大学第三附属医院骨科研究院, 广东 广州 510665 ;
4. 广东省第二人民医院创伤外科, 广东 广州 510317
2. Department of Plastic Surgery, General Hospital of Guangzhou Military Command, Guangzhou 510010, China ;
3. Academy of Orthopedics of Guangdong Province, Department of Orthopedics, Third Affiliated Hospital of Southern Medical University, Guangzhou 510665, China ;
4. Department of Orthopedics and Microsurgery, Second Guangdong Provincial People's Hospital, Guangzhou 510317, China
骨缺损常因创伤、畸形等多种原因所致,全球每年有需要进行两百多万例的骨移植手术,而其中,由于外伤所致的颅骨缺损约占骨缺损的总数的1/5[1]。针对骨缺损,临床最常用治疗方法是自体骨移植。自体骨移植虽然是目前骨缺损修复的金标准,但受限于取骨区的多种并发症以及骨量有限等问题,自体骨移植仅能覆盖8%~20%,因此,理想的生物材料本身必须具有良好的理化性质,在拥有接近人体组织的强度、韧性的同时,降解产物无毒,无磁性都是生物活性材料的基本要求。同时,在颅骨缺损中,理想的骨移植物被认为应具备3点骨学特点:1:骨再生性,即可直接在材料中发生骨再生反应;2:骨诱导性,即诱导成骨细胞前体迁移,分化,加速移植周边部位成骨反应;3:骨传导性,通过吸引成骨细胞前体迁移至材料内部后再诱导成骨细胞转移至缺损周边,继发产生成骨反应[3-4]。然而,现行的生物材料,在缺乏种子细胞与生物因子的附着时,均未被报道存在以上生物特点[5]。因此,理想的生物骨替代物的研发一直以来都是临床研究的重点领域。
2004 年,Yang 等[6]通过简单而经济的聚合法合成了第一种聚柠檬酸生物材料(CABE)—聚柠檬酸二醇酯(POC)。将聚柠檬酸材料与人体骨合成原料羟基磷灰石按一定比例化合,可以得到与人体骨骼理化特性几乎一致的生物活性材料。聚柠檬酸生物材料不仅具有良好的强度,韧性与可塑性,同时降解产物为人体内环境本身存在的柠檬酸。由于来源极易获得,合成方法经济简单,基于以上特点,聚柠檬酸生物材料具有极高的临床推广潜力。
至今,聚柠檬酸生物材料已研发至第3代。在之前的体外研究中,第3代聚柠檬酸生物展现出了良好的生物相容性及骨诱导性[6-7]。然而,这种新型的高分子填充材料在骨缺损的动物模型上并未进行评估。同时,由于颅骨再生是一个膜内成骨的过程,而软组织再生又是膜内成骨的重要生物基础[8]。因此,本研究在探讨评估新型聚柠檬酸生物材料在修复颅骨缺损的同时重点评估了第3代聚柠檬酸生物材料对软组织再生的诱导能力,为今后聚柠檬酸新型材料在骨缺损的临床应用奠定基础。
1 材料与方法 1.1 动物分组雄性Sprague Dawley大鼠(南方医科大学实验动物中心提供)共46只,8周龄,体质量200~220 g。随机选取6只SD大鼠大腿肌肉植入生物材料,两周后取材,其余24只随机分为4组:对照组10只,自体骨移植组10只,两种新型柠檬酸生物材料修复组各10只。
1.2 支架制作 1.2.1 CUPE预聚物和POC预聚物的合成 1.2.2 多孔的CUPE-HA 及POC -HA 盘型支架制备CUPE预聚体溶解于1,4—二恶烷中,并于65%重量的羟基磷灰石混合;在上述混合物中加入85%重量、平均体积大小为200~400 μm的氯化钠,在Teflon盘中搅拌直至形成同质的黏糊状物;然后将黏糊状物放入Teflon管(4 mm×2 mm;内径×高),形成盘状支架。蒸发溶剂1,4 - 二恶烷后,把上述盘状支架在100 ℃的烘箱内烘烤3 d,然后在真空环境下浸入去离子水中72 h,期间每12 h更换1次去离子水,使支架中的氯化钠析出。最终用冻干法使得支架干燥。
POC-HA支架用POC预聚体,按照上述CUPE-HA盘型支架一致的方法制作。喷金处理后的材料置于Hitachi,S-3000N 平台中扫描,Philips XL30 ESEMFEG系统采集500倍放大倍数的照片(图 1E,F)。
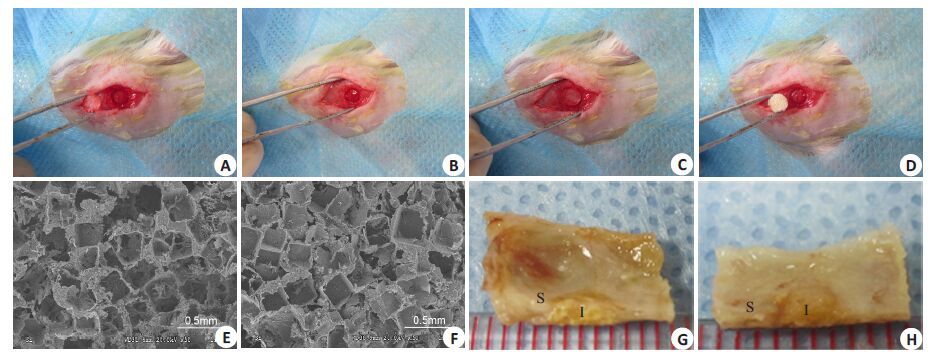
|
图 1 手术造模示意图 Figure 1 Surgical procedures of repairing skull defect in rats A: Model establishment (endocranium injury should be avoided); B:Control group without any implant; C: Auto-graft implant group; D: CUPE-HA implant group and POC-HA implant group; E: ECMresult of CUPE-HA, F: ECM result of POC-HA; G: General observation of CUPE-HA implant group at 3 months after operation (S:Bone; I: Implant); H: Gross observation of POC-HA implant group at 3 months after operation(S: Bone; I: Implant) |
用10%水合氯醛(100 mg/kg)腹腔注射麻醉,大鼠取俯卧位,术区备皮并铺消毒无菌洞巾,术前于颅骨矢状线皮下局部注射0.5 mL 1%利多卡因局部加强麻醉。于大鼠头颅中线(颅骨矢状线)行长约1.5 cm长的纵向皮肤切口,显露矢状缝、双侧顶骨及部分额骨及枕骨,纵行切开右侧顶骨骨膜,钝性分离骨膜,用4 mm口径的开口器于大鼠右侧顶骨正中位置打出4 mm痕迹后,开口器后端连接骨钻,沿颅骨预留痕迹钻取4 mm直径的大鼠颅骨,钻取的过程中用生理盐水滴注降温重新,术中应避免损伤硬脑膜;根据手术分组情况,分别行缺损处空缺、自体骨移植、柠檬酸生物骨材料支架移植(图 1A~D)。术后第3个月腹腔注射过量水合氯醛处死大鼠,收集大鼠颅骨标本(图 1G,H),行组织学染色及形态计量学分析。
1.4 影像学评估颅骨缺损的愈合骨缺损术后3个月,每组各取3只大鼠行颅骨样本取材后浸于4%多聚甲醛固定24 h 后,进行影像学micro-CT扫描,三维重建后评估颅骨缺损处的骨愈合情况。Micro-CT 三维重建使用ZKKSMCT-Sharp-Ⅲscanner系统(广州中科恺盛生物有限公司)。
1.5 组织学染色及免疫组化染色大鼠肌肉包埋材料样本及颅骨缺损样本浸泡于4%多聚甲醛24 h,EDTA甘油脱钙14 d,脱水后石蜡包埋,组织样本切为4 μm厚切片,行HE染色,其中大鼠肌肉包埋材料切片行VEGF免疫组化染色。
1.6 形态计量学分析骨缺损处的血管计数颅骨缺损区HE切片获取5个随机视野,依据文献报道,计算HE染色中血管内皮线性结构,计数血管后数据行单向方差分析[9]。
1.7 统计学处理实验所获数据结果以均数±标准差表示,使用SPSS13软件进行统计学分析。所有数据采用单项方差分析后进行Bonfferoni法,P<0.05时被认为有统计学差异。
2 结果 2.1 新型聚柠檬酸可降解材料可诱导肌肉软组织再生两种材料填充股四头肌两周后,HE染色结果显示填充部位材料内部出现新生纤维组织,填充部位没有出现炎性反应,与此同时,两种材料在填充部位均出现了明显的降解,在材料周边与内部均可以观察到明显的血管再生(图 2A,B)。这些现象说明了聚柠檬酸生物材料具有良好软组织诱导性以及较好的降解率。另一方面,血管内皮生长因子(VEGF)免疫组织化学染色中可以观察到填充材料周围以及内部有明显的阳性细胞,提示材料填充部位有明显的血管内皮发生(图 2C,D)。以上表明新型聚柠檬酸生物材料本身具有良好的软组织再生诱导性。
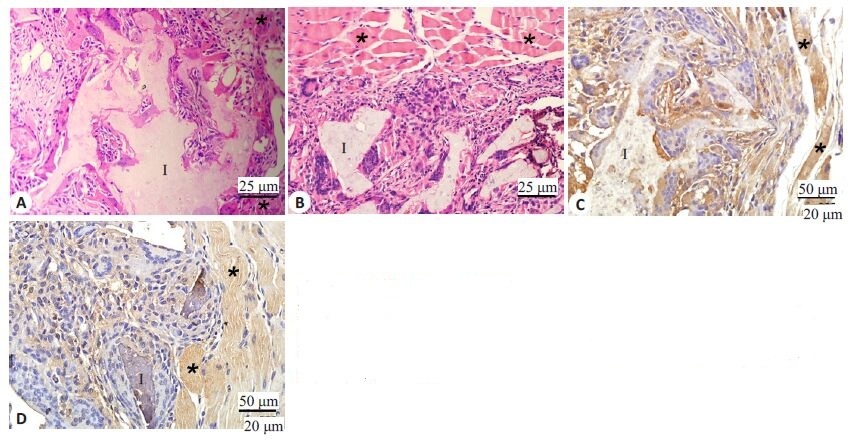
|
图 2 新型柠檬酸材料肌肉移植 Figure 2 Muscular implantation of graft HE staining (A, B: originalmagnification: ×100) and VEGF IHC staining (C, D: original magnification:× 100) of CUPE-HA and POC-HA implant in rat muscle at two weekspost-implantation. I: Implant; *: Muscle. |
颅骨缺损造模3个月后,micro-CT三维重建显示,四组的颅骨缺损均未完全愈合。其中,与其他3 组相比,自体骨移植组呈现了最优的愈合效果(图 3B)。而与两种材料组相比,对照组的缺损处周边虽有一定的骨性再生,然而,在缺损中心部,基本无骨再生(图 3A)。三维重建结果显示两种新型聚柠檬酸生物材料不仅可以诱导缺损周边的骨再生,还能同时诱导缺损中心的骨性再生,说明了此材料具有良好的骨诱导性(图 3C,D)。
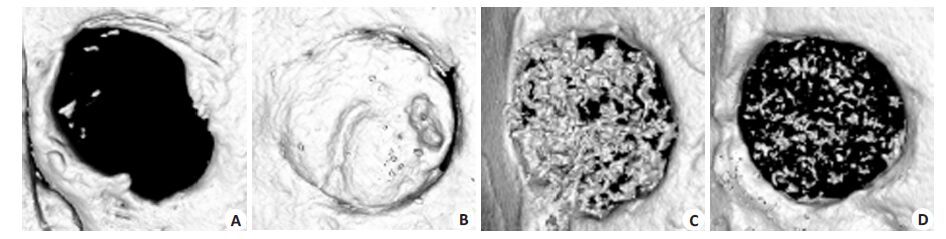
|
图 3 nfykdxxb-35-8-1184 Figure 3 Micro-CT scan of cranioaural regeneration A: None regeneration was observed in the control group; B: Auto-graft group; C:CUPE-HA group; D: POC-HA group. |
造模3个月后HE染色镜下观察发现:相比于对照组,自体骨移植组以及两种材料移植组有明显的骨性再生;两种材料移植组的缺损处周围与材料中间出现大量成纤维细胞聚集,并伴有大量血管的再生;而对照组的缺损处中几乎没有纤维聚集,仅有骨膜的少量再生(图 4)。经组织学血管计数后统计发现,材料组中新生血管数量分别为22.40±2.49与21.60±3.62,明显高于对照组的15.40±3.68(P<0.01)与自体骨移植组的12.20±4.68(P<0.001)。说明新型聚柠檬酸生物材料在诱导颅骨缺损再生的同时可以有效的刺激软组织再生。
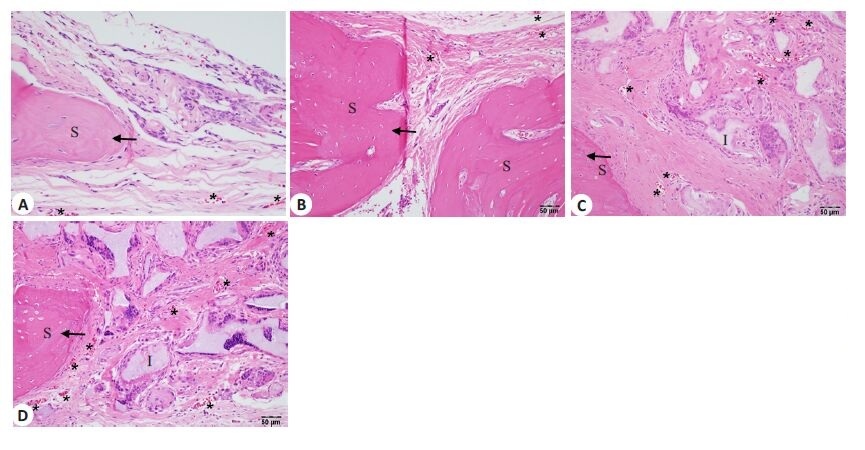
|
图 4 材料移植后软组织再生情况 Figure 4 Soft tissue regeneration after graft implantation (HE staining) At 3months, no regeneration was found in control group (A) and obviousregenerations of the bone and blood vessels occurred in auto-graft group (B)and in CUPE-HA (C) and POC-HA group (D). Arrows indicate new bones;stars indicate blood vessels; I: Implant; S: Skull. |
颅骨缺损造模后3个月HE染色镜下观察发现,自体骨材料组以及两种材料移植组中颅骨缺损边缘区即颅骨再生区域出现明显的纤维骨痂(膜内成骨标志物),而对照组中几乎观察不到纤维骨痂的形成,提示两种材料的移植可以缠身与自体骨移植接近的膜内成骨诱导(图 5)。这些结果说明新型聚柠檬酸生物材料在诱导骨与软组织再生的同时,其本身也具有良好的骨传导性[10]。
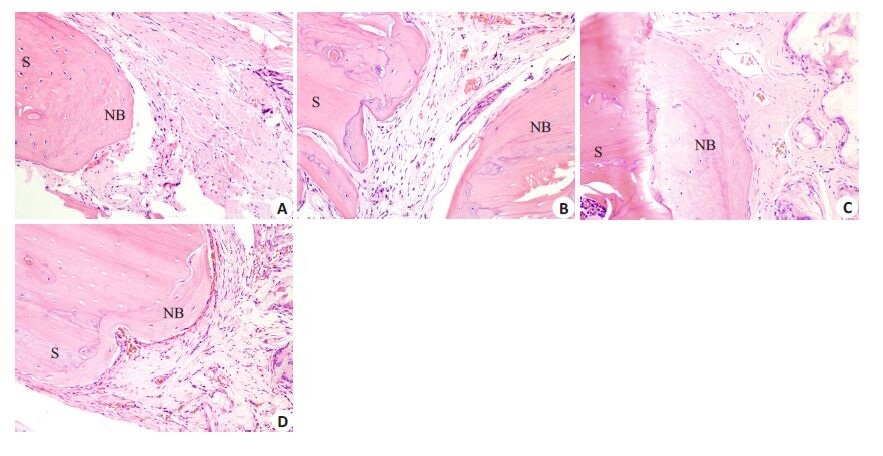
|
图 5 材料移植后膜性成骨的评估 Figure 5 Intramembranous ossification after graft implantation Three monthsafter operation, HE staining revealed intramembranous ossification. Noremarkable intramembranous ossification was found in control group (A);Obvious intramembranous ossifications occurred in auto-graft group (B),CUPE-HA group (C) and POC-HA group (D). I: Implant; S: Skull; NB: Newbone. |
颅骨缺损后的骨再生方式以膜性成骨为主,软组织再生是膜内成骨的重要生理基础[11-12]。本研究选用两种新型聚柠檬酸生物材料作为移植物,并未加入任何种子细胞与生物因子,目的在于探讨聚柠檬酸生物材料自身的骨再生与软组织再生诱导性。我们的结果显示两种生物材料在完全没有种子细胞与生物因子附着的情况下,已经具有良好的骨再生和软组织再生诱导性。目前,现行的生物材料尚无被报道在没有种子细胞与生物因子的条件下具备骨再生和软组织再生诱导性。
聚柠檬酸生物材料自2004年问世以来,于今年已开发至第3代,本研究中的两种生物材料均为第3代聚柠檬酸生物材料。在体外,两种生物材料的生物相容性已被报道[6, 14]。混合羟基磷灰石后的两种新型材料,具有与自体骨接近的生物学特征。然而,由于聚柠檬酸的理化性质特殊,因此即便在混合羟基磷灰石后,依然无法获得较好的力学强度。因而出于颅骨在解剖学上不承力的特点,在本研究中,我们选择了颅骨缺损模型作为评估模型。而我们的结果显示聚柠檬酸材料可以有效的保护颅骨缺损并诱导组织再生,因此,聚柠檬酸填充材料表现出了良好的应用前景。
同时鉴于颅骨再生以膜性成骨的特点[15]。因此,我们猜想材料的骨生物学特点应以软组织再生为基础,故而在讨论材料的骨再生诱导能力的同时,我们针对此类材料对软组织再生的诱导性,做出重点的评估。在软组织再生中,血管再生与重建一直被认为是重中之重,两种生物材料不论在肌肉中填充还是在颅骨缺损部位填充,都出现了大量的新生血管。血管内皮生长因子(VEGF)是生物体内诱导血管发生的重要生物因子[16]。本研究中,VEGF免疫组织化学染色结果发现,比较于对照组,VEGF表达水平在两种材料填充肌肉填充区域有明显的提高。说明聚柠檬酸生物材料具有良好的血管再生诱导性。同时,在颅骨缺损的周边部位,纤维骨痂的形成说明了聚柠檬酸生物材料在诱导软组织再生的同时,本身具备了良好的骨传导性。这些提示了聚柠檬酸生物材料在未来的应用潜能。
我们将在下一步研究中在材料中附着种子细胞与生物因子,以评估聚柠檬酸生物材料作为骨移植物的骨学诱导性,为聚柠檬酸新型生物材料的临床应用打下基础。另一方面,聚柠檬酸生物材料促进骨组织再生与软组织再生的原因也是我们未来的重点研究方向。从材料本身的特点出发,我们猜想材料对组织再生的诱导可能源自于其降解产物(柠檬酸)在缺损处的聚集,然而,柠檬酸对骨组织及软组织再生的诱导作用尚未被阐述。因此,阐明外源性柠檬酸对骨与软组织再生的诱导作用也将对组织工程学研究带来新的方向。
两种聚柠檬酸生物材料具有良好的软组织再生诱导能力。在修复颅骨缺损时,可以有效的促进血管和纤维组织再生。同时,这种诱导软组织再生的能力有效的提高颅骨缺损后膜内成骨的发生最终促进颅骨缺损的愈合。
致谢: 本研究中两种可降解聚柠檬酸生物材料由美国宾夕法尼亚州立大学生物材料系杨健教授提供。| [1] | Giannoudis PV, Dinopoulos H, Tsiridis E. Bone substitutes: an update[J]. Injury,2005, 36 (Suppl 3) : S20-7. |
| [2] | You ZW, Cao HP, Gao J, et al. A functionalizable polyester with free hydroxyl groups and tunable physiochemical and biological properties[J]. Biomaterials,2010, 31 (12) : 3129-38. DOI: 10.1016/j.biomaterials.2010.01.023. |
| [3] | Callaghan JJ, Liu SS, Phruetthiphat OA. The revision acetabulum - allograft and bone substitutes vestigial organs for bone deficiency[J]. Bone Joint J,2014, 96B (A) : 70-2. |
| [4] | Tevlin R, Mcardle A, Atashroo D, et al. Biomaterials for craniofacial bone engineering[J]. J Dent Res,2014, 93 (12) : 1187-95. DOI: 10.1177/0022034514547271. |
| [5] | 谢志伟, 杨健. 基于柠檬酸的生物可降解高分子材料的设计、开发及 应用[J]. 中国医疗设备,2013, 28 (3) : 1-6. |
| [6] | Yang J, Webb AR, Ga A. Novel citric acid-based biodegradable elastomers for tissue engineering[J]. Adv Mater,2004, 16 (8) : 511-6. |
| [7] | Dey J, Xu H, Shen JH, et al. Development of biodegradable crosslinked urethane-doped polyester elastomers[J]. Biomaterials,2008, 29 (35) : 4637-49. DOI: 10.1016/j.biomaterials.2008.08.020. |
| [8] | Guo J, Xie Z, Tran RT, et al. Click chemistry plays a dual role in biodegradable polymer design[J]. Adv Mater,2014, 26 (12) : 1906-11. DOI: 10.1002/adma.v26.12. |
| [9] | Sicchieri LG, Crippa GE, de Oliveira PT, et al. Pore size regulates cell and tissue interactions with PLGA-CaP scaffolds used for bone engineering[J]. J Tissue Eng Regen Med,2012, 6 (2) : 155-62. DOI: 10.1002/term.v6.2. |
| [10] | Lokkevold PR, Jovanovic SA. Advanced implant surgery and bone grafting techniques. Advanced implant surgery and bone grafting techniques[M]. Philadelphia: W.B.Saunders, . |
| [11] | Mikael PE, Xin X, Urso M, et al. A potential translational approach for bone tissue engineering through endochondral ossification[J]. Conf Proc IEEE Eng Med Biol Soc,2014 (6) : 3925-8. |
| [12] | Shakir S, Macisaac ZM, Naran S, et al. Transforming growth factor beta 1 augments calvarial defect healing and promotes suture regeneration[J]. Tissue Eng Part A,2015, 21 (5/6) : 939-47. |
| [13] | Jing J, Hinton RJ, Jing Y, et al. Osterix couples chondrogenesis and osteogenesis in post-natal condylar growth[J]. J Dent Res,2014, 93 (10) : 1014-21. DOI: 10.1177/0022034514549379. |
| [14] | Qiu H, Yang J, Kodali P, et al. A citric acid-based hydroxyapatite composite for orthopedic implants[J]. Biomaterials,2006, 27 (34) : 5845-54. DOI: 10.1016/j.biomaterials.2006.07.042. |
| [15] | Chen Q, Sinha K, Deng JM, et al. Mesenchymal deletion of histone demethylase NO66 in mice promotes bone formation[J]. J Bone Miner Res,2015, 12 (6) : 2494. |
| [16] | Kim KI, Park S, Im GI. Osteogenic differentiation and angiogenesis with cocultured adipose-derived stromal cells and bone marrow stromal cells[J]. Biomaterials,2014, 35 (17) : 4792-804. DOI: 10.1016/j.biomaterials.2014.02.048. |
 2015, Vol. 35
2015, Vol. 35
