肿瘤的发生、发展依赖于肿瘤细胞与肿瘤微环境间的相互作用,肿瘤相关成纤维细胞(CAFs)是肿瘤微环境中的主要成分。随着研究的深入,CAFs已被证实在肿瘤进展过程中扮演了关键性的角色,参与了肿瘤生长、血管生成、免疫抑制等多个方面[1-2]。胆道恶性肿瘤具有间质纤维化的特征[3],在包括胆管癌在内的多种肿瘤中已证实CAFs与患者预后直接相关[4-7]。在胆囊癌中CAFs细胞是否同样存在,并在胆囊肿瘤发生发展中起相应作用尚无相关报道。本实验通过酶消化法及组织块法探索人胆囊癌相关成纤维细胞的原代培养方法,进一步研究CAFs对胆囊癌细胞生物学行为的影响,探讨其在胆囊癌发生、发展中的作用。
1 材料与方法 1.1 材料与试剂F12 培养基、1640 培养基、新生胎牛血清购自Gibco,Ⅱ型胶原酶、四甲基偶氮唑盐(MTT)试剂、DMSO 购自Sigma,DNase Ⅰ、青链霉素溶液购自Thermo,胰酶购自Invitrogen;抗α-SMA鼠抗人抗体、抗Vimentin兔抗人、抗VEGFA兔抗人、HRP标记羊抗兔第二抗体、HRP标记羊抗鼠第二抗体购自Abcam;FITC标记羊抗鼠第二抗体、TRIFC标记羊抗兔第二抗体购自EarthOx。Transwell小室购自LabServe;基质胶购自BD。
1.2 细胞系胆囊癌GBC-SD、SGC-996细胞由西安交通大学第一附属医院肝胆外科实验室提供。
1.3 组织标本于术中收取新鲜的胆囊癌癌组织标本,多点取材,每块组织1.0 cm3左右,取材后立即置于100 U/mL的PBS溶液中,密封离心管后带回实验室。
1.4 免疫组织化学组织块与原代培养为同一来源,标本以4%多聚甲醛固定后经脱水-透明-浸蜡后制成蜡块标本,5 μm连续切片,经脱蜡-脱水后加经3% H2O2、封闭血清孵育,加入相应一抗(稀释比例均为1∶100)、二抗,DAB显色并苏木素复染色,封片后正置显微镜下拍照。
1.5 原代培养方法 1.5.1 组织块处理将组织块置于含100 U/mL的PBS中浸泡、冲洗4次,剔除血块、脂肪组织及坏死组织备用。
1.5.2 组织块培养法将处理后的组织块置于F12培养基中,剪碎至2~3 mm3大小,接种于预铺血清的28 cm2培养皿中,组织块间距0.5 cm,置于37 ℃、5% CO2的培养箱内2 h,使组织块贴壁牢固后加入含20%胎牛血清的培养基培养,每3 d换液,待细胞自组织块爬出后去除组织块。
1.5.3 酶消化培养法将处理后的组织块置于含20 μL/mL DNase I的Ⅱ型胶原酶(1 mg/mL)中,剪碎组织至1 mm3大小,置于37 ℃温箱孵育4 h,终止消化后以70 μm一次性筛网过滤,所获溶液以800 r/min离心5 min ,弃去上清液,加入培养基重悬,再次离心,所得细胞接种于培养瓶中,置于37 ℃、5% CO2的培养箱内,6~8 h后观察到细胞贴壁后即首次换液,之后每3 d换液1次。
1.5.4 细胞分离与纯化待细胞铺满培养瓶后,进行传代,应用胰酶消化法及差速贴壁法对细胞进行纯化,传代后5~6 h观察到细胞贴壁即进行换液,洗去未贴壁细胞,7~9 d可传代、纯化1次,至纯化3次后进行免疫细胞化学、免疫荧光鉴定。
1.6 细胞免疫化学及免疫荧光接种适量CAFs,培养至细胞形态完全形成时以4%多聚甲醛室温固定,清洗后依次加入3‰ Triton X-100、3% H2O2、封闭血清孵育,弃去封闭血清后加入相应一抗(稀释比例均为1∶100)、二抗,DAB显色后以苏木素复染色、封片。免疫荧光实验步骤至加入一抗与细胞免疫化学一致,后依次加荧光二抗、DAPI避光孵育,荧光显微镜下拍照。
1.7 MTT检测细胞增殖当CAFs密度达到80%~90%时,弃去培养基,PBS洗3遍,加入无血清无抗生素的F12培养基,连续培养48 h 后收集培养基,3000 r/min 离心10 min,收集上清液并制成含5%胎牛血清的细胞条件培养基(CM)。收集对数期生长的GBC-SD及SGC-996 细胞,分别设立实验组(EG)及对照组(CG),每组6 个复孔,实验组以CM重悬癌细胞,对照组以含5%胎牛血清的1640重悬癌细胞,按5×103/孔接种至96孔板内,常规培养24、48、72 h后在每孔内加入5 mg/mL MTT 50 μL,37°C继续培养4 h,弃去孔内上清液,每孔加入375 μLDMSO,震荡10min后于490 nm波长测各自的吸光度值(A490)。
1.8 Transwell小室侵袭实验设立实验组(EG)及对照组(CG),取对数生长期的CAFs细胞,将CAFs稀释为2×104/mL的细胞悬液,按500 μL/孔接种于24孔板,24 h后将细胞培养上清换为600 μL无血清无抗生素的F12,常规培养24 h后加入终浓度为5%的胎牛血清作为EG组下室培养基,对照组下室单纯加入600 μL含5%胎牛血清的F12培养基的孔作为阴性对照;预先于Transwell内置入60 μL基质胶,并于上室内加入对数生长期的SGC-996、GBC-SD细胞各5×104/孔,分别将小室置入已加入相应培养基之下室中。SGC-996细胞常规培养48 h,GBC-SD细胞常规培养72 h 后取出小室,擦去小室内基质胶及细胞,置入0.1%结晶紫中染色30 min,显微镜下观察穿过膜的细胞,按上、下、左、右、中的顺序拍摄5个视野,对穿过膜的细胞计数后进行统计分析,每个样本设3个复孔。
1.9 统计学处理方法所有数据统计均采用SPSS 13.0统计软件进行分析处理,统计学处理方法均为方差分析,以P<0.05表示存在统计学差异。
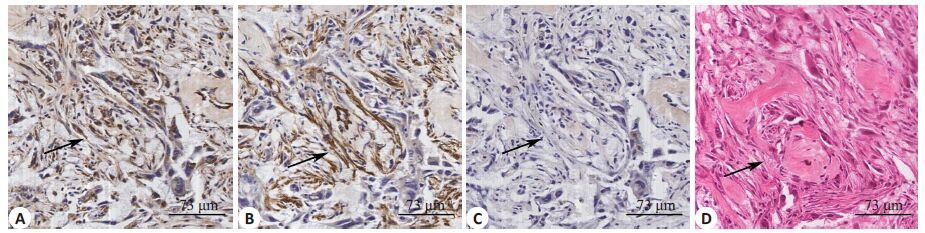
2 结果 2.1 免疫组化胆囊癌组织标本中Vimentin、α-SMA强阳性表达,VEGFA弱阳性表达,证实胆囊癌组织中存在大量CAFs(图 1)。
|
图 1 胆囊癌CAFs的表达情况 Figure 1 Expression of CAFs in gallbladder carcinoma tissues (Original magnification: × 200). A, B, C: Immunocytochemistry for vimentin, α-SMA, and VEGFA, respectively; D: HE staining. |
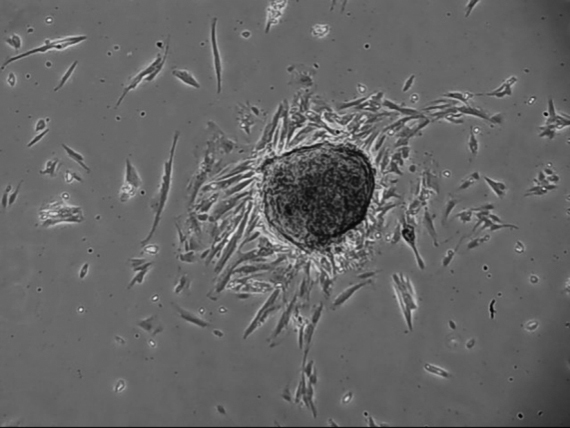
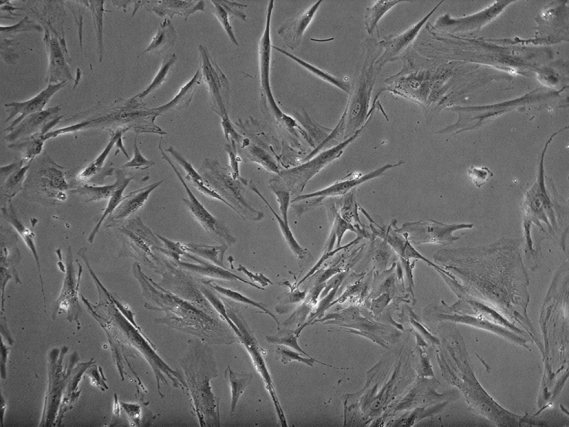
组织块法与酶消化法均可获得细胞,组织块法6~7 d可见细胞从组织块周围游出(图 2),后向四周呈扩散式生长,至25 d 左右可长满培养皿。酶消化法6~8 h即可观察到细胞贴壁,36 h后可观察到细胞分裂、生长(图 3),7~9 d后即可长满瓶底。初代细胞中以成纤维细胞为主,呈放射或漩涡状,同时掺杂少量肿瘤细胞。
|
图 2 组织块法培养CAFs接种6-7d可见细胞自组织块游出 Figure 2 Tissue culture showing outgrowth of CAFs from the tissue block after 6-7 days (Original magnification: ×40). |
|
图 3 酶消化法培养CAFs消化接种36 h后可见细胞完整形态形成,多数呈长梭形 Figure 3 Enzyme digestion method for CAF isolation at 36 h (Original magnification: ×100). |
首次传代后7~9 d即可观察到细胞再次长满瓶底,80%~90%为漩涡状、条索状生长的成纤维细胞,掺杂少量成团状生长的的肿瘤细胞,传代至第3代时成纤维细胞已达近100%,在形态上表现呈具有多量胞突的梭形或星状细胞。
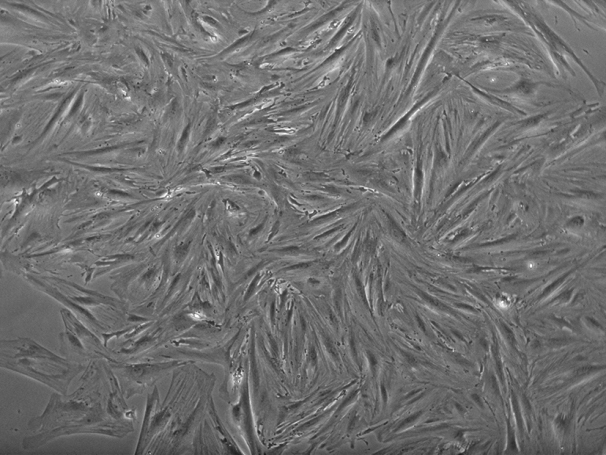
2.3 CAFs的鉴定 2.3.1 活细胞观察最终所得CAFs细胞来源于1例胆囊腺癌Ⅱ级患者,以酶消化法提取,传代至第3代时,细胞纯度较为满意。从形态学而言CAFs呈长梭形或星形,具有较多胞突,生长密集,呈条束状、漩涡状或放射状,接触抑制及密度抑制消失(图 4)。
|
图 4 纯化所得CAFs细胞呈长梭形或星形,生长密集 Figure 4 Purification of the CAFs (Original magnification: ×100). |
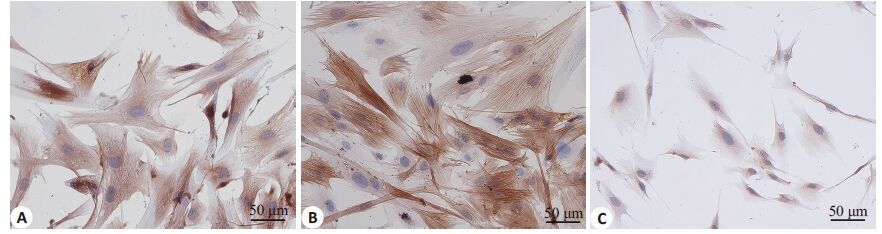
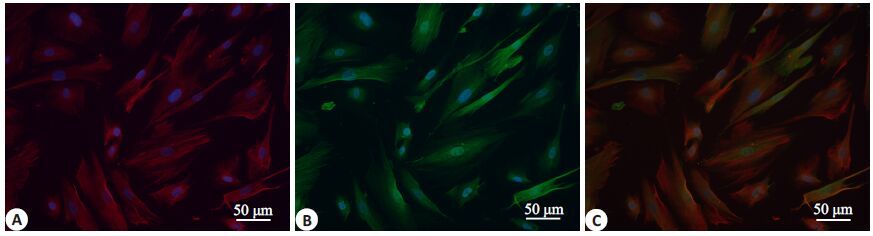
培养所得CAFs 中Vimentin、α-SMA强阳性表达,VEGFA弱阳性表达(图 5),与组织标本染色一致。免疫荧光示原代培养所得细胞中成纤维细胞标志Vimentin与活化标志α-SMA共表达(图 6),证实所得细胞即为胆囊癌CAFs。
|
图 5 CAFs的免疫细胞化学结果 Figure 5 Immunocytochemistry of the CAFs for vimentin (A) α-SMAstain (B), and VEGFA(C) (Original magnification: ×200). |
|
图 6 CAFs的免疫荧光结果 Figure 6 Immunofluorescence of the CAFs (Original magnification: ×200). A: Vimentin staining; B: α-SMA staining; C: Merged image. |
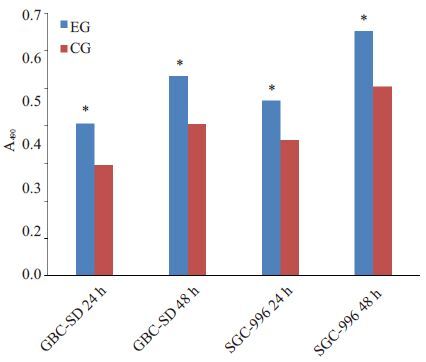
培养24、48 h后检测光度值并进行比较。数据经方差分析显示两组细胞培养24、48 h后EG组吸光度值均高于CG组,差异具有统计学意义(P<0.05,图 7)
|
图 7 MTT实验结果 Figure 7 Results of MTT assay. *P<0.05 vs control group. |
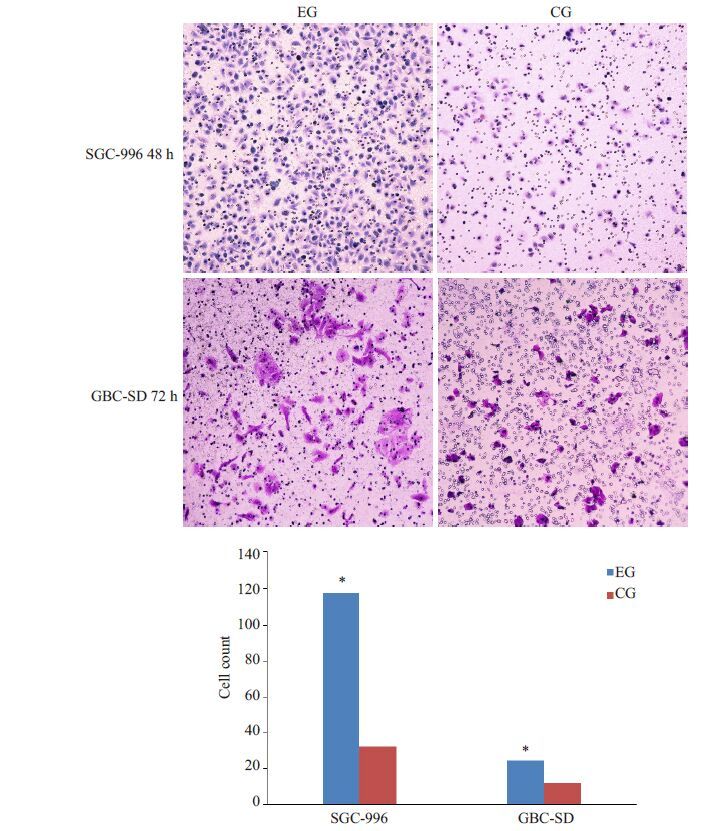
SGC-996 细胞培养48 h、GBC-SD 细胞培养72 h后,400×视野下抽取5个视野细胞计数。数据经方差分析显示两种细胞EG组侵袭细胞数均高于CG组,差异存在统计学意义(P<0.05,图 8)。
|
图 8 Transwell侵袭实验结果 Figure 8 Results of Transwell chamber assay (Original magnification: × 100). *P<0.05 vs control group. |
与正常组织或良性肿瘤中的成纤维细胞相比,CAFs具有不同的表型与功能,与肿瘤的增殖、浸润、转移密切相关,直接影响患者的预后。CAFs作为肿瘤间质中表现为持续性活化的成纤维细胞,与正常组织或良性组织中的成纤维细胞不同,这类细胞不能回复成为普通表型的成纤维细胞且难以凋亡[8]。尽管随着报道的增多,越来越多CAFs的标记蛋白被发现,但迄今尚未发现1个特异性的标记蛋白,其诊断基于以下3个特征:(1)表达成纤维细胞的标记蛋白如Vimentin、FSP1 及FAP;(2)表达活化标记蛋白α-SMA、PDGFR-α/β、MMP3 等;(3)细胞因子、生长因子如VEGF、TGF-β、HGF等表达增多[9]。在胆管癌[4]、乳腺癌[10]、胃癌[11]等肿瘤中已在体外成功分离CAFs,但目前国内外均未有胆囊癌CAFs的相关报道。本实验选取Vimentin、α-SMA、VEGFA对胆囊癌组织进行标记染色,证实了胆囊癌中CAFs的存在,并参照国内外各类肿瘤CAFs及皮肤成纤维细胞、星状细胞等的原代培养方法[10, 11],成功地在体外分离培养了胆囊癌CAFs。
对于两种原代培养的方法,我们认为酶消化法更为高效、利于反复重复试验。随后对所获原代细胞进行Vimentin、α-SMA、VEGFA染色鉴定,免疫细胞化学显示Vimentin、α-SMA、VEGFA均阳性表达,免疫荧光显示成纤维细胞标志Vimentin与活化标志蛋白α-SMA共表达于原代细胞中,结合组织切片免疫组化结果证实原代培养所得细胞即为胆囊癌CAFs。
作为肿瘤间质的主要成分,CAFs不仅参与了细胞外基质的合成和重建,同时通过多种途径参与肿瘤发生与进展。旁分泌为CAFs作用于肿瘤细胞的主要方式之一,CAFs可分泌多种细胞如HGF、PDGF、TGF、EGF等促进肿瘤细胞生长及促进肿瘤血管生成,除此之外最新的研究展示了CAFs在肿瘤的新陈代谢、肿瘤引起的炎症、肿瘤转移、免疫耐受及耐药性等多个方面扮演了重要的角色,CAFs可促进肿瘤细胞发生上皮间质转化[12-13],并参与了肿瘤微环境中低氧环境的构建与调节[14],通过以上多方面的作用,CAFs 与肿瘤的不良预后相关。在进一步的实验中,我们选取了SGC-996 及GBC-SD两株细胞系研究CAFs对胆囊癌细胞的作用,MTT实验显示EG组胆囊癌细胞在24、48 h两个时间点其吸光度值均明显高于CG组癌细胞,提示CAFs条件培养基增强了胆囊癌细胞的增殖能力;侵袭实验中EG组穿膜癌细胞数量明显高于CG组,证实CAFs条件培养基同样可增强胆囊癌细胞的侵袭能力。
在乳腺癌、胰腺癌、胆管癌等的研究中已发现CAFs 能促进肿瘤细胞的增殖、侵袭与转移[15-18]。CAFs对肿瘤细胞的作用主要通过细胞因子来实现,包括TGF-β、肝细胞生长因子、胰岛素样生长因子、基质金属蛋白酶以及表皮生长因子,在促进肿瘤生长、迁移和侵袭的恶性转化过程中发挥着重要作用,Yu 等[19]证实CAFs 可通过分泌TGF-β促进乳腺癌细胞发生EMT,Claperon等[18]的研究表明CAFs通过分泌HB-EGF促进胆管癌细胞增殖能力及血管生成,Song 等人的研究表明在肝癌微环境中CAFs可通过SDF-1 阻止癌细胞凋亡,CAFs对癌细胞的作用可能涉及Akt[20]、hedgehog[21]、PKC[22]等信号通路,然而由于各通路间复杂的Crosstalk,更深入的作用机制仍需要进一步研究。
| [1] | Oestman A, Augsten M. Cancer-associated fibroblasts and tumor growth-bystanders turning into key players[J]. Curr Opin Genet Dev,2009, 19 (1) : 67-73. DOI: 10.1016/j.gde.2009.01.003. |
| [2] | Castells M, Thibault B, Delord J. Implication of tumor microenvironment in chemoresistance: Tumor-Associated stromal cells protect tumor cells from cell death[J]. Int J Mol Sci,2012, 13 (8) : 9545-71. |
| [3] | Sirica AE, Dumur CI, Campbell DJ, et al. Intrahepatic cholangiocarcinoma progression: prognostic factors and basic mechanisms[J]. Clinical Gastroenterology and Hepatology,2009, 7 (11) : 68-78. |
| [4] | Chuaysri C, Thuwajit P, Paupairoj A, et al. Alpha-smooth muscle actin-positive fibroblasts promote biliary cell proliferation and correlate with poor survival in cholangiocarcinoma[J]. Oncol Rep,2009, 21 (4) : 957-69. |
| [5] | Sirica AE, Campbell DJ, Dumur C. Cancer-associated fibroblasts in intrahepatic cholangiocarcinoma[J]. Curr Opin Gastroenterol,2011, 27 (3) : 276-84. DOI: 10.1097/MOG.0b013e32834405c3. |
| [6] | Paulsson J, Micke P. Prognostic relevance of cancer-associated fibroblasts in human cancer[J]. Semin Cancer Biol,2014, 25 (2) : 61-8. |
| [7] | Cirri P, Chiarugi P. Cancer-associated-fibroblasts and tumour cells: a diabolic liaison driving cancer progression[J]. Cancer and Metastasis Reviews,2012, 31 (1/2) : 195-208. |
| [8] | Franco OE, Shaw AK, Strand DW, et al. Cancer associated fibroblasts in cancer pathogenesis[J]. Semin Cell Dev Biol,2010, 21 (1) : 33-9. DOI: 10.1016/j.semcdb.2009.10.010. |
| [9] | De VK, Rao L, De Bruyne E, et al. Cancer associated fibroblasts and tumor growth: focus on multiple myeloma[J]. Cancers (Basel),2014, 6 (3) : 1363-81. DOI: 10.3390/cancers6031363. |
| [10] | De Francesco EM, Lappano R, Santolla MF, et al. HIF-1alpha/ GPER signaling mediates the expression of VEGF induced by hypoxia in breast cancer associated fibroblasts (CAFs). Breast Cancer Res, 2013, 15(4): R64. http://cn.bing.com/academic/profile?id=2153895029&encoded=0&v=paper_preview&mkt=zh-cn |
| [11] | Hu CY, Wang ZC, Zhai LL, et al. Effects of cancer-associated fibroblasts on the migration and invasion abilities of SGC-7901 gastric cancer cells[J]. Oncol Lett,2013, 5 (2) : 609-12. |
| [12] | Madar S, Goldstein I, Rotter V. 'Cancer associated fibroblasts'-more than meets the eye. Trends Mol Med, 2013, 19(8): 447-453. http://cn.bing.com/academic/profile?id=2018011096&encoded=0&v=paper_preview&mkt=zh-cn |
| [13] | Kharaishvili G, Simkova D, Bouchalova K, et al. The role of cancer-associated fibroblasts, solid stress and other microenvironmental factors in tumor progression and therapy resistance[J]. Cancer Cell Int,2014, 14 (8) : 41. |
| [14] | Ostman A. Cancer-associated fibroblasts: Recent developments and emerging challenges[J]. Semin Cancer Biol,2014, 25 : 1-2. DOI: 10.1016/j.semcancer.2014.02.004. |
| [15] | Goicoechea SM, Garcia-Mata R, Staub J, et al. Palladin promotes invasion of pancreatic cancer cells by enhancing invadopodia formation in cancer-associated fibroblasts[J]. Oncogene,2014, 33 (10) : 1265-73. DOI: 10.1038/onc.2013.68. |
| [16] | Amornsupak K, Insawang T, Thuwajit P, et al. Cancer-associated fibroblasts induce high mobility group box 1 and contribute to resistance to doxorubicin in breast cancer cells[J]. BMC Cancer,2014, 14 (9) : 955. |
| [17] | Luo HJ, Tu G, Liu ZM, et al. Cancer-associated fibroblasts: A multifaceted driver of breast cancer progression[J]. Cancer Lett,2015, 361 (1) : 155-63. |
| [18] | Claperon A, Mergey M, Aoudjehane LA, et al. Hepatic myofibroblasts promote the progression of human cholangiocarcinoma through activation of epidermal growth factor receptor[J]. Hepatology,2013, 58 . |
| [19] | Yu Y, Xiao CH, Tan LD, et al. Cancer-associated fibroblasts induce epithelial-mesenchymal transition of breast cancer cells through paracrine TGF-beta signalling[J]. Br J Cancer,2014, 110 (3) : 724-32. DOI: 10.1038/bjc.2013.768. |
| [20] | Yamamura Y, Asai N, Enomoto A, et al. Akt-Girdin signaling in Cancer-Associated fibroblasts contributes to tumor progression[J]. Cancer Res,2015, 75 (5) : 813-23. DOI: 10.1158/0008-5472.CAN-14-1317. |
| [21] | Peiris-Pages M, Sotgia F, Lisanti MP. Chemotherapy induces the cancer-associated fibroblast phenotype, activating paracrine hedgehog-GLI signaling in breast cancer cells[J]. Cancer Res,2015, 75 (5) : 813-23. DOI: 10.1158/0008-5472.CAN-14-1317. |
| [22] | Li F, Zhu YT. HGF-activated colonic fibroblasts mediates carcinogenesis of colonic epithelial cancer cells via PKC-cMETERK1/ 2-COX-2 signaling[J]. Cell Signal,2015, 27 (4) : 860-6. DOI: 10.1016/j.cellsig.2015.01.014. |
 2015, Vol. 35
2015, Vol. 35
