弓形虫是一种危害性巨大的机会致病微生物,属于顶复门寄生虫,虽然猫科动物为其目前确认的唯一终宿主[1],但其可侵犯所有温血动物,尤其对免疫缺陷人群有极大威胁[2]。弓形虫感染后可致弓形虫病[3],危害严重却无特征性临床症状,并可通过多种途径传播[4-5]。其中,弓形虫病的母婴垂直传播是孕期宫内感染致畸的重要原因之一。据世界卫生组织统计,目前为止,全球已有超过三分之一的人群感染或携带弓形虫[6],而原本的预防治疗药物相对局限,新的有效抗虫药物亟待开发。
本研究尝试在酸性钙体上寻找新的药物作用靶点。酸性钙体是一种新近发现的细胞器,扫描电镜下形态为圆形电子致密颗粒[7],目前已被证实在弓形虫[8-11]和疟原虫[12-13]中均有存在。其膜上存在着大量泵及转运体,在调节细胞渗透压、PH值、无机阳离子储存及焦磷酸的储存方面发挥着重要作用[7, 14]。液泡型质子焦磷酸酶就是其中之一。液泡型质子焦磷酸酶(V-PPase)是一种特殊的生电质子泵,分为K+依赖型(Ⅰ型)和非K+依赖型(Ⅱ型)[15],其功能是利用水解无机焦磷酸(PPi)产生的能量,建立质膜内外氢离子梯度,维持膜内正常pH值,从而保证细胞形态稳定和功能正常[16-19]。已有文献报道弓形虫和布氏锥虫的Ⅰ型液泡型质子焦磷酸酶(TgVP1)与其代谢、侵袭力、胞外生存能力有密切联系[17, 19]。研究人员认为Ⅰ型液泡型质子焦磷酸酶为酸性钙体的标志性蛋白,并以其为参照研究其他酸性钙体蛋白的定位[7]。但是目前仍没有针对弓形虫TgVP1的高特异性抗体研制出来。本研究通过人工合成多肽制备抗体的方法获得了针对两条不同肽段的兔抗TgVP1多克隆抗体,为更深入地研究TgVP1、寻找新的抗弓形虫药物作用靶点和开发抗虫新药奠定了更为坚实的基础。
1 材料与方法 1.1 材料 1.1.1 虫株及细胞弓形虫ME49株和OFTU细胞为南方医科大学抗体工程研究所保存。
1.1.2 主要试剂马来酰亚胺活化的BSA、KLH偶联试剂盒(MBK1)购自Sigma,无蛋白封闭液购自上海生工,RIPA(中)购自康为世纪,PVDF膜购自Bio-Rad公司,MEM培养基和胎牛血清均购自Hyclone公司,辣根过氧化物酶(HRP)标记的羊抗兔IgG和兔源His标签抗体均购自Bioworld公司,Alexa Fluor 546羊抗兔IgG购自Invitrogen,DAPI购自碧云天,其他试剂均为国产或进口分析纯。
1.1.3 实验动物健康8周龄雄性新西兰大耳白兔(SPF级)购自南方医科大学实验动物中心。实验前常规喂养适应1周。
1.2 方法 1.2.1 多肽片段的选择及合成在NCBI Genebank中检索得到刚地弓形虫、恶性疟原虫和伯氏疟原虫的氨基酸序列,利用Immune Epitope Database(IEDB)对其分别进行B 细胞线性抗原表位预测(Bepipred Linear Epitope Prediction),选择界值为0.350。利用TMHMM Server v 2.0 对这三个氨基酸序列分别进行跨膜区分析,综合用SDSC Biology Workbench BOXSHADE方法得到的同源性比对结果,我们最终选择了两段具有高度抗原性和保守性的非跨膜区多肽片段TgVP1-1和TgVP1-2,长度分别为29个氨基酸和17 个氨基酸,交由广州瑞博奥生物科技有限公司合成。
1.2.2 免疫抗原肽的制备用马来酰亚胺活化的BSA,KLH偶联试剂盒(MBK1)将合成的多肽片段与牛血清白蛋白(BSA)与匙孔血蓝蛋白(KLH)偶联,按照说明书操作。将偶联好的KLH 多肽分别与弗氏完全佐剂(CFA)和弗氏不完全佐剂(IFA)以1∶1(v/v)比例混合乳化作为免疫原,4 ℃保存。
1.2.3 多克隆抗体的制备于2只雄性新西兰大耳白兔背部脊柱旁各选取8个点,备皮消毒后小剂量多点皮内注射免疫。初次免疫时共注射500 μg合成肽-KLH与CFA乳化物作为基础免疫;其后第3、5、6周,选取不同于初免的点皮内注射250 μg合成肽-KLH与IFA乳化物作为加强免疫。第2 次加强免疫后7 d 耳静脉采少量血,分离血清,测定效价,大于1∶105为达标。最后1次加强免疫结束10 d后收获抗血清,-20 ℃保存。2只白兔均于免疫前以常规方法各收集血清3 mL。
1.2.4 多克隆抗体的纯化采用Protein-G 免疫亲和层析柱对收集的抗血清进行纯化。将抗血清用结合缓冲液(100 mmol/L Tris-Hcl,pH 7.5,100 mmol/L NaCl)稀释10倍体积,0.45 μm滤膜过滤,加样到IgG亲和层析柱,流速1 mL/min至基线,用洗脱缓冲液(100 mmol/L甘氨酸-HCl,pH2.5)洗脱后,收集洗脱峰,所得即为纯化多克隆抗体,SDS-PAGE分析纯化效果。
1.2.5 多克隆抗体效价检测采用间接ELISA的方法,将合成肽-BSA溶于碳酸盐缓冲液(CBS)至100 μg/L包被检测板,每孔100 μL,4 ℃包被过夜。用无蛋白封闭液37 ℃封闭2 h后,每孔加入100 μL倍比稀释的多克隆抗体,同时以等体积免疫前兔血清和CBS作为阴性对照和空白对照。37 ℃孵育2 h后,用PBST洗涤3次,加入100 μL/孔1∶10 000稀释的HRP标记的羊抗兔IgG,37 ℃孵育0.5 h。洗涤3次后每孔加入TMB显色液100 μL。避光显色10 min后,加入50 μL/孔2 mol/L浓硫酸终止显色[20]。用酶标仪测定各孔在450 nm处吸光度值,取2.1倍阴性对照值为阳性。
1.2.6 刚地弓形虫速殖子的纯化培养液氮罐中取出冻存的刚地弓形虫ME49株,37℃水浴复苏,以3×104/只感染雌性BALB/c小鼠。7~10 d后小鼠发病,每只小鼠腹腔注射5 mL无菌生理盐水并轻揉腹部。抽取腹水,腹水中即有大量刚地弓形虫速殖子。将腹水以800 g/min离心10 min并去上清,用无菌生理盐水洗涤沉淀3次后重悬,所得即为纯化的刚地弓形虫速殖子。用纯化的速殖子按1∶10感染OFTU细胞,培养至50%细胞病变效应(CPE)时收集。
1.2.7 多克隆抗体的鉴定与应用 1.2.7.1 Western blot检测天然弓形虫全蛋白在RIPA(中)裂解液中加入蛋白酶抑制剂,重悬收集的刚地弓形虫,冰上裂解20 min后10 000 g离心10 min收集上清,即为弓形虫全蛋白。OFTU全蛋白提取方法同上,用于阴性对照;恶性疟原虫和伯氏疟原虫全蛋白为本实验室保存。在全蛋白中加入等体积2×Loading Buffer煮沸10 min,离心取上清进行SDS-PAGE电泳,转膜并封闭后,以1∶1000稀释的纯化兔多抗或免疫前兔血清作一抗孵育2 h、1∶10 000稀释的HRP标记的羊抗兔IgG作二抗孵育1 h进行Western blot分析,ECL法显色。
1.2.7.2 间接免疫荧光(IFA)分析TgVP1的亚细胞定位在共聚焦培养皿底孔中加入500 μL含纯化刚地弓形虫速殖子的培养基,37 ℃孵箱中放置2 h使速殖子粘附。加入4%多聚甲醛固定15 min 后加入0.25% Triton X-100 室温透化10 min。PBS 洗涤后,用1% BSA/PBST室温封闭2 h,加入1∶500稀释的纯化兔多抗或未免疫兔血清作一抗室温孵育1.5 h、1∶1000 稀释的Alexa Fluor 546 羊抗兔IgG(红色荧光标记)作二抗室温孵育1 h,最后加入1∶1000稀释的DAPI染色10 min,共聚焦显微镜观察[8]。
2 结果 2.1 多肽片段的选择、合成及免疫抗原制备用IEDB 对检索得到的TgVP1 氨基酸序列(gi|527308392|gb|EPT25031.1)进行B细胞线性抗原表位预测,如图 1A,得到23个表位评分,评分越高代表其抗原性越好。利用TMHMM Server v 2.0对其进行拓扑学分析,得到17个跨膜区,如图 1B,据此可将定位于跨膜区的抗原表位排除。然后对刚地弓形虫、恶性疟原虫和伯氏疟原虫的I型液泡型质子焦磷酸酶氨基酸序列进行同源性比对,最终选择了两段抗原评分较高的非跨膜区保守序列进行人工合成。其中TgVP1-1长度为29个氨基酸(YTKAADVGADLSGKNEYGMSEDDPRNPAC),包含预测的PPi结合位点(DX7KXE模体);TgVP1-2长度为17 个氨基酸(CHKNAVTGDTVGDPLKD),位于肽链全长的C端,如图 1C。合成并偶联制备免疫抗原,用等体积弗氏佐剂乳化,操作完成后取1滴液体滴于冰冷水面上,如能长时间保持圆珠形不散开即表示乳化达到要求。
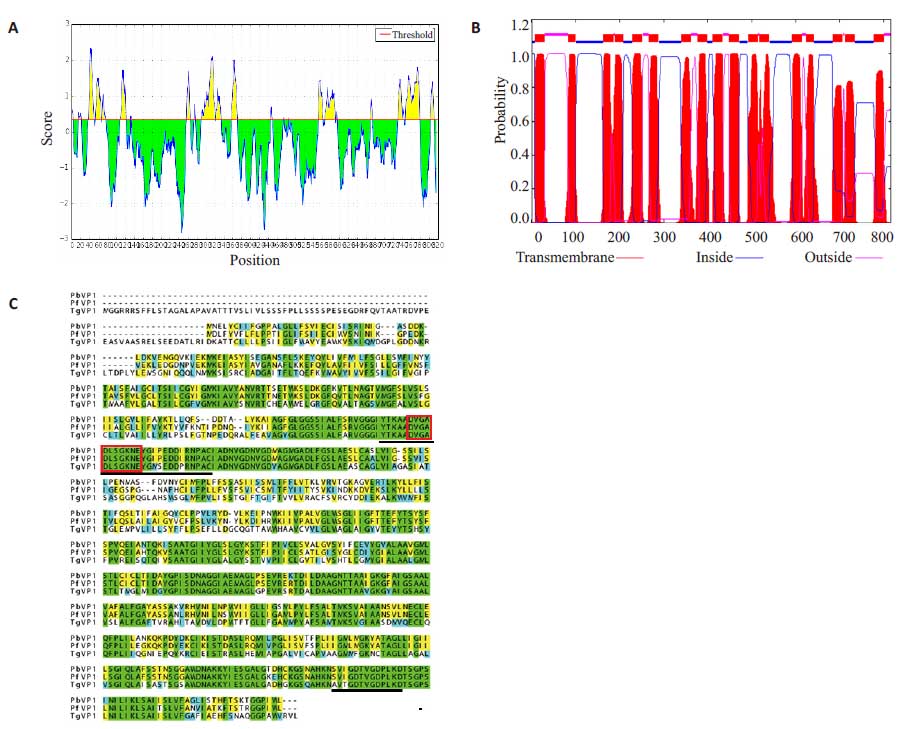
|
图 1 多肽片段的选择 Figure 1 Selection of the synthetic peptides. A: B cell epitopes of TgVP1 predicted by IEDB; B: Tansmembrane domains of TgVP1 predicted by TMHMM; C: Homology comparison result of TgVP1, PfVP1, and PbVP1 amino acid sequences. The selected peptides are underlined and DX7KXE motif is boxed. |
抗TgVP1-1和TgVP1-2的多克隆抗体效价均达到1∶128 000。利用Protein-G免疫亲和层析法对获取的抗血清进行纯化,经SDS-PAGE检测,结果显示纯化效果较好,抗血清纯度较高,如图 2。
2.3 多克隆抗体的鉴定与应用 2.3.1 Western blot 检测天然弓形虫全蛋白利用Western blot方法对天然弓形虫全蛋白进行检测,结果显示在85 000左右有特异性条带,与TgVP1预测相对分子质量一致;对同属顶复门寄生虫的恶性疟原虫和伯氏疟原虫全蛋白进行检测,结果显示均在76 000左右处有特异性条带,与恶性疟原虫Ⅰ型液泡型质子焦磷酸酶(PfVP1)和伯氏疟原虫Ⅰ型液泡型质子焦磷酸酶(PbVP1)预测相对分子质量一致,如图 2。说明该多抗不仅可以检测TgVP1,而且可以识别PfVP1和PbVP1。
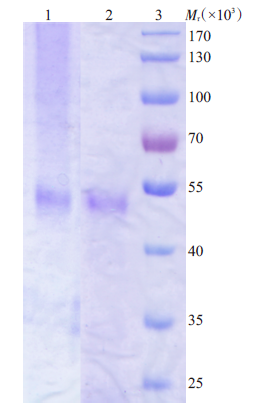
|
图 2 多克隆抗体的纯化及检测 Figure 2 Purification and detection of polyclonal antibodies. Lane 1, purified rabbit anti- TgVP1-1; Lane 2, purified rabbit anti- TgVP1-2; Lane 3, Marker. |
通过共聚焦显微镜观察,用兔抗TgVP1-1 和兔抗TgVP1-2 作一抗进行间接免疫荧光检测时,红色荧光散在分布于刚地弓形虫速殖子的胞质中,Merge 后与蓝色荧光无重合。用免疫前兔血清作一抗进行免疫荧光检测,结果显示无红色荧光,如图 3。红色荧光所指示为TgVP1,蓝色荧光所指示为细胞核,白光视野(BF)所示为弓形虫速殖子形态。结果说明,TgVP1散在分布于细胞质中,未见于细胞核中,与酸性钙体的亚细胞定位一致。
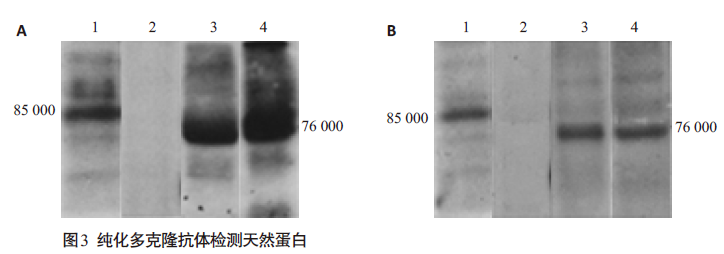
|
图 3 纯化多克隆抗体检测天然蛋白 Figure 3 Detection of natural parasites protein with purified polyconal antibodies. A; primary antibody is rabbit anti-TgVP1-1; B: primary antibody is rabbit anti-TgVP1-2. Lane 1, total protein of T. gondii; Lane 2, total protein of OFTU; Lane 3, total protein of P. falciparum; Lane 4, total protein of P. berghei. |
因弓形虫病传播途径较多,故人群普遍对其易感[2, 21]。为了开发新的抗弓形虫药物来保护人群,我们必须深入研究弓形虫的结构,找到新的药物作用靶点。目前,已有几种针对其他生物V-PPase的抗体,这些生物的V-PPase虽与弓形虫的具有一定同源性,但应用这些抗体进行对弓形虫TgVP1的研究,终究少了一些可信度。但是仍没有适合的针对弓形虫TgVP1的抗体研制成功。究其原因,TgVP1的跨膜区多达17个,使原核表达困难大大增加。所以,本研究采用了一种新方法——人工合成多肽制备抗体,选取并合成2个保守的非跨膜区肽段与载体蛋白偶联、免疫新西兰大耳白兔,最终获得了2株多克隆抗体。这种方法制备的抗原较传统原核表达目的蛋白制备的抗原相比,避免菌体杂蛋白的污染,纯度更高,且不需要繁琐的纯化步骤。制备的多抗,不仅特异性强、灵敏度高,而且大大缩短了抗体制备所需的时间[22]。并且为了后期研究的需要,我们选择了与恶性疟原虫和伯氏疟原虫同源性较高的肽段,因此,我们获得的2 株多抗均能灵敏且特异地识别与PfVP1和PbVP1同等相对分子质量的蛋白。在多肽片段的选择和设计过程中,首要的是预测分析目的蛋白的结构和表位,既要选择抗原性好的肽段,又要避开跨膜区和三维结构无法暴露的区域。其次,肽段长度、天然蛋白构象稳定程度也需要考虑,一般选择长度在15~40个氨基酸之间且具有稳定构象的线性表位进行合成[23]。偶联完成免疫雄性新西兰大耳白兔时,我们选其背部脊柱旁的位置作皮下注射,因为这里末梢神经较少,可以减少动物的痛苦。
有些研究中提到,TgVP1、PfVP1和PbVP1用SDSPAGE检测到的相对分子质量分别为76 000、67 000和67 000,与预测相对分子质量85 000、76 000和76 000不符[24]。这种现象在高疏水性蛋白质的SDS-PAGE电泳中很常见,主要是由于在电泳条件不稳定时,SDS无法将高疏水性蛋白质完全溶解导致的[25]。Western blotting结果显示有少量非特异性条带,但并不影响对实验结果的观察,且通过降低一抗浓度可以消除非特异性条带。最终的Western blotting和间接免疫荧光结果表明,本研究制备的兔抗TgVP1多克隆抗体不仅可以与TgVP1线性抗原特异性结合,还可以与其天然抗原特异性结合,同时还能检测顶复门寄生虫PfVP1 和PbVP1,且灵敏度和特异性均理想,可用于后期对弓形虫、恶性疟原虫和伯氏疟原虫V-PPase及酸性钙体的深入研究,为开发抗寄生虫新药奠定了基础,也为弓形虫病的诊断提供了新的有效工具。
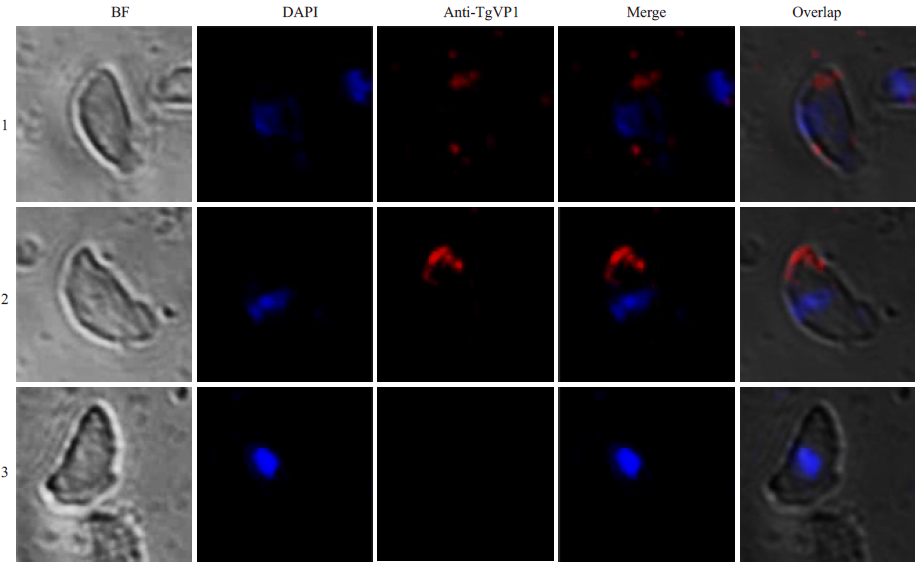
|
图 4 纯化多克隆抗体的间接免疫荧光检测 Figure 4 Indirect immunofluorescence detection of polyclonal antibodies. 1, primary antibody is rabbit anti-TgVP1-1; 2, primary antibody is rabbit anti-TgVP1-2; 3, primary antibody is non-immunized rabbit serum. |
| [1] | Jokelainen P, Simola O, Rantanen E, et al. Feline toxoplasmosis in Finland: cross-sectional epidemiological study and case series study[J]. J Vet Diagn Invest,2012, 24 (6) : 1115-24. DOI: 10.1177/1040638712461787. |
| [2] | Cook TB, Brenner LA, Cloninger CR, et al. "Latent" infection with Toxoplasma gondii: association with trait aggression and impulsivity in healthy adults[J]. J Psychiatr Res,2015, 60 : 87-94. DOI: 10.1016/j.jpsychires.2014.09.019. |
| [3] | Dardé ML, Ajzenberg D, Smith J. 3-Population structure and epidemiology of Toxoplasma gondii. //Weiss LK, Toxoplasma Gondii: The Model Apicomplexan[M]. London: Academic Press/Elsevier, 2011 : 49 -80. |
| [4] | Flegr J, Klapilova K, Kankova S. Toxoplasmosis can be a sexually transmitted infection with serious clinical Consequences[J]. Med Hypotheses,2014, 83 (3) : 286-9. DOI: 10.1016/j.mehy.2014.05.019. |
| [5] | Robert-Gangneux F, Dardé ML. Epidemiology of and diagnostic strategies for toxoplasmosis[J]. Clin Microbiol Rev,2012, 25 (2) : 264-96. DOI: 10.1128/CMR.05013-11. |
| [6] | Hill D, Dubey JP. Toxoplasma gondii: transmission, diagnosis and prevention[J]. Clin Microbiol Infect,2002, 8 (10) : 634-40. DOI: 10.1046/j.1469-0691.2002.00485.x. |
| [7] | Docampo R, Moreno SN. Acidocalcisomes[J]. Cell calcium,2011, 50 (2) : 113-9. DOI: 10.1016/j.ceca.2011.05.012. |
| [8] | Luo S, Vieira M, Graves J, et al. A plasma membrane-type Ca(2+)-ATPase co-localizes with a vacuolar H(+)-pyrophosphatase to acidocalcisomes of Toxoplasma gondii[J]. EMBO J,2001, 20 (1/2) : 55-64. |
| [9] | Rodrigues CO, Ruiz FA, Rohloff P, et al. Characterization of isolated acidocalcisomes from Toxoplasma gondii tachyzoites reveals a novel pool of hydrolyzable polyphosphate[J]. J Biol Chem,2002, 277 (50) : 48650-6. DOI: 10.1074/jbc.M208990200. |
| [10] | Moreno SN, Zhong L. Acidocalcisomes in toxoplasma gondii tachyzoites[J]. Biochem J,1996, 313 (Pt 2) : 655-9. |
| [11] | Luo S, Ruiz FA, Moreno SN. The acidocalcisome Ca2 +-ATPase (TgA1) of Toxoplasma gondii is required for polyphosphate storage, intracellular Calcium homeostasis and virulence[J]. Mol Microbiol,2005, 55 (4) : 1034-45. |
| [12] | Marchesini N, Luo S, Rodrigues CO, et al. Acidocalcisomes and a vacuolar H+-pyrophosphatase in malaria parasites[J]. BiochJ,2000, 347 (Pt) : 243-53. |
| [13] | Ruiz F, Luo S, Moreno SN, et al. Polyphosphate content and fine structure of acidocalcisomes of Plasmodium falciparum[J]. Microsc Microanal,2004, 10 : 563-7. DOI: 10.1017/S1431927604040875. |
| [14] | Li FJ, He CY. Acidocalcisome is required for autophagy in Trypanosoma brucei[J]. Autophagy,2014, 10 (11) : 1978-88. DOI: 10.4161/auto.36183. |
| [15] | Mcintosh MT, Drozdowicz YM, Laroiya K, et al. Two classes of plant-like vacuolar-type H(+)-pyrophosphatases in malaria parasites[J]. Mol Biochem Parasitol,2001, 114 (2) : 183-95. DOI: 10.1016/S0166-6851(01)00251-1. |
| [16] | Hsu SH, Lo YY, Liu TH, et al. Substrate-induced changes in domain interaction of vacuolar H+-pyrophosphatase[J]. J Biol Chem,2015, 290 (2) : 1197-209. DOI: 10.1074/jbc.M114.568139. |
| [17] | Liu J, Pace D, Dou Z, et al. A vacuolar-H (+ )-pyrophosphatase (TgVP1)is required for microneme secretion, host cell invasion,and extracellular survival of Toxoplasma gondii[J]. Mol Microbiol,2014, 93 (4) : 698-712. DOI: 10.1111/mmi.2014.93.issue-4. |
| [18] | Schilling RK, Marschner P, Shavrukov Y, et al. Expression of the arabidopsis vacuolar H +-pyrophosphatase gene (AVP1) improves the shoot biomass of transgenic barley and increases grain yield in a saline field[J]. Plant Biotechnol J,2014, 12 (3) : 378-86. DOI: 10.1111/pbi.2014.12.issue-3. |
| [19] | Lander N, Ulrich PN, Docampo R. Trypanosoma brucei vacuolar transporter chaperone 4 (TbVtc4) is an acidocalcisome polyphosphate kinase required for in vivo infection[J]. J Biol Chem,2013, 288 (47) : 34205-16. DOI: 10.1074/jbc.M113.518993. |
| [20] | 王小平, 郝文波, 罗树红, 等. 抗羊口疮病毒蛋白ORFV086多克隆抗体 的制备及其应用[J]. 中国畜牧兽医,2014, 41 (11) : 7-13. |
| [21] | Dubey JP, Rajendran C, Ferreira LR, et al. High prevalence and genotypes of Toxoplasma gondii isolated from goats, from a retail meat store, destined for human consumption in the USA[J]. Int J Parasitol,2011, 41 (8) : 827-33. DOI: 10.1016/j.ijpara.2011.03.006. |
| [22] | 胡小元, 张岐蜀, 段伟, 等. 用人工合成多肽作为半抗原制备 BtCry1Ac的单克隆抗体[J]. 中国农业科技导报,2012, 14 (2) : 88-94. |
| [23] | Zhao L, Hou XS, Ji R, et al. Establishment of bovine prion peptide-based monoclonal antibodies for identifying bovine prion[J]. Sci Chin Series C-life Sci,2009, 52 (8) : 754-60. DOI: 10.1007/s11427-009-0100-z. |
| [24] | Ejk RZ, Rea PA. The molecular and biochemical basis of Pyrophosphate-Energized proton translocation at the vacuolar membrane[J]. Adv Bot Res,1997, 25 : 297-337. DOI: 10.1016/S0065-2296(08)60156-1. |
| [25] | Maddy AH. A critical evaluation of the analysis of membrane proteins by polyacrylamide gel electrophoresis in the presence of dodecyl sulphate[J]. J Theor Biol,1976, 62 (2) : 315-26. DOI: 10.1016/0022-5193(76)90123-5. |
 2015, Vol. 35
2015, Vol. 35
