盐酸布比卡因是临床常用的局麻药之一,尤其在蛛网膜下腔阻滞广泛应用。但其所致的神经毒性损伤如短暂性神经病学综合征、马尾综合征等已引起人们的广泛关注[1-2]。钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)是一种多功能的丝氨酸/苏氨酸蛋白激酶,广泛分布于中枢和外周神经系统,是兴奋性突触的突触后致密物的主要成分,是调节神经元功能的重要分子。CaMKⅡ与T型钙通道关系密切,二者相互调节,在神经元活动中具有重要作用[3-5]。Cav3.1 是T型钙通道的一种亚型,也是SH-SY5Y细胞上表达的主要亚型,其是否与局麻药毒性损伤有关,以及CaMKⅡ是否通过调节Cav3.1参与盐酸布比卡因所致的神经毒性损伤目前尚不明确。本实验采用盐酸布比卡因致神经细胞损伤的模型,抑制CaMKⅡ的表达后,检测细胞活力、细胞凋亡率以及Cav3.1的表达来探讨CaMKⅡ及其对Cav3.1的调控在盐酸布比卡因诱导SH-SY5Y细胞损伤中的作用。
1 材料与方法 1.1 细胞培养SH-SY5Y细胞株购自中科院上海生命科学研究院细胞资源中心,采用DMEM培养液(含有谷氨酰胺4.0 mmol/L、葡萄糖4.5 g/L、链霉素100 mg/L和青霉素100U/L),置于37 ℃5%CO2 培养箱中培养,以5×105/mL的密度接种于96孔培养板(每孔100 μL)中用于实验。
1.2 实验分组与处理采用随机数字表法,将细胞随机分为4组(n=6):常规培养组(C组);CaMKⅡ抑制剂KN93组(K组)在细胞培养液中加入KN93(终浓度1 μmol/L,批号:139298-40-1,Sigma)孵育24 h;布比卡因组(B 组)在细胞培养液中加入盐酸布比卡因(终浓度1 mmol/L,批号:101034-200801,中国食品药品检定研究院)孵育24 h;KN93 +布比卡因组(KB组)在细胞培养液中加入KN93(终浓度1 μmol/L)和布比卡因(终浓度1 mmol/L) 孵育24 h。
1.3 细胞形态学观察药物孵育24 h后,在IX71-F22PH显微镜(Olympus公司,日本)下观察细胞形态变化。
1.4 细胞活力检测于药物孵育前、孵育1、6、12、24 h(T1~5)时各随机取6孔,每孔加入溶液[5 mg/mL,中国医药(集团)上海公司]10 μL,37 ℃继续孵育4 h,终止培养,吸去孔内培养液,每孔加入DMSO 150 μL,震荡10 min使结晶充分溶解,于MK3型全自动酶标仪(Ladsystems公司,芬兰)检测570 nm或630 nm波长处的吸光度值(A570及A630值),计算A570与A630差值,并以各时点A570与A630的差值与T1时差值的比值反映细胞活力。
1.5 细胞凋亡检测于T1~5时各随机取6孔,培养箱中继续孵育4 h后检测细胞凋亡情况。取细胞,置于离心管中,以离心半径10 cm,1500 r/min,离心5 min,收集悬浮细胞。PBS洗涤细胞2次后,以离心半径10 cm,1500 r/min,离心5 min,然后收集细胞。用400 μL 1X Annexin V结合缓冲液重悬细胞。将细胞悬液移至样品试管中,加入5 μLAnnexin V-FITC,轻轻混匀后于避光条件下室温24 ℃孵育15 min。加入碘化丙啶10 μL,使终浓度为50 μg/mL,染色5 min,24℃避光30 min后,使用FACSCalibur流式细胞仪(BD公司,美国)检测细胞凋亡情况,计算细胞凋亡率。每孔重复测定3次,取平均值。
1.6 Cav3.1蛋白检测药物于培养皿孵育24 h后,每组随机取6皿提取细胞总蛋白,Bradford 法定量后取50 μg 蛋白用于SDS-PAGE电泳,电泳完毕后,转移至PVDF膜上,5%脱脂牛奶封闭1 h,1∶500 Cav3.1一抗(Sigma 公)4 ℃过夜,1∶1000二抗1 h,ECL化学发光剂观察结果。采用Quantity one图像分析软件(Bio-Rad)分析各组蛋白条带的吸光度值,以Cav3.1 与β-actin 内参的比值为Cav3.1蛋白的相对表达量。
1.7 统计学处理采用SPSS 11.0统计学软件进行分析,计量资料以均数±标准差表示,组内比较采用重复测量设计的方差分析,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 SH-SY5Y细胞形态在倒置光学显微镜下常规培养的C组的SH-SY5Y细胞呈网状分布,细胞胞体呈梭型,突起丰富,交叉呈网状。K组细胞形态与C组相似,二者形态上无明显差异。B组细胞呈圆形,胞体蜷缩、突起消失,细胞漂浮。KB组细胞也表现为突起减少,部分细胞胞体蜷缩呈圆形,部分细胞漂浮。KB细胞受损程度小于B组细胞(图 1)。
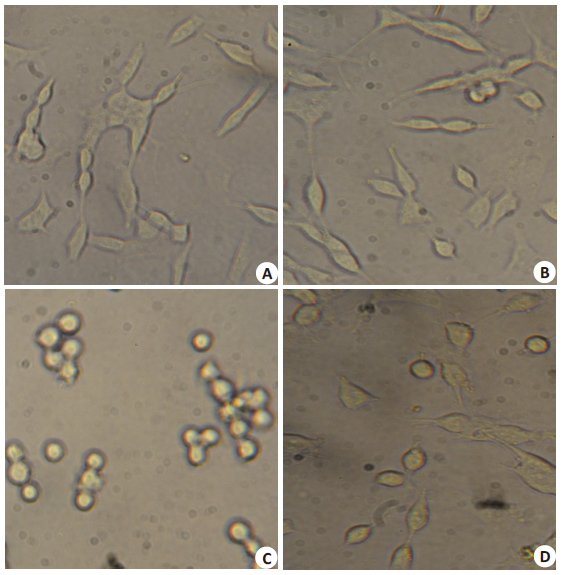
|
图 1 各组细胞形态学变化 Figure 1 Morphological changes of the cells after exposures (Original magnification: ×200). A: Group C; B: Group K; C: Goup B; D: Group KB. |
C组细胞活力各时间点无统计学差异;与C组比较,K组各时间点细胞活力无统计学差异。与C组和K组比较,B组和KB组细胞在盐酸布比卡因处理1、6、12及24 h后细胞活力降低。与B组比较,KB组细胞在盐酸布比卡因处理1、6、12及24 h后细胞活力增高(表 1)。
| 表 1 各组细胞各时间点细胞活力 Table 1 Viability of the cells at different time points during exposures (%, Mean±SD, n=6) |
C组细胞和K组细胞生长良好,各时间点细胞凋亡率低,两组之间比较无统计学意义。与C组和K组比较,B组和KB组SH-SY5Y细胞经盐酸布比卡因处理1、6、12、24 h后,SH-SY5Y细胞凋亡率增加。与B组细胞比较,KB组细胞凋亡率在盐酸布比卡因处理1、6、12及24 h后降低,差异有统计学意义(表 2)。
| 表 2 各组细胞各时间点细胞凋亡率 Table 2 Apoptosis rate of the cells at different time points during exposures (%, Mean±SD, n=6) |
各组细胞均可检测到Cav3.1蛋白的表达,与C组比较,K组细胞Cav3.1蛋白表达无统计学差异,B组和KB组细胞Cav3.1表达增加,差异有统计学意义。与B组比较,KB组细胞Cav3.1表达降低,差异有统计学意义(图 2)。
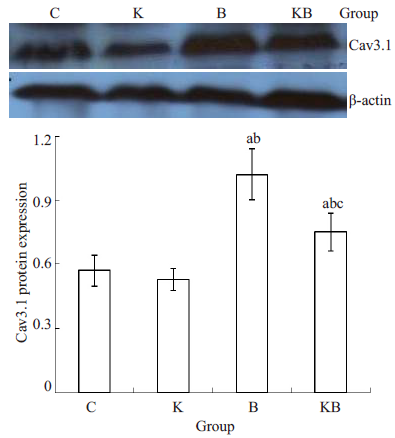
|
图 2 各组细胞Cav3.1蛋白的表达 Figure 2 Comparison of Cav3.1 protein expression levels among the groups (Mean±SD, n=6). aP<0.05 vs Group C; bP<0.05 vs Group K; cP<0.05 vs Group B. |
椎管内阻滞因具有镇痛效果好,对患者影响小,恢复快等特点,成为临床麻醉中广泛应用的一种技术,但局麻药在椎管内神经阻滞后所致的神经毒性反应也已引起人们的密切关注。盐酸布比卡因在椎管内阻滞尤其是蛛网膜下腔阻滞中广泛应用,对其神经毒性的研究具有较强的临床意义。SH-SY5Y细胞是人类神经母瘤细胞,其在生化、形态学、电生理学及超微结构方面与神经元极为相似,是研究离体神经元功能的常用细胞模型,也是研究吸入麻醉药和局麻药神经细胞毒性的常用细胞模型[6~8]。由于盐酸布比卡因对SH-SY5Y细胞半数致死率的浓度约为1.1 mmol/L[2],同时在临床麻醉工作中,局麻药的作用时间通常在24 h以内(术后镇痛除外),结合SH-SY5Y细胞自身生长及传代特点,因此,本实验选择的盐酸布比卡因的浓度为1 mmol/L,处理时间为24 h。
细胞内钙超载是局麻药神经毒性的机制之一[9~11]。细胞内的钙离子升高,与钙调蛋白(calmodulin,CaM)结合形成Ca2+-CaM复合物,激活CaMKⅡ,形成Ca2+-CaM-CaMKⅡ信号通路而导致细胞细胞损伤。本研究结果表明,钙调素依赖性蛋白激酶Ⅱ(CaMKⅡ)抑制剂KN93 可以减轻盐酸布比卡因对SH-SY5Y细胞的损伤,改善盐酸布比卡因所致的细胞活力降低和细胞凋亡率的增加。
T型钙通道是一种低电压依赖性钙通道,对调节神经元的兴奋性及神经递质的分泌有重要的调节作用[12-14]。我们前期研究发现,T型钙通道阻滞剂米贝地尔能改善盐酸利多卡因所致的SH-SY5Y细胞损伤,提示T型钙通道可能与盐酸利多卡因的神经毒性损伤有关[15]。
研究表明,CaMKⅡ与T型钙通道可以相互调控[3, 14]。一方面,CaMKⅡ是调节T型钙通道的上游型号,CaMKⅡ上调或下调可以直接调控T 型钙通道的上调与下调。另一方面,T型钙通道又是调节细胞内钙离子的重要通道,细胞外钙离子在静息状态下通过通过T型钙通道进入细胞内,可以激活高电压依赖性钙通道开放,使细胞外钙离子迅速进入细胞内;同时,细胞内钙离子升高还可以诱导细胞内的钙依赖性钙释放细胞内钙离子增加则可以激活CaMKⅡ。Cav3.1 是SH-SY5Y细胞表达的主要亚型[16],本研究发现,盐酸布比卡因可以增加SH-SY5Y细胞的Cav3.1表达增加,KN93则可以降低盐酸布比卡因所致的Cav3.1表达增加的幅度。上述结果提示,CaMKⅡ可能参与了了盐酸布比卡因所致的SH-SY5Y细胞损伤,且可能与其上调Cav3.1的表达有关。
综上所述,CaMKⅡ可能参与了盐酸布比卡因所致的SH-SY5Y细胞损伤,且可能与其上调Cav3.1的表达有关。
| [1] | Auroy Y, Benhamou D, Bargues L, et al. Major complications of regional anesthesia in France-The SOS Regional Anesthesia Hotline Service[J]. Anesthesiology,2002, 97 (5) : 1274-80. DOI: 10.1097/00000542-200211000-00034. |
| [2] | Perez-Castro R, Patel S, Garavito-Aguilar ZV, et al. Cytotoxicity of local anesthetics in human neuronal cells[J]. Anesth Analg,2009, 108 (3) : 997-1007. DOI: 10.1213/ane.0b013e31819385e1. |
| [3] | Iftinca MC. Neuronal T-type calcium channels: what`s new? Iftinca: T-type channe regulation[J]. J Med Life,2011, 4 (2) : 126-38. |
| [4] | Chemin J, Traboulsie A, Lory P. Molecular pathways underlying the modulation of T-type calcium channels by neurotransmitters and hormones[J]. Cell Calcium,2006, 40 (2) : 121-34. DOI: 10.1016/j.ceca.2006.04.015. |
| [5] | Welsby PJ, Wang H, Wolfe JT, et al. A mechanism for the direct regulation of T-type Calcium channels by Ca2 +/ calmodulin-dependent kinase II[J]. J Neurosci,2003, 23 (31) : 10116-21. |
| [6] | Biedler Jl HL, growth. Tumorigenicity and cytogenetics of human neuroblastoma cells in continuous culture[J]. Cancer Res,1973, 33 (11) : 2643-52. |
| [7] | Lin D, Feng C, Cao M, et al. Volatile anesthetics may not induce significant toxicity to human neuron-like cells[J]. Anesth Analg,2010, 112 (5) : 1194-8. DOI: 10.1097/ALN.0b013e3181d94d6e. |
| [8] | Lu J, Xu SY, Zhang QG, et al. Bupivacaine induces reactive oxygen species production via activation of the AMP-Activated protein Kinase-Dependent pathway[J]. Pharmacology,2011, 87 (3/4) : 121-9. |
| [9] | Johnson ME, Saenz JA, Dasilva AD, et al. Effect of local anestbetic on neuronal cytoplasmic calcium and plasma membrane lysis (necrosis) in a cell culture model[J]. Anesthesiology,2002, 97 (6) : 1466-76. DOI: 10.1097/00000542-200212000-00019. |
| [10] | Chang DC, Meng C. A localized elevation of cytosolic free calcium is associated with cytokinesis in the zebrafish embryo[J]. J Cell Biol,1995, 131 (6 Pt 1) : 1539-45. |
| [11] | Hogan QH. Pathophysiology of peripheral nerve injury during regional anesthesia[J]. Reg Anesth Pain Med,2008, 33 (5) : 435-41. DOI: 10.1097/00115550-200809000-00006. |
| [12] | Perez-Reyes E. Molecular physiology of low-voltage-activated T-type calcium channels[J]. Physiol Rev,2003, 83 (1) : 117-61. DOI: 10.1152/physrev.00018.2002. |
| [13] | Feltz A. Low-threshold-activated Ca channel: from molecules to function: over 25 years of progress[J]. Crit Rev Neurobiol,2006, 18 (1/2) : 169-78. |
| [14] | Cueni L, Canepari M, Adelman JP, et al. Ca2 + signaling by T-type Ca2+ channels in neurons[J]. Pflugers Arch,2009, 457 (5) : 1161-72. DOI: 10.1007/s00424-008-0582-6. |
| [15] | 文先杰, 徐世元, 周树勤, 等. T-型钙通道在利多卡因致神经母细胞瘤 SH-SY5Y 细胞损伤中的作用[J]. 中华麻醉学杂志,2011, 31 (4) : 456-9. |
| [16] | Wen XJ, Xu SY, Wang LL, et al. T-type calcium channel expression in cultured human neuroblastoma cells[J]. Neural Regeneration Res,2011, 6 (31) : 2410-3. |
 2015, Vol. 35
2015, Vol. 35
