2. 南方医科大学南方医院,广东 广州 510515 ;
3. 中国人民解放军264医院,山西 太原 030000
2. Department of Pathology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China ;
3. 264 Hospital of PLA, Taiyuan 030000, China
WTX(Wilm's tumor on X chromosome,又称FAM123B、AMER1、OSCS)是首个被发现定位于X染色体上的抑癌基因[1]。WTX于2007年首次在《Science》上被报道,并被认为在正常器官发育过程中发挥重要[2];在肿瘤等疾病相关研究方面,WTX 先后被证实在Wilms瘤[3],合并有颅骨硬化症的条纹状骨病(OSCS)[4-7]、白血病[8-9]、肾上腺皮质瘤[10]、消化道肿瘤的肝癌、胃癌[11-12]中存在不同程度突变,提示WTX可能在多种肿瘤的发生发展中发挥作用,但其在结直肠癌中的作用目前尚未见报道,其对结直肠癌发生、发展、患者预后的影响尚处于未知。
本课题组前期研究发现,WTX可能在结直肠癌的发生发展中发挥重要作用。本研究旨在通过慢病毒载体系统构建WTX稳定表达载体,并在结直肠癌中建立稳定慢病毒表达细胞株,为进一步研究抑癌基因WTX对结直肠癌发生、进展的明确作用以及作用机制提供分子生物学工具。
1 材料与方法 1.1 材料与试剂 1.1.1 细胞株、细菌与载体人胚肾293T细胞,结直肠癌SW620 细胞与大肠杆菌DH5α均为本实验室保存。三质粒慢病毒包装系统:GV287 、pHelper 1.0 和pHelper 2.0载体购自吉凯基因技术有限公司。
1.1.2 生物试剂DNA Marker 购自Fermentas,T4连接酶、限制性内切酶BamHⅠ/AgeⅠ购自NEB,质粒抽提、胶回收以及纯化试剂盒购自Qiagen,质粒转染用脂质体Lipofectamine2000 购自Life Technologies,逆转录及QPCR试剂盒购自Takara,全蛋白提取试剂盒购自南京凯基生物科技公司,兔抗人WTX及小鼠抗人GAPDH单克隆抗体分别购自Abcam与AbClonal,RPMI 1640与DMEM培养基、胎牛血清购自BI,G418购自Sigma。
1.2 方法 1.2.1 细胞培养人胚肾293T细胞用含10%胎牛血清的DMEM培养基,结直肠癌SW620 和HT29细胞用含10%胎牛血清的RPMI 1640培养基,常规置于37 ℃、含5% CO2、饱和湿度的培养箱中培养,细胞生长密度至80%~90%饱和时,用2.5%含EDTA的胰酶消化传代。1.2.2 重组慢病毒载体的构建与测序WTX基因CDS区全长3408 bp,以人类基因组DNA为模版,设计上、下游引物,并在引物两端分别插入BamHⅠ/AgeⅠ限制性酶切位点,(F:5'-ACCGGTCGCCACCATGGAGACCCAAAAGGATGAAGCTGCTC-3',R:5'-ACCCTTGGCTAGGTTTCCATTCATGGCAGTG-3',双下划线为酶切位点,下划线为保护碱基),PCR扩增基因片段,设置反应条件:94 ℃ 5 min 1 循环,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min 30循环,72 ℃ 10 min。PCR反应产物经双酶切后露出BamHⅠ/AgeⅠ粘性末端,与同步双酶切并纯化后的GV287慢病毒质粒载体用T4 DNA连接酶连接,转化DH5α感受态细菌,挑选阳性克隆,摇菌后菌液测序鉴定。
1.2.3 病毒颗粒包装与病毒液浓缩将生长状态良好的人胚肾293T细胞以50%~70%密度接种于15 cm的培养皿中,24 h待细胞贴壁后即可用于转染。转染前1 h将培基更换为无血清培养基,将重组基因质粒与病毒包装载体以一定比例混合(LV-WTX重组载体/空白对照载体:pHelper 1.0 载体:pHelper 2.0 载体=4∶3∶2),与Opti-MEM 混匀静置5 min 后,加入一定体积Lipofectamine 2000,轻柔混合,室温静置20 min后,将混合液加入待转染的293T细胞中,十字法摇匀,培养箱中培养8~12 h后,更换为含10%胎牛血清的DMEM,继续培养48 h。48h后,收集293T细胞上清液。将病毒上清液送交吉凯基因技术有限公司进行浓缩并滴度初测,将浓缩后病毒上清,进行滴度复验,并分装置于-80 ℃长期保存。
1.2.4 病毒滴度复测采用“荧光梯度稀释法”检测病毒滴度,检测前24 h,以每孔4×104的细胞数量铺293T细胞于96 孔板内,待细胞生长贴壁后可用于滴度检测。将重组慢病毒颗粒原液用无血清的DMEM逐倍稀释为1E+0、1E-1、1E-2…1E-6共7个梯度,逐孔加入293T细胞内,各梯度设置3个复孔。培养24 h后加入含10%胎牛血清的DMEM继续培养,96 h后观察各孔荧光细胞数量。荧光细胞数量随着病毒稀释倍数的增加逐渐减少,从病毒稀释倍数最大的倒数第1 或2 孔中,选取含可见荧光细胞最少的孔计算病毒滴度,3个复孔计算平均值。
病毒滴度(TU/mL)=荧光细胞数/病毒稀释倍数×1000。
1.2.5 慢病毒颗粒感染结直肠癌细胞及感染效率初步观察Western 检测6 株结直肠癌细胞内WTX内源性表达,选取内源性基因表达含量最低的细胞用于稳定感染。将选定的结直肠癌细胞以10%密度接种于24 孔板,次日待细胞贴壁生长后可用于感染。按照病毒MOI值,培基中加入合适比例病毒液,感染10~12 h后,更换为含10%胎牛血清的RPMI 1640培养基继续培养。感染72~96 h 后,荧光显微镜下初步观察并判断感染效率,准备G418药物筛选。
1.2.6 G418 筛选浓度测定以及筛选得到WTX感染稳定株以未经感染的结直肠癌细胞对G418最佳用药浓度进行筛选,将结直肠癌细胞接种于24孔板,待次日细胞密度达50%~70%时,更换培养基并加入浓度分别为500、800、1000、2000、3000 ng/mL的G418开始筛选,以10~14 d 内细胞全部死亡的最低浓度定为最佳筛选浓度。筛选结果确定G418最佳用药浓度为1000 ng/mL。
将慢病毒感染后的结直肠癌细胞,按50%~70%密度接种于六孔板,铺板24 h 后,按比例加入浓度为1000 ng/mL的G418,细胞生长达90%时可用含G418的培养基传代继续培养,维持药物浓度持续培养10~14 d,并在对照组细胞全部死亡时可终止筛选。得到慢病毒稳定感染的细胞株。
1.2.7 QPCR 对稳定株于mRNA水平鉴定PBS清洗目的细胞以及对照组细胞各2次,加入Trizol逐级提取细胞总RNA,逆转录得到cDNA,QPCR分析目的细胞以及对照细胞中WTX相对表达量。GAPDH做内参。引物序列:
WTX:
sense:GACCCAAAAGGATGAAGCT;
antisense:CCCCTCCAAAGAAACTAGGC,
GAPDH:
sense:TGAAGGTCGGAGTCAACGGA;
antisense:CCATTGATGACAAGCTTCCCG
1.2.8 Western blotting对稳定株蛋白水平鉴定分别收集适量稳定感染的目的细胞与对照组细胞,提取细胞全蛋白,BCA法测定蛋白浓度,8%的SDS-PAGE中,上样变性后的蛋白样品各30 μg,电泳分离后切取目的条带电转至0.45 μm PVDF膜,5%的脱脂奶粉室温封闭1 h,一定稀释比例的一抗(WTX 1∶75)4 ℃孵育过夜,PBST清洗3 min×5次,二抗(山羊抗兔IgG抗体,1∶5000)室温孵育1 h,PBST 清洗3 min×5 次,电化学发光曝光观察。GAPDH做内参。
2 结果 2.1 重组慢病毒载体构建以及鉴定WTX 基因CDS 区全长3408 bp,以人类基因组DNA为模版,PCR对合成片段进行扩增,因引物内插入BamHⅠ/AgeⅠ双酶切位点加保护碱基,产物预期全长3449 bp,将PCR扩增产物行琼脂糖凝胶电泳,结果显示产物大小与预期基本一致。扩增产物经双酶切后,用T4连接酶与同样经过双酶切露出BamHⅠ/AgeⅠ粘性末端的GV287慢病毒载体骨架连接,连接产物转化大肠杆菌DH5α,挑选阳性克隆菌进行摇菌,提取质粒进行初步双酶切鉴定后(图 1),进行测序分析。测序结果示片段全长测通拼接后与NCBI官方公布序列核对,碱基序列完全一致,提示WTX基因CDS区全长重组慢病毒载体构建成功,可用于病毒包装。
2.2 慢病毒包装将重组慢病毒载体或者阴性对照空载体与辅助包装载体共感染293T细胞,48 h后于荧光显微镜下观察可以看到大小不等的绿色荧光团块,提示慢病毒包装成功。
收集病毒上清,送交吉凯基因技术有限公司进行浓缩并滴度检测,病毒滴度复验采用荧光梯度稀释法,即将浓缩病毒上清行系列梯度稀释,加入到铺有293T细胞的96孔板内,96 h后,观察各孔内荧光,可见荧光数量随着病毒稀释倍数增加逐渐减少,其中,在1E-6的孔内已无可见荧光,在1E-5的孔内,可看到2个荧光团,提示至少有2 个病毒感染细胞,计算最终病毒滴度:2/(1E-5)×1000=2×108 TU/mL,与吉凯基因技术公司采用ELISA检测方法测得病毒滴度基本一致。
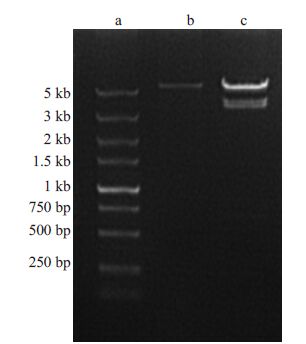
|
图 1 WTX过表达载体构建初步验证图 Figure 1 Electrophoresis of WTX CDS fragmentamplified by PCR. a: DNA marker; b: Doublerestriction enzyme digestion products ofGV287; c: Double restriction enzymedigestion products of the recombinant vector. |
WTX在SW480、SW620、LS174T、LOVO、HT29、HCT116 等6 株结直肠癌细胞内内源性表达检测结果示:SW620内源WTX表达最低,差异具有统计学意义,选作稳定感染的细胞株(图 2)。将SW620细胞以30%~50%的密度铺入24孔板,贴壁后即感开始染。每孔细胞加入15~25 μl慢病毒液,感染48 h后荧光显微镜下观察细胞生长状态良好,可见到绿色荧光,结合绿色荧光团块数量与视野内总细胞数量,粗测感染效率为40%~50%(图 3)。
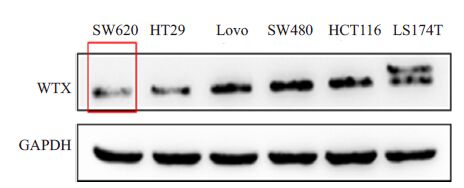
|
图 2 检测6株结直肠癌细胞株内WTX内源性表达 Figure 2 Endogenous WTX expression in 6 CRC cell lines. |
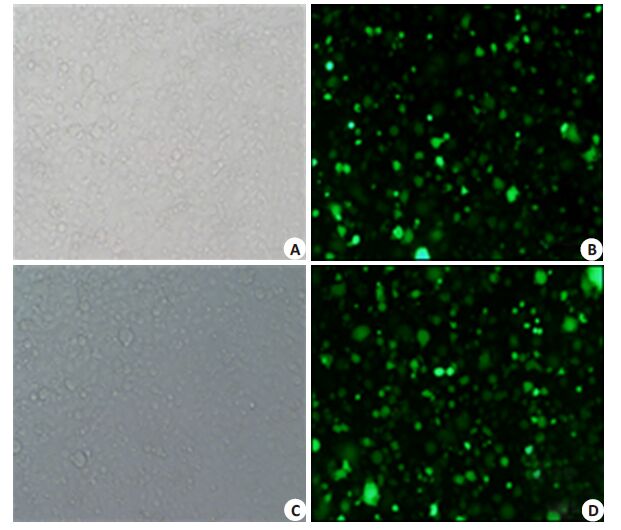
|
图 3 WTX慢病毒感染结直肠癌SW620细胞 Figure 3 SW620 cell lines transfected with WTX recombinant lentivirus vector,displaying white or green fluorescence (Original magnification: ×100). A: SW620-N1cell line,white; B: SW620-N1 cell line,green; C: SW620-W + cell line,white; D:SW620-W+ cell line,green. |
按照已验证的最佳筛选药物浓度,各孔细胞内各加入一定体积1000 ng/mL G418进一步筛选,在10~14 d内对照组空白细胞全部死亡时终止筛选,得到稳定感染重组病毒载体的细胞株。
2.4 QPCR与Western blot对稳定感染细胞株mRNA及蛋白水平定量分析鉴定QPCR对mRNA水平检测结果显示,与空白载体对照组相比,稳定感染LV-WTX 重组载体的细胞,WTX mRNA表达明显升高,差异具有统计学意义(图 4)。
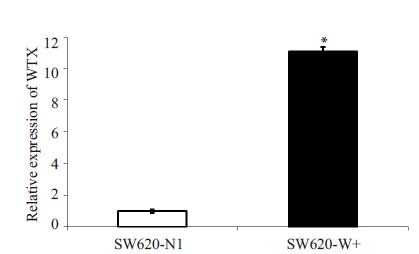
|
图 4 QPCR验证SW620细胞中WTX过表达效率 Figure 4 Detection of WTX mRNA expression inSW620-W+ cells. and SW620-N1 cells with qPCR (*P<0.01). |
Western blot 对蛋白水平表达检测结果显示,在GAPDH内参齐平时,与空载体对照组相比,稳定感染LV-WTX重组载体的细胞,WTX蛋白表达明显升高(图 5)。二者结果综合提示结直肠癌细胞在感染了LV-WTX重组慢病毒后,实现了WTX的稳定高表达。换言之,提示抑癌基因WTX的结直肠癌稳定过表达细胞系构建成功。
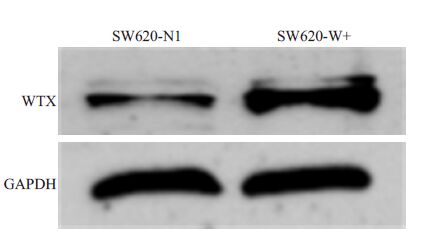
|
图 5 WB验证SW620细胞中WTX过表达效率 Figure 5 Detection of WTX protein expression inSW620-W+/NC cell lines by Western blotting. |
结直肠癌是国内外发病率以及致死率都最高的恶性肿瘤之一[13],且随着现代都市人民生活方式以及饮食习惯不良化改变,其发病率仍在逐年攀升[14]。因为缺乏对早期消化道症状的足够重视,多数患者在就诊时,已是肿瘤晚期,出现远处转移并可能合并多种并发症,失去了有效治疗的机会。且因为具有消化系统疾病一般特点,疾病会直接影响患者食欲、排便等日常生活,后期恶病质症状严重,晚期患者生存质量堪忧,态度消极。因此,积极探讨结直肠癌的发病原因及其病变机制,探寻有效的治疗方法,寻找高效用药靶点,对于临床患者治疗、改善预后有积极意义。
从基因学角度,肿瘤的异变主要包括原癌基因的激活与抑癌基因的失活。原癌基因的激活,是指机体内原本“沉默”表达的基因被异常激活,与之相对应。
抑癌基因的失活,是指原本在正常生命活动中发挥重要作用,对机体正常发育、生长或者维持正常活动起调节作用的基因,被异常“沉默”。基因的变异引起的一系列分子路径的继发改变,直接影响机体细胞的正常生命活动,继而影响人类健康。
肿瘤的分子靶向治疗正是基于此机理应运而生的一种肿瘤新兴治疗手段[15],其旨在使用特定药物“逆转”原本异变的分子学效应,靶向“改造”逆变的分子通路。这种“归根”治疗,使其成为在手术治疗,放、化疗之外另一重要治疗途径,为改善肿瘤患者预后提供了无限可能。而研究不同器官肿瘤内,异变的主要癌以及抑癌基因及其作用通路,则为发现相应的分子药物靶点的提供了主要途径。
其中,探索与结直肠癌相关的抑癌基因,以及其失活机制,是消化道肿瘤研究领域的重要方向之一,也是本课题组研究的主要方面。目前已知的与结直肠癌发生、发展相关的抑癌基因包括,APC[16],P53[6, 17],DCC[18],MMR[19]等,已发现参与作用的主要分子通路为Wnt/β-catenin信号通路[20]。但是由于肿瘤发生发展机制的复杂性,我们需要持续发现新的肿瘤相关基因以及可能作用分子路径,了解其对结直肠癌发生、发展过程的影响,从而寻找突破口,找到有效药物治疗靶点。
WTX于2007年被首次被发现,是首个被发现定位于X染色体上的抑癌基因[1],目前生物学研究领域对X染色体所知甚少,近年才逐渐发现X染色体上可能存在多种肿瘤抗原、遗传病致病基因以及肿瘤相关信号通路分子,其对遗传性疾病以及肿瘤发生、发展的影响很值得科研界探讨[21]。WTX首次报道后,先后被证实在Wilms tumor,合并有颅骨硬化症的条纹状骨病、白血病、肾上腺皮质瘤等疾病的发生、发展中有影响作用。但其在结直肠癌中的作用或者作用机制目前尚未所知。
本课题组前期初步研究发现结直肠癌中WTX异常“沉默”,提示WTX可能对结直肠癌发生或者发展有一定影响。为进一步研究WTX对结直肠癌进展的明确作用以及作用机制,本研究构建了WTX基因稳定表达的慢病毒载体,并稳定感染WTX内源性表达原本被异常“沉默”的结直肠癌SW620细胞,建立了结直肠癌稳定WTX高表达细胞系,为后续研究提供分子工具。
慢病毒感染是构建稳定表达细胞株的常用方法之一。慢病毒表达载体是以人类免疫缺陷病毒-1(HIV-1)为来源,经过后期人工改造的一种特定载体,在将外源待研究基因片段插入载体骨架后,载体可以稳定整合入宿主细胞染色体从而实现待研究基因的稳定表达,为进行后续实验分析目的基因功能提供分子工具。慢病毒载体包含了所有慢病毒包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。而经过前期改造处理后携带有外源基因的慢病毒载体,可以在慢病毒包装体系、细胞内环境的辅助下,经过病毒包装成为有感染力的病毒颗粒,经过感染细胞或活体组织,实现外源基因在细胞或活体组织中的稳定表达。
本研究首先利用化学合成技术逐碱基合成了WTX的全长CDS区片段,并将其插入慢病毒GV287骨架,构成WTX的重组慢病毒表达载体,该表达载体可以表达GFP 和neomycin,但因为目的基因片段过长,全长约3000 bp,GFP与目的基因在载体内采用独立启动子分开启动表达,只为在目的细胞感染时初步观察感染效率。将目的表达载体与构建慢病毒的辅助包装载体共转染人胚肾293T细胞,后收集上清液并浓缩产生病毒颗粒,并用慢病毒颗粒感染结直肠癌细胞,表达载体带有的neomycin抗性,用于后续续继续采用G418药物进一步筛选稳定感染克隆,最终得到稳定感染的细胞系。QPCR 与Western blotting 的结果证实,与阴性对照组细胞相比,稳定感染后的细胞WTX mRNA与蛋白表达均出现明显上升,差异具有统计学意义。表示结直肠癌内WTX稳定过表达细胞系构建成功,可用于后续的进一步实验。
综上所述,本实验成功构建了抑癌基因WTX的重组慢病毒表达载体,并建立了结直肠癌WTX稳定感染细胞系,为后续研究WTX在结直肠癌发生、发展中的作用以及作用机制提供了分子基础工具,对寻找分子药物治疗的靶点,最终用于结直肠癌的早期诊断、后期治疗有积极意义。
| [1] | Rivera MN, Kim WJ, Wells J, et al. An X chromosome gene, WTX, is commonly inactivated in Wilms tumor[J]. Science,2007, 315 (5812) : 642-5. DOI: 10.1126/science.1137509. |
| [2] | Huff V. Wilms tumor genetics: A new, unX-pected twist to the story[J]. Cancer Cell,2007, 11 (2) : 105-7. DOI: 10.1016/j.ccr.2007.01.011. |
| [3] | Ruteshouser EC, Robinson SM, Huff V. Wilms tumor genetics: Mutations in WT1, WTX, and CTNNB1 account for only about one-third of tumors[J]. Genes Chromosomes Cancer,2008, 47 (6) : 461-70. DOI: 10.1002/(ISSN)1098-2264. |
| [4] | Joseph DJ, Ichikawa S, Econs MJ. Mosaicism in osteopathia striata with cranial sclerosis[J]. J Clin Endocrinol Metab,2010, 95 (4) : 1506-7. DOI: 10.1210/jc.2009-2343. |
| [5] | Holman SK, Morgan T, Baujat G, et al. Osteopathia striata congenita with cranial sclerosis and intellectual disability due to contiguous gene deletions involving the WTX locus[J]. Clin Genet,2013, 83 (3) : 251-6. DOI: 10.1111/j.1399-0004.2012.01905.x. |
| [6] | Herman SB, Holman SK, Robertson SP, et al. Severe osteopathia striata with cranial sclerosis in a female case with whole WTX gene deletion[J]. Am J Med Genet A,2013, 161A (3) : 594-9. |
| [7] | Zicari AM, Tarani L, Perotti D, et al. WTX R353X mutation in a family with osteopathia striata and cranial sclerosis (OS-CS): case report and literature review of the disease clinical, genetic and radiological features[J]. Ital J Pediatr,2012, 38 (8) : 27. |
| [8] | Chung NG, Kim MS, Chung YJ, et al. Tumor suppressor WTX gene mutation is rare in acute leukemias[J]. Leuk Lymphoma,2008, 49 (8) : 1616-7. DOI: 10.1080/10428190802105082. |
| [9] | Owen C, Virappane P, Alikian M, et al. WTX is rarely mutated in acute myeloid leukemia[J]. Haematologica,2008, 93 (6) : 947-8. DOI: 10.3324/haematol.12509. |
| [10] | Gaujoux S, Pinson S, Gimenez-Roqueplo AP, et al. Inactivation of the APC gene is constant in adrenocortical tumors from patients with familial adenomatous polyposis but not frequent in sporadic adrenocortical cancers[J]. Clin Cancer Res,2010, 16 (21) : 5133-41. DOI: 10.1158/1078-0432.CCR-10-1497. |
| [11] | Yoo NJ, Kim S, Lee SH. Mutational analysis of WTX gene in Wnt/ beta-Catenin pathway in gastric, colorectal, and hepatocellular carcinomas[J]. Dig Dis Sci,2009, 54 (5) : 1011-4. DOI: 10.1007/s10620-008-0458-9. |
| [12] | Scheel SK, Porzner M, Pfeiffer S, et al. Mutations in the WTX-gene are found in some high-grade microsatellite instable (MSI-H) colorectal cancers[J]. BMC Cancer,2010, 10 (6) : 413. |
| [13] | Pisani P, Parkin DM, Bray F, et al. Erratum: estimates of the worldwide mortality from 25 cancers in 1990[J]. Int J Cancer,1999, 83 (6) : 870-3. DOI: 10.1002/(ISSN)1097-0215. |
| [14] | Parkin DM. Global cancer statistics in the year 2000[J]. Lancet Oncol,2001, 2 (9) : 533-43. DOI: 10.1016/S1470-2045(01)00486-7. |
| [15] | Chung-Faye GA, Kerr DJ, Young LS, et al. Gene therapy strategies for colon cancer[J]. Mol Med Today,2000, 6 (2) : 82-7. DOI: 10.1016/S1357-4310(99)01598-1. |
| [16] | Bougatef K, Marrakchi R, Ouerhani S, et al. No evidence of the APC D1822V missense variant's pathogenicity in Tunisian patients with sporadic colorectal cancer[J]. Pathol Biol (Paris),2009, 57 (3) : e67-71. DOI: 10.1016/j.patbio.2008.01.004. |
| [17] | Lane DP, Fischer PM. Turning the key on p53[J]. Nature,2004, 427 (6977) : 789-90. DOI: 10.1038/427789a. |
| [18] | Beggs AD, Abulafi M, Hodgson SV. The DCC gene and colorectal cancer: the story is more complex[J]. Colorectal Dis,2008, 10 (6) : 630. DOI: 10.1111/j.1463-1318.2008.01474.x. |
| [19] | Peng J, Jian-Qiu S, Ying-Hui Z, et al. Expression of cyclooxygenase-2 and its relationship with mismatch repair and microsatellite instability in hereditary nonpolyposis colorectal cancer[J]. Chin Med Sci J,2010, 25 (4) : 206-10. DOI: 10.1016/S1001-9294(11)60003-5. |
| [20] | Major MB, Camp ND, Berndt JD, et al. Wilms tumor suppressor WTX negatively regulates WNT/beta-catenin signaling[J]. Science,2007, 316 (5827) : 1043-6. DOI: 10.1126/science/1141515. |
| [21] | Ahn KS, Sethi G, Aggarwal BB. Embelin, an inhibitor of X chromosome-linked inhibitor-of-apoptosis protein, blocks nuclear factor-kappaB(NF-kappaB)signaling pathway leading to suppression of NF-kappaB-regulated antiapoptotic and metastatic gene products[J]. Mol Pharmacol,2007, 71 (1) : 209-19. |
 2015, Vol. 35
2015, Vol. 35
