2. 蚌埠医学院 临床检验诊断学实验中心, 安徽 蚌埠 233030
2. Research Center of Clinical Laboratory Science, Bengbu Medical College, Bengbu 233030, China
原花青素是一类由儿茶素和表儿茶素聚合而成的多酚类化合物,葡萄的籽和皮中富含原花青素。葡萄籽提取物原花青素(GSPE)具有较强的抗炎,抗氧化,预防心血管疾病和抗肿瘤生物学活性[1-2] 。近年来,葡萄籽提取物原花青素的抗肿瘤作用得到广泛关注,对于其机制的探讨也有不同的认识,但仍需更多的实验数据去进一步探讨葡萄籽提取物原花青素抗肿瘤作用的分子机制。
1 材料与方法 1.1 材料人胰腺癌AsPC-1细胞(购自中科院上海细胞库)。
1.2 试剂及仪器葡萄籽提取物原花青素(100 g 纯度为≥95%的原花青素,60%低聚物,天津市尖峰天然产物研究开发有限公司),RPMI 1640 培养基(Hyclone),胎牛血清(Gibco),四甲基偶氮唑蓝(MTT,Sigma),Trizol(Invitrogen),Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术研究所),miRcute miRNA isolation Kit(天根生化有限公司),Taqman MicroRNA ReverseTranscription Kit (Applied Biosystems) ,TaqmanUniversal Master Mix II(Applied Biosystems),let-7a及U6探针(Applied Biosystems),let-7a mimics(上海吉玛制药技术有限公司),LipoFectamine RNAiMax转染试剂(Invitrogen)。荧光定量PCR 仪(美国ABI stepone),FACSCalibur 流式细胞仪(美国BD)。
1.3 方法 1.3.1 细胞培养人胰腺癌AsPC-1 细胞培养于RPMI1640培养基中(含10%胎牛血清,1%青霉素及链霉素),置于37 ℃,5% CO2,100%饱和湿度的细胞培养箱中培养,2~3 d传代1次。
1.3.2 MTT检测AsPC-1 细胞生长至对数生长期时,0.25%胰酶消化贴壁细胞,完全培养基终止消化,并调整细胞数至2×104/mL后接种于96孔培养板,于细胞贴壁后,分别采用不同的分组处理细胞,继续培养72 h后,向各孔内加MTT 20 μL,置于培养箱继续培养4 h后,弃去培养基,每孔各加100 μL DMSO后,待结晶完全溶解后,在酶标仪上于波长490 nm处测各孔吸光度值。细胞增殖率按以下公式进行计算:细胞增殖率(%)=(GSE处理组D均值/对照组D均值)×100%(每组平均5个复孔,重复3次)。
1.3.3 Annexin V-FITC/PI 双染检测细胞凋亡取胰酶消化后的对数生长期细胞,调整细胞浓度后,按2×105/mL接种于6孔培养板,于细胞贴壁后,分别采用不同的分组处理细胞,继续培养24 h后,收集各组细胞,并按照Annexin V-FITC 细胞凋亡检测试剂盒说明书进行操作,最后流式细胞仪检测各组细胞凋亡情况。
1.3.4 transwell迁移实验具体方法参考文献[3] ,胰酶消化对数生长期细胞,用无血清培养基调整细胞浓度至2×105/mL,Transwell小室内加入100 μL无血清细胞悬液,小室下部加入600 μL 5% FBS的细胞培养基,待细胞贴壁后,采用不同的分组处理细胞,37 ℃,培养24 h后,棉签轻轻拭去各处理组小室上部基质细胞,小室底部细胞用4%多聚甲醛室温固定20 min,吉姆萨染色后拍照。每1组的迁移细胞数在显微镜下随机取5个视野进行细胞计数。
1.3.5 划痕实验具体参考文献[3] 方法,将5×105/mL对数生长期的AsPC-1细胞,接种于6孔培养板内,待细胞长满,用200 μL吸头轻轻的在细胞表面划一划痕,PBS洗涤去除脱落的细胞,采用不同的分组处理,分别在0 h和处理24 h后观察创伤愈合情况并拍照。
1.3.6 Real-time PCR细胞经分组处理后,每组收集约106细胞,用miRcute miRNA isolation Kit试剂盒提取细胞总RNA(含miRNA),经RNA浓度及纯度检测后,用Taqman MicroRNA Reverse Transcription Kit进行逆转录反应。let-7a 和内参基因U6 的探针由AppliedBiosystems 公司设计合成,按照Taqman UniversalMaster Mix II配置PCR反应体系,在荧光定量PCR仪上进行PCR扩增。每个样本均设置3 个重复反应孔。基因表达相对定量结果按照2-ΔΔCT法计算。
1.3.7 脂质体转染let-7a mimics胰酶消化对数生长期细胞,接种合适浓度至6 孔培养板内,待细胞生长至70%汇合度后,按照LipoFectamine RNAiMax 转染试剂说明书,转染let-7a mimics,使其终浓度为20 nmol/L。转染48 h后进行后续试验。
1.3.8 统计学分析采用SPSS 13统计软件对所测数据进行独立样本t检验以及单因素方差分析,以P<0.05为差异有统计学意义。
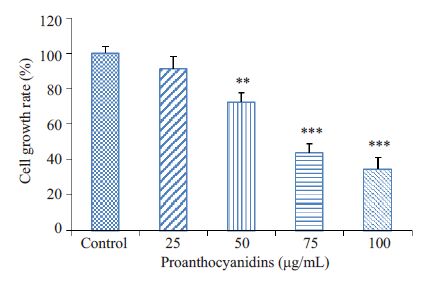
2 结果 2.1 原花青素对细胞增殖率的影响MTT实验结果显示,与对照组相比,原花青素处理AsPC-1细胞后,细胞增殖率明显降低,原花青素对胰腺癌细胞的抑制作用具有浓度依赖性。根据实验结果可知,原花青素作用AsPC-1细胞的IC50接近75 μg/mL(图 1),在随后的一些实验中我们将使用这一浓度进行检测。
|
图 1 原花青素对AsPC-1细胞增殖的影响 Figure 1 Effect of proanthocyanidins on proliferation ofAsPC-1 cells. **P<0.01,***P<0.001 vs control group. |
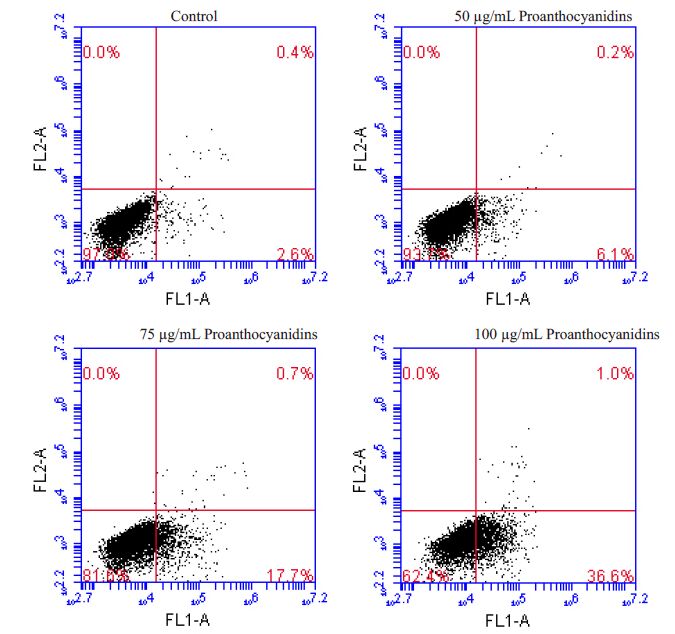
AnnexinV-FITC/PI 双染结果显示,原花青素具有明显诱导AsPC-1细胞凋亡的作用。从图 2中可知,原花青素作用24 h后,对照组、50 μg/mL浓度组、75 μg/mL浓度组、100 μg/mL浓度组的早期凋亡率分别为2.6%、6.1%、17.7%、36.6%,由此可见,原花青素诱导细胞凋亡作用具有浓度依赖性。
|
图 2 原花青素对AsPC-1细胞凋亡的影响 Figure 2 Effect of proanthocyanidins on apoptosis of AsPC-1 cells. |
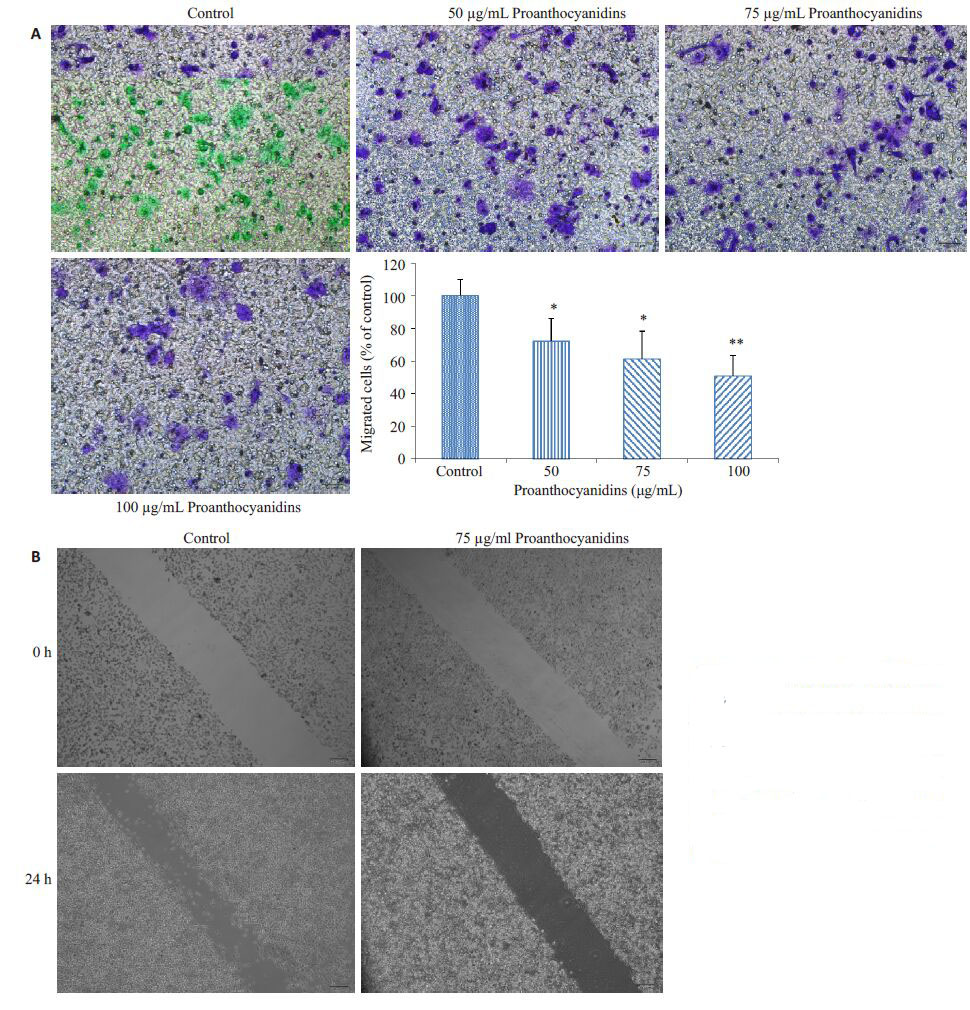
利用Transwell 迁移实验检测原花青素对细胞迁移能力的作用,实验结果显示,原花青素可以抑制AsPC-1的迁移作用,而且随着原花青素浓度的增加,AsPC-1细胞的迁移能力明显减弱。与对照组相比,各实验组的细胞迁移能力减弱均具有统计学意义,其中100 μg/mL原花青素对细胞迁移能力的抑制作用最为显著(图 3A)。为进一步验证原花青素对细胞迁移的影响,我们通过75 μg/mL原花青素处理细胞,利用划痕实验检测其迁移能力的改变,划痕实验结果显示,原花青素处理组细胞迁移能力明显低于对照组细胞(图 3B)。
|
图 3 原花青素对AsPC-1细胞迁移的影响 Figure 3 Effect of proanthocyanidinson migration of AsPC-1 cells. A:Cell migration was measured byTranswell assay,*P<0.05,**P<0.01vs control group; B: Cell migrationwas measured by wound-healingassay. |
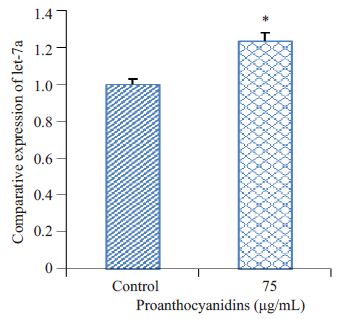
利用Taqman 探针法检测let-7a的表达,实验结果显示75 μg/mL原花青素处理组let-7a的表达高于对照组中let-7a的表达,具有统计学意义(图 4)。说明原花青素可以上调胰腺癌AsPC-1细胞中let-7a的表达。
|
图 4 原花青素对AsPC-1细胞let-7a表达的影响 Figure 4 Effect of proanthocyanidins on let-7aexpression in AsPC-1 cells. *P<0.05 vs control group. |
为了进一步证实原花青素对细胞生长、迁移的抑制作用是通过上调let-7a所导致的。我们将let-7a mimics转染入AsPC-1 细胞后,观察细胞生长及迁移能力的改变。实验分组为不加任何处理的对照组、转染let-7a mimics组、75 μg/mL GSPE作用组、let-7a mimics与75 μg/mL GSPE 共同作用组。实验结果显示(图 5):let-7a mimics组、75 μg/mL GSPE组细胞增殖率均明显低于对照组,说明let-7a表达上调以及原花青素均可以抑制细胞的增殖;而let-7a mimics 及75 μg/mL GSPE共同处理组与mimics、GSPE单独处理组相比,对细胞增殖的抑制作用最明显,提示了原花青素对细胞生长的抑制作用可能是通过上调let-7a所导致的。
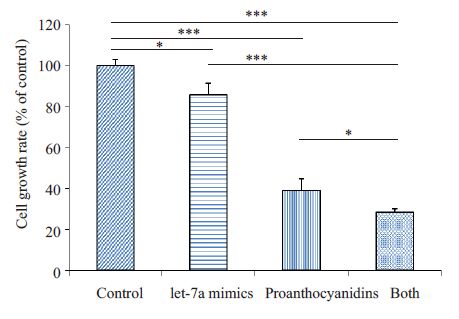
|
图 5 上调let-7a对AsPC-1细胞增殖的影响 Figure 5 Effect of let-7a up-regulation on cell growth ofAsPC-1 cells. *P<0.05,***P<0.001. |
我们利用transwell 实验进一步分析let-7a 上调后对细胞迁移能力的作用,实验分组同样为不加任何处理的对照组、转染let-7a mimics组、75 μg/mL GSPE作用组、let-7a mimics 与75 μg/mL GSPE 共同作用组。结果显示(图 6),let-7a mimics组细胞迁移能力明显低于对照组,说明let-7a表达上调后,可以抑制细胞的迁移;而且let-7a mimics 与75 μg/mL GSPE共同处理组对细胞迁移的抑制作用最明显,提示原花青素对细胞迁移的抑制作用可能是通过上调let-7a所导致的。
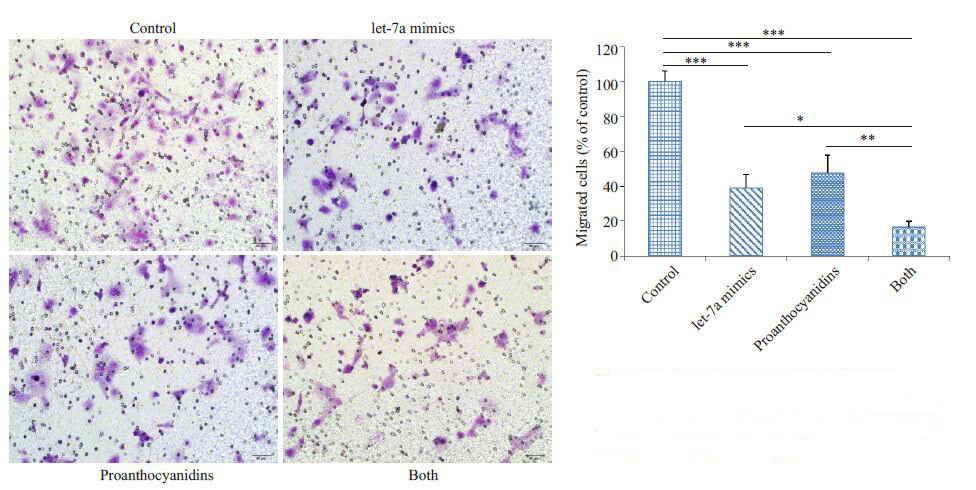
|
图 6 上调let-7a对AsPC-1细胞迁移的影响 Figure 6 Effect of let-7a up-regulation on migrationof AsPC-1 cells,(Original magnification: × 200),*P<0.05,**P<0.01,***P<0.001. |
胰腺癌是一种常见的恶性消化道肿瘤,该病恶性程度高,发病率高,早期诊断困难,绝大多数病人确诊时已经发生局部侵袭或转移,导致手术切除率低,仅为10~20%,5年存活率低于6%[4] 。因此防治胰腺癌是当今国内外研究的难点与热点。
miRNAs 是一类非编码小分子RNA,通过与靶基因mRNA碱基配对引导沉默复合体降解mRNA或阻碍其翻译,从而达到负向调控基因表达的功能。近年来,许多研究表明miRNA在肿瘤发生发展过程中发挥重要作用,miRNA与多种人类癌症相关,不同的miRNA可以发挥肿瘤抑制基因或者癌基因的功能[5] 。而let-7a已被证实在多种人类肿瘤包括胰腺癌中起到肿瘤抑制基因的功能。在前列腺癌中let-7a作为一种肿瘤抑制基因,具有抑制前列腺癌细胞的生长、诱导凋亡,引起细胞周期调控阻滞等作用[6] 。Kim等[7] 证实let-7a通过下调CCR7的表达,从而抑制乳腺癌细胞的迁移与侵袭。Liu等[8] 发现Lin28诱导乳腺癌细胞发生EMT变化和肿瘤干细胞的特性是由于Lin28下调了let-7a所致。Bhutia[9] 则发现let-7a可以提高胰腺癌对吉西他滨的化疗敏感性,这一作用与let-7a下调肿瘤耐药基因RRM2的表达有关。近年来,天然植物药物因为其来源广泛、毒副作用低等优点被广泛用于抗肿瘤新药的开发,肿瘤的基础研究与临床治疗中。原花青素是葡萄籽提取物中的主要酚类物质,其抗肿瘤作用已被广泛证实,原花青素对于乳腺癌、结肠癌、胰腺癌等多种肿瘤均有抑制作用[10-12] 。对于原花青素抑制胰腺癌作用及其机制的探讨,也有不同的认识。Prasad等[13] 通过体内外实验证实原花青素对胰腺癌有抑制作用,并且可能是通过PI3K/AKT信号途径来调控胰腺癌细胞的生长。此外,他还发现原花青素可以逆转胰腺癌细胞的EMT过程,从而抑制胰腺癌细胞的迁移[14] 。
本文探讨了原花青素对胰腺癌的抑制作用。MTT细胞增殖实验显示浓度分别为25、50、75、100 μg/mL的原花青素作用人胰腺癌AsPC-1细胞72 h后,细胞增殖率随着原花青素浓度的升高而逐渐降低,由此可见,在一定的浓度范围内,原花青素可呈浓度依赖性抑制人胰腺癌AsPC-1细胞的生长。细胞凋亡实验结果同样显示细胞凋亡率随着原花青素浓度增高而逐渐增高,提示了原花青素可以诱导AsPC-1细胞凋亡。此外,Transwell迁移实验结果显示AsPC-1细胞迁移能力随着原花青素浓度升高而降低,划痕实验结果同样显示原花青素可以抑制细胞迁移,进一步证明原花青素对细胞迁移能力的影响。说明了原花青素具有潜在的抗胰腺癌的作用。本实验还发现原花青素有上调胰腺癌AsPC-1 细胞内let-7a表达的作用。为了证明原花青素的抗胰腺癌作用与上调let-7a有关,我们通过转染let-7a mimics升高细胞内let-7a的含量,发现let-7a上调后细胞的增殖与迁移受到抑制,转染let-7a mimics和原花青素共同作用细胞后,细胞增殖与迁移的抑制作用明显高于转染let-7a mimics及原花青素单独作用组,进一步显示原花青素通过调控细胞内let-7a的表达而发挥抑制胰腺癌细胞的作用。
| [1] | Teixeira A, Baenas N, Dominguez-Perles R, et al. Natural bioactive compounds from winery by-products as health promoters: a review[J]. Int J Mol Sci,2014, 15 (9) : 15638-78. DOI: 10.3390/ijms150915638. |
| [2] | Bagchi D, Swaroop A, Preuss HG, et al. Free radical scavenging, antioxidant and cancer chemoprevention by grape seed proanthocyanidin: An overview[J]. Mutat Res,2014, 768 (14) : 69-73. |
| [3] | Ma J, Cheng L, Liu H, et al. Genistein down-regulates miR-223 expression in pancreatic cancer cells[J]. Curr Drug Targets,2013, 14 (10) : 1150-6. DOI: 10.2174/13894501113149990187. |
| [4] | Bartsch DK, Gress TM, Langer P. Familial pancreatic cancercurrent knowledge[J]. Nat Rev Gastroenterol Hepatol,2012, 9 (8) : 445-53. DOI: 10.1038/nrgastro.2012.111. |
| [5] | Croce CM. Causes and consequences of microRNA dysregulation in cancer[J]. Nat Rev Genet,2009, 10 (10) : 704-14. DOI: 10.1038/nrg2634. |
| [6] | Wu XQ, Huang C, Liu XH, et al. MicroRNA let-7a: a novel therapeutic candidate in prostate cancer[J]. Asian J Androl,2014, 16 (2) : 327-8. DOI: 10.4103/1008-682X.123680. |
| [7] | Kim SJ, Shin JY, Lee KD, et al. MicroRNA let-7a suppresses breast cancer cell migration and invasion through downregulation of C-C chemokine receptor type 7[J]. Breast Cancer Res,2012, 14 (1) : R14. DOI: 10.1186/bcr3098. |
| [8] | Liu Y, Li H, Feng J, et al. Lin28 induces epithelial-to-mesenchymal transition and stemness via downregulation of let-7a in breast cancer cells[J]. PLoS One,2013, 8 (12) : e83083. DOI: 10.1371/journal.pone.0083083. |
| [9] | Bhutia YD, Hung SW, Krentz M, et al. Differential processing of let-7a precursors influences RRM2 expression and chemosensitivity in pancreatic cancer: role of LIN-28 and SET oncoprotein[J]. PLoS One,2013, 8 (1) : e53436. DOI: 10.1371/journal.pone.0053436. |
| [10] | Kumar S, Kumar D, Raina K, et al. Functional modification of adipocytes by grape seed extract impairs their pro-tumorigenic signaling on colon cancer stem cells and the daughter cancer cells[J]. Oncotarget,2014, 5 (20) : 10151-69. DOI: 10.18632/oncotarget. |
| [11] | Kijima I, Phung S, Hur G, et al. Grape seed extract is an aromatase inhibitor and a suppressor of aromatase expression[J]. Cancer Res,2006, 66 (11) : 5960-7. DOI: 10.1158/0008-5472.CAN-06-0053. |
| [12] | Chung YC, Huang CC, Chen CH, et al. Grape-seed procyanidins inhibit the in vitro growth and invasion of pancreatic carcinoma cells[J]. Pancreas,2012, 41 (3) : 447-54. DOI: 10.1097/MPA.0b013e318229da41. |
| [13] | Prasad R, Vaid M, Katiyar SK. Grape proanthocyanidin inhibit pancreatic cancer cell growth in vitro and in vivo through induction of apoptosis and by targeting the PI3K/Akt pathway[J]. PLoS One,2012, 7 (8) : e43064. DOI: 10.1371/journal.pone.0043064. |
| [14] | Prasad R, Katiyar SK. Grape seed proanthocyanidins inhibit migration potential of pancreatic cancer cells by promoting mesenchymal-to-epithelial transition and targeting NF-κB[J]. Cancer Lett,2013, 334 (1) : 118-26. DOI: 10.1016/j.canlet.2012.08.003. |
 2015, Vol. 35
2015, Vol. 35
