2. 安徽医科大学基础医学院, 安徽 合肥 230000 ;
3. Northwestern University, Chicago IL 60611, USA
2. School of Basic Medical Sciences, Anhui Medical University, Hefei 233000, China ;
3. Department of Neurology, Northwestern University, Chicago IL 606, USA
慢性粒细胞白血病(CML)是一种多潜能造血干细胞恶性克隆性疾病,其具有特征性的染色体异位t(9,22)(q34,q11),能产生Bcr/Abl 融合基因,编码蛋白质P210[1] 。近年来,酪氨酸激酶抑制剂的应用对CML治疗效果有很大改善,但对慢粒急变的治疗效果仍不乐观。因此,寻找新治疗方法仍是CML研究的目标。K562细胞系是从1例处于急变期的CML患者胸水中分离并建立的,其同时具有CML细胞和急性粒细胞白血病细胞的特点,是筛选抗白血病药物的常用细胞模型。
三七是中医学上一味名贵的药材,主要作用为止血补血。三七总皂苷(PNS)是从三七的根中提取出主要活性成分,其主要成分包括三七皂苷R1、人参皂苷Rg1、Re、Rb1和Rd等。目前研究表明,PNS及其单体具有防治动脉硬化[2] 、抗抑郁[3] 、抗阿尔茨海默病[4] 、抗糖尿病[5] 和抗高血压[6] 等多种功能。近年来,PNS抗肿瘤作用倍受关注,有研究表明PNS可抑制结肠癌[7] 、肝癌[8] 等癌细胞增殖,并且有抑制乳腺癌细胞的迁移的作用[9] 。但是,有关PNS对K562细胞影响的研究较少,本实验将研究PNS对体外培养K562细胞的作用,并初步探讨其相关的分子机制。
1 材料与方法 1.1 主要试剂及配制胎牛血清、RPMI 1640培养基(Gibco),凋亡及周期检测试剂盒(碧云天),MTT(Sigma),Annexin V-FITC/PI 试剂盒(南京凯基),PCR引物(南京金斯瑞),一抗cleaved caspeas-3、cyclin D1、Fas、mTOR、p-mTOR(Ser2448)、p70S6K、p-p70S6K(Thr229/389)、4E-BP1、p-4E-BP1(Thr37/46)(Affinity Biosciences),HRP标记的羊抗兔IgG、HRP 标记的羊抗鼠IgG(Santa Cruz)。PNS(南京广润)用含10%胎牛血清RPMI 1640培养基溶解并稀释浓度为5 mg/mL,4 ℃保存。
1.2 细胞培养K562 细胞在含10%胎牛血清的RPMI 1640 培养基中培养。以下各项实验使用对数生长期细胞进行。
1.3 MTT法检测细胞增殖情况将K562 细胞接种于96 孔培养板,5000/孔,加入PNS稀释液,补齐培养基至100 μL/孔,设置对照组,及PNS分别为50、100、200、400、800 μg/mL的5个实验组,设5个复孔,并设置空白孔。MTT法检测24、48、72 h的细胞存活率。细胞存活率=(A给药-A空白)/(A对照-A空白)。实验重复3次。根据细胞存活率计算PNS对K562细胞的IC50值,根据ID50值并对比其他研究人员的用药浓度,选取低、中、高3个药物浓度组进行以下实验。
1.4 荧光显微镜观察细胞的凋亡情况将K562细胞接种于六孔板,浓度为6×105/孔,使用不同浓度的PNS(0、100、200、400 μg/mL)处理,培养48 h后离心收集各组全部细胞,以PBS调整细胞浓度为106/mL,各组皆吸取混匀的细胞悬液100 μL,然后加入浓度为100 μg/mL 的AO、EB 染液各2 μL,吹打混匀,取50 μL涂于载破片上,使用荧光显微镜观察细胞核的颜色形态变化。
1.5 Annexin V-FITC/PI双染色法检测细胞的凋亡率K562细胞分组及加药情况同1.4,48 h后离心收集细胞。以PBS洗涤后加入500 μL Binding Buffer悬浮细胞,再加入5 μLAnnexin V-EGFP混匀后加入5 μL PI,设置空白对照组和单色对照组。混匀室温避光反应15 min,使用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.6 流式细胞仪检测细胞周期的变化K562 细胞分组及加药情况同1.4,48 h 后收集细胞,预冷PBS洗涤1次,加入预冷的70%乙醇固定细胞12 h,PBS洗涤1次后收集细胞于流式管,加入预先配置好的含有RNase A和PI的染色液0.5 mL,缓慢并充分重悬细胞,37 ℃避光温浴30 min,随后冰浴放置并用流式细胞仪检测在488 nm激发波长下红色荧光和光散射情况。实验重复3次。
1.7 Western blot检测凋亡、周期及mTOR信号通路相关蛋白及磷酸化蛋白表达情况分组及加药情况同1.4,孵育72 h,提取各组细胞总蛋白,使用SDS-PAGE法对变性后的蛋白进行电泳,转膜后室温封闭2 h,一抗分别为cleaved caspeas-3、cyclin D1、Fas、mTOR、p70S6K及4E-BP1,4 ℃孵育过夜。使用TBST 洗膜3 次,二抗37 ℃孵育2 h。再用TBST 洗膜3 次后使用ECL 进行显色,随后使用BIO-RA胶成像仪曝光,检测条带灰度值(蛋白相对表达量=目的条带灰度/内参条带灰度×100%)。
细胞接种浓度同1.4,对照组不加药,3 h后收集细胞提取总蛋白,实验组PNS浓度为200 μg/mL,分别在加药1、2、3 h 后提取总蛋白,检测mTOR 总蛋白(t-mTOR)的蛋白量,及p-mTOR(Ser2448)、p-p70S6K(Thr229/389)、p-4E-BP1(Thr37/46)等磷酸化蛋白量,方法同1.8.1。p-mTOR(Ser2448)相对表达量=p-mTOR 条带灰度值/t-mTOR 条带灰度× 100% 。p-p70S6K(Thr229/389)、p-4E-BP1(Thr37/46)相对表达量=目的条带灰度/对照条带灰度×100%。
| 表 1 待测基因引物序列、退火温度及扩增长度 Table 1 Primer sequences,annealing temperature and amplified fragment length of the target genes in RT-PCR |
分组加药情况及培养时间同1.7.1,提取总RNA,每组取2 μg 逆转录合成cDNA,对各组样本内参基因GAPDH及目的基因mTOR、p70S6K、4E-BP1进行PCR扩增。预变性为94 ℃ 5 min;变性为94 ℃ 35 s,退火温度见表 1,时间为35 s,延伸为72 ℃ 35 s,进行30 个循环。扩增产物进行琼脂糖凝胶电泳,使用BIO-RAD凝胶成像仪检测电泳结果。计算各组目的mRNA的相对表达量(相对表达量=目的条带灰度/内参条带灰度值×100%)。
1.9 统计学处理统计数据皆采用均数±标准差表示,统计学分析采用SPSS 17.0软件,采用单因素方差分析法进行组间比较,采用SNK法进行两两比较。P<0.05为差异有统计学意义。
2 结果 2.1 PNS抑制K562细胞增殖MTT 实验结果显示(图 1),PNS 浓度为100~800 μg/mL,作用时间分别为24、48、72 h时,其对K562细胞增殖的具有明显的抑制作用,且具有时间和药物浓度依赖性,差异具有统计学意义(P<0.05)。PNS的IC50为229.07±2.36 μg/mL。根据此结果,以下将使用100 μg/mL作为低浓度组,200 μg/mL作为中浓度组,400 μg/mL作为高浓度组进行实验。
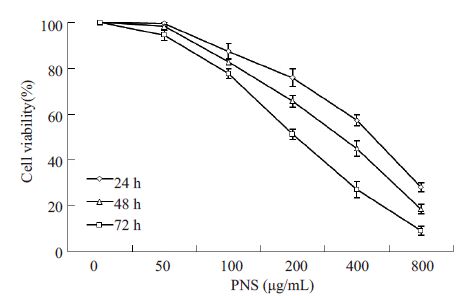
|
图 1 PNS对K562细胞存活率的影响 Figure 1 Effects of PNS on the survival rate of K562 cells. |
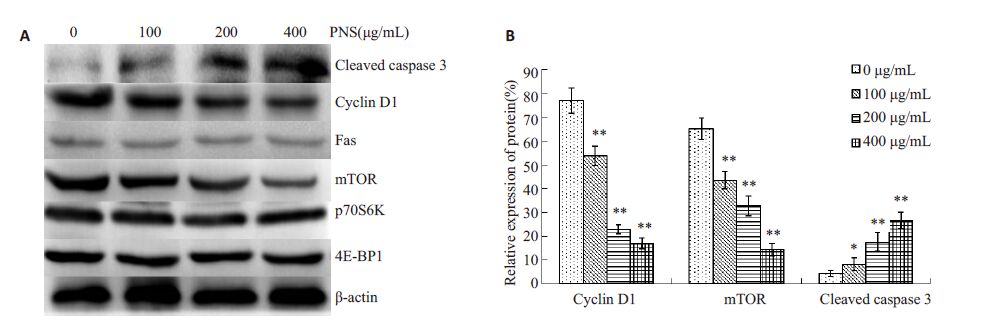
经AO/EB染色后镜检发现,PNS作用后,K562部分细胞核发生了固缩及碎裂(图 2A,B),其红色荧光细胞数目较对照组增多,且红色荧光的细胞数目所占的比例随着药物浓度的增加而增加(图 2C、D、E、F)。Annexin V-FITC/PI双染色法检测细胞凋亡率结果显示(图 3),浓度为100、200、400 μg/mL的PNS作用于K562细胞48 h后,早期凋亡与晚期凋亡的细胞总和分别为(8.5±1.9)%、(15.6±2.3)%、(33.4±2.7)%,与对照组(3.2±0.7)%相比,差异具有统计学意义(P<0.05)。使用Western blot法对凋亡相关蛋白的表达量进行检测,发现Fas 蛋白的变化没有统计学意义(P>0.05),而cleaved caspase-3 的表达量增加(P<0.05,图 5)。结果提示PNS 能过上调cleaved caspase-3 的表达,促进K562细胞发生凋亡。
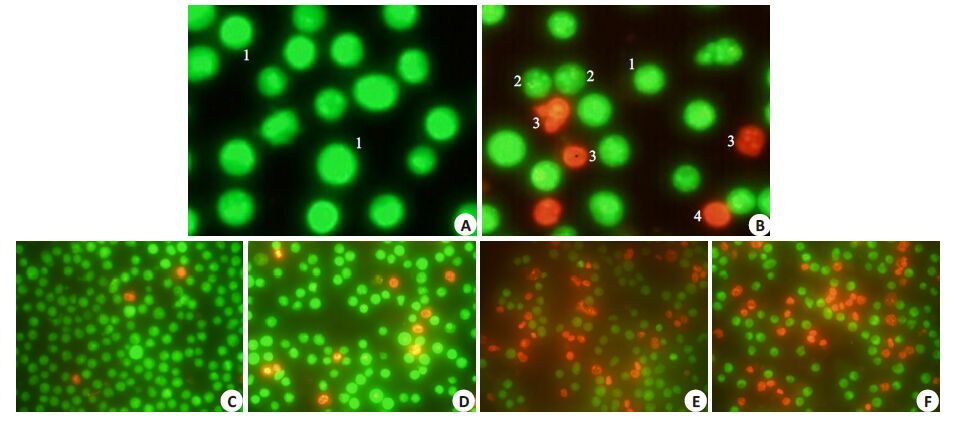
|
图 2 AO/EB双荧光染色检测PNS对K562细胞的凋亡影响 Figure 2 Apoptosis of K562 cells detected by AO/EB after treatment with PNS for 48 h. A,C: Control; B,F: PNS (400 μg/mL); D: PNS(100 μg/mL). E: PNS (200 μg/mL). 1: Normal cell; 2: Early apoptotic cell; 3: Late apoptotic cell; 4: Dead cell. A,B: Originalmagnification: ×400; C,D,E,F: Original magnification: ×200. |
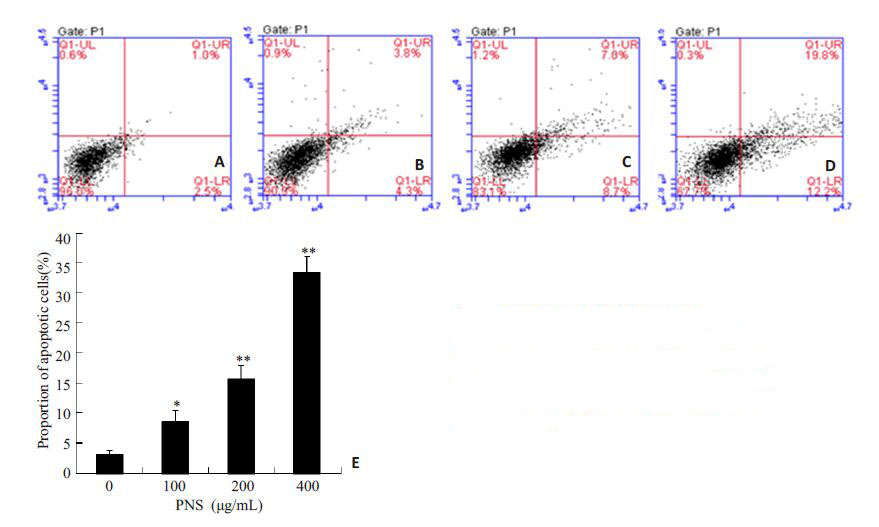
|
图 3 PNS对K562细胞的凋亡影响 Figure 3 Effects of PNS on the apoptosis of K562cells. A: Control; B: PNS (100 μg/mL); C: PNS(200 μg/mL); D: PNS (400 μg/mL); E:Proportion of apoptotic cells. *P<0.05,**P<0.01 vs control. |
流式细胞仪检测结果显示(图 4),随着PNS浓度的升高,S期及G2/M期的细胞比例逐渐减少,而G0/G1期的细胞比例逐渐增多。差异有统计学意义(P<0.05,表 2)。使用Western blot 法检测G0/G1期周期蛋白cyclinD1 的表达变化,发现PNS 作用于K562 细胞72 h 后,cyclin D1 蛋白的表达量降低(P<0.05,图 5)。这说明PNS能够下调cyclin D1的表达,将K562细胞周期阻滞在G0/G1期。
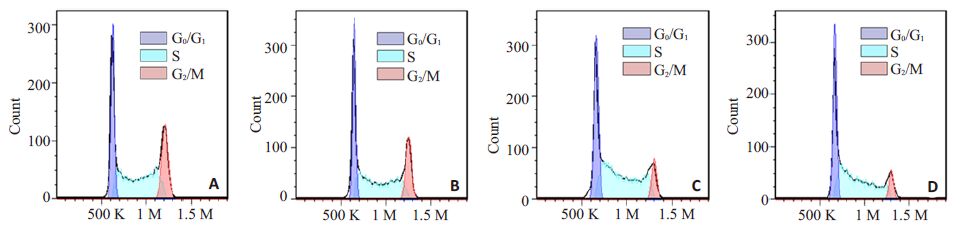
|
图 4 PNS对K562细胞的周期影响。 Figure 4 Effects of PNS on cell cycle of K562 cells. A: Control; B: PNS(100 μg/mL); C: PNS(200 μg/mL); D: PNS(400 μg/mL). |
| 表 2 流式细胞仪检测三七总皂苷作用48 h后K562细胞的周期变化 Table 2 Cell cycle distribution detected by FACS cytometry in K562 cells treated with PNS for 48 h (%,Mean±SD,n=3) |
|
图 5 PNS对K562细胞cleaved caspase 3、cyclin D1、Fas 、mTOR、p70S6K和4E-BP1的蛋白表达的影响 Figure 5 Effects of PNS on the expression of cleaved caspase 3,cyclin D1,Fas,mTOR,p70S6K and 4E-BP1 in K562 cells. A: Westernblot analysis; B: Quantitative analysis of the relative expression of cyclin D1,mTOR and cleaved caspase 3 protein. *P<0.05 ,**P<0.01 vs control. |
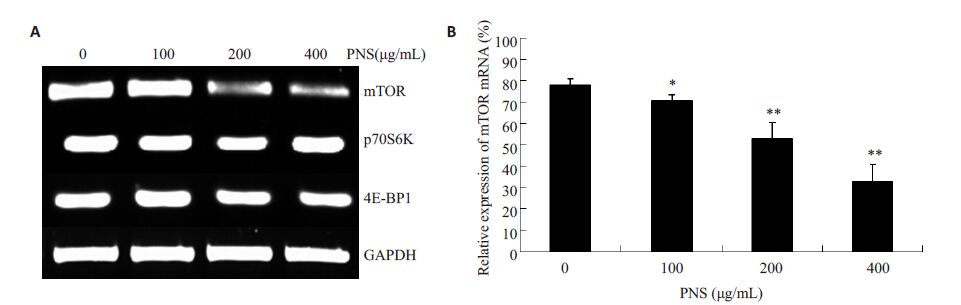
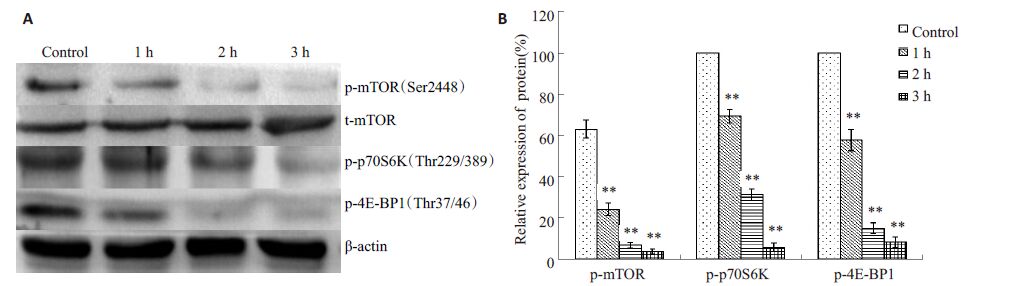
有研究表明cyclin D1蛋白的表达与mTOR信号通路的活性具有相关性,因此本实验对mTOR通路主要蛋白的基因表达水平及蛋白表达水平进行了检测。使用100~400 μg/mL PNS 作用K562 细胞72 h 后,RT-PCR结果显示(图 6):mTOR mRNA的相对表达量与对照组相比明显降低,差异具有统计学意义。而p70S6K和4E-BP1 的mRNA 变化没有统计学意义(P>0.05)。Western Blot检测结果显示(图 5),mTOR蛋白表达下降(P<0.05),而p70S6K及4E-BP1 这两种蛋白没有明显变化(P>0.05)。由于mTOR信号通路分子的活性状态为磷酸化蛋白,故本实验检测了mTOR、p70S6K 及4E-BP1 3种蛋白的磷酸化水平,结果显示,200 μg/mLPNS 能够显著降低K562 细胞中mTOR、p70S6K 和4E-BP1 3种蛋白的磷酸化水平(图 7,P<0.05)。实验结果提示PNS 能够抑制mTOR mRNA 的转录,下调mTOR蛋白的表达,抑制mTOR、p70S6K及4E-BP1这3种蛋白磷酸化,从而降低mTOR信号通路的活性。
|
图 6 PNS对K562细胞mTOR、p70S6K及4E-BP1 mRNA表达水平的影响 Figure 6 Effects of PNS on the expression of p-mTOR,p-p70S6K and p-4E-BP in K562 cells. A: RT-PCR analysis; B: Relativeexpression of mTOR mRNA. *P<0.05,**P<0.01 vs control. |
|
图 7 PNS对K562细胞p-mTOR、p-p70S6K及p-4E-BP1蛋白表达水平的影响 Figure 7 Effects of PNS on the expression of p-mTOR,p-p70S6K and p-4E-BP in K562 cells. A: Western blot analysis; B: Relativeexpression of p-mTOR,p-p70S6K and p-4E-BP1 proteins. **P<0.01 vs control. |
抑制肿瘤细胞的增殖对治疗癌症有至关重要的作用,近年来研究发现PNS能够有效抑制多种癌细胞增殖。Wen等[8] 研究得出,200 μg/mL 的PNS能够明显抑制SMMC-7721、BEL-7402 和HepG2 三株肝癌细胞增殖,但对正常肝细胞株L-02 没有显著的增殖抑制作用。Wang等[10] 研究发现,浓度为250 μg/mL的PNS对结肠癌HCT-116细胞的72 h抑制率为27.6%,但对大鼠肠上皮细胞没有明显的抑制作用。本结果显示,PNS对K562细胞有明显的增殖抑制作用,且此作用具有浓度和时间依赖性。综合上述结果可知PNS能够抑制多种肿瘤细胞增殖,但其对正常细胞的抑制作用不明显。
为了研究PNS抑制K562细胞增殖的具体原因,我们采用A0/EB 双荧光染色法观察,发现药物作用后K562细胞的细胞核出现了固缩及裂解,这提示细胞存在凋亡变化,而Annexin V-FITC/PI双染色法也证实了PNS 对K562 细胞的促凋亡作用。同时,我们发现cleaved caspase-3蛋白在用药后的K562细胞中表达增加,这进一步证明了PNS对K562细胞的促凋亡作用。
我们发现PNS作用后,G1期周期蛋白cyclin D1表达下降,K562细胞发生了G0/G1期阻滞。与我们的研究结果相同的是,PNS中的单体人参皂苷25-OCH3-PPD能将A549、H358及H838这3株肺癌阻滞在G0/G1期[11] 。但与我们的研究结果不同的是,PNS中的单体人参皂苷Rb1、人参皂苷Rg1及三七皂苷R1能将结肠癌细胞SW480阻滞在S期及G2/M期[10] 。造成这种差异的原因可能是PNS含有多种单体,其作用的靶点可能有多个。因为对于三七总皂苷,不同地区的产品乃至不同的提取工艺都可能导致其单体比例的差异,从而导致不同的作用效果。综合以上研究结果可知,PNS能够通过促进肿瘤细胞凋亡、阻滞肿瘤细胞周期来抑制K562细胞的增殖。
mTOR即哺乳动物雷帕霉素靶蛋白,是一种丝氨酸/苏氨酸蛋白激酶,它与p70S6K 及4E-BP1 同属mTOR信号通路的主要信号蛋白。p70S6K(40S 核糖体S6 蛋白激酶)和4E-BP1(真核启动因子4E结合蛋白1)的磷酸化水平受到mTOR复合体的调节,二者活化后将进一步调节蛋白质的合成,影响细胞的增殖、凋亡和周期等生理活动[12] 。mTOR信号通路的过度激活与多种癌细胞如乳腺癌细胞、肺癌细胞及白血病细胞等的增殖、转移分化紧密相关[13] 。作为慢粒细胞的特征性融合蛋白,Bcr/Abl具有很强的酪氨酸激酶活性[13] ,可激活体内多种信号通路,而在Bcr/Abl介导的细胞癌变过程中,mTOR 信号通路发挥着关键作用[14-15] 。研究发现,在Bcr/Abl表达阳性的白血病细胞株中,mTOR信号通路处于激活状态,且其下游的信号分子p70S6K和4E-BP1磷酸化水平也很明显升高[16] 。磷酸化的4E-BP1 与eIF4E分离,而eIF4E主要调节cyclin D1、Myc等蛋白质的翻译。
Li 等[17] 使用雷帕霉素抑制K562 细胞的mTOR信号通路活性后,发现K562 细胞增殖受到抑制,凋亡增加,活性caspase-3表达上调,且细胞被阻滞在G0/G1期,cyclin D1 表达下降,这与我们的研究结果非常相似。因此我们推测PNS有类似雷帕霉素的作用,我们通过检测PNS对K562细胞mTOR信号通路的影响,发现PNS能够降低了K562 细胞mTOR 的转录量,从而抑制mTOR蛋白的表达,与此同时,K562细胞mTOR信号通路的磷酸化水平也受到了抑制。这提示PNS是通过抑制mTOR信号通路的活性,来抑制K562细胞增殖,促进其凋亡并且使其发生周期阻滞。
三七总皂苷作为一种中草药提取物,由于其作用靶点复杂,药理作用尚未完全明确,因此将其作为临床化疗药物的辅助用药更为有益。Yu等[18] 发现PNS能够增强顺铂对Hela细胞的毒性作用,将PNS与5-FU联合应用于HCTT-116细胞,发现PNS能够增强5-FU的抗肿瘤作用[19] 。Wang 等[20] 发现PNS 能够提高低剂量Cytoxan对黑色素瘤模型小鼠的抗肿瘤作用。这表明PNS能够增强化疗药物的化疗作用,提示PNS可以作为治疗癌症的辅助用药。总之,本研究发现PNS能够抑制K562细胞增殖,促进其凋亡,使其发生周期阻滞,从而发挥其抗肿瘤的作用,为PNS临床治疗白血病提供了一定的理论基础。
| [1] | Shtivelman E, Lifehitz B, Gale R, et al. Fused transcript of abl and bcr genes in chronic myelogenous leukaemia[J]. Nature,1985, 315 (6020) : 550-4. DOI: 10.1038/315550a0. |
| [2] | Liu Y, Hao F, Zhang H, et al. Panax notoginseng saponins promote endothelial progenitor cell mobilization and attenuate atherosclerotic lesions in apolipoprotein E knockout mice[J]. Cell Physiol Biochem,2013, 32 (4) : 814-26. DOI: 10.1159/000354484. |
| [3] | Xiang H, Liu Y, Zhang B, et al. The antidepressant effects and mechanism of action of total saponins from the caudexes and leaves of Panax notoginseng in animal models of depression[J]. Phytomedicine,2011, 18 (8/9) : 731-8. |
| [4] | Li L, Liu Z, Liu J, et al. Ginsenoside Rd attenuates betaamyloid- induced tau phosphorylation by altering the functional balance of glycogen synthase kinase 3beta and protein phosphatase 2[J]. Neurobiol Dis,2013, 54 (8) : 320-8. |
| [5] | Yang CY, Wang J, Zhao Y, et al. Anti-diabetic effects of Panax notoginseng saponins and its major anti-hyperglycemic components[J]. J Ethnopharmacol,2010, 130 (2) : 231-6. DOI: 10.1016/j.jep.2010.04.039. |
| [6] | Pan CS, Huo YQ, An XJ, et al. Panax notoginseng and its components decreased hypertension via stimulation of endothelialdependent vessel dilatation[J]. Vascul Pharmacol,2012, 56 (3/4) : 150-8. |
| [7] | Wang CZ, Xie JT, Fishbein A, et al. Antiproliferative effects of different plant parts of Panax notoginseng on SW480 human colorectal cancer cells[J]. Phytother Res,2009, 23 (1) : 6-13. DOI: 10.1002/ptr.v23:1. |
| [8] | Wen LL, Bin X, Hui Z. Effects of panax notoginseng saponins on the proliferation of three different kinds of human hepatoma cell line[J]. Antitumor Pharmacy,2013, 3 (2) : 100-3. |
| [9] | Wang P, Cui J, Du X, et al. Panax notoginseng saponins(PNS) inhibits breaste cancer metastasis[J]. J Ethnopharmacol,2014, 154 (3) : 633-71. |
| [10] | Wang CZ, Xie JT, Zhang B, et al. Chemopreventive effects of Panax notoginseng and its major constituents on SW480 human colorectal cancer cells[J]. Int J Oncol,2007, 31 (5) : 1149-56. |
| [11] | Wei W, Elizbeth RR, Jie H, et al. Anti-lung cancer effects of novel ginsenoside 25-OCH3-PPD[J]. Lung Cancer,2009, 65 (6) : 306-11. |
| [12] | Gibbons JJ, Abraham RT, Yu K. Mammalian target of rapamycin: discovery of rapamycin reveals a signaling pathway important for normal and cancer cell growth[J]. Semin Oncol,2009, S36 (S3) : 3-17. |
| [13] | Rumjanek VM, Vidal RS, Maia RC. Multidrug resistance in chronic myeloid leukaemia: how much can we learn from MDR-CML cell lines[J]. Biosci Rep,2013, 33 (6) : 875-88. DOI: 10.1042/BSR20130067. |
| [14] | Vakana E, Sassano A, Platanias LC. Induction of autophagy by dual mTORC1-mTORC2 inhibition in BCR-ABL-expressing leukemic cells[J]. Autophagy,2010, 6 (7) : 966-7. DOI: 10.4161/auto.6.7.13067. |
| [15] | Cilloni D, Saglio G. Molecular pathways: BCR-ABL[J]. Clin Cancer Res,2012, 18 (4) : 930-7. DOI: 10.1158/1078-0432.CCR-10-1613. |
| [16] | Machado-Neto JA, Favaro P, Lazarini M, et al. Knockdown of insulin receptor substrate 1 reduces proliferation and downregulates Akt/mTOR and MAPK pathways in K562 cells[J]. Biochim Biophys Acta,2011, 1813 (8) : 1404-11. DOI: 10.1016/j.bbamcr.2011.04.002. |
| [17] | Li J, Xue L, Hao HL, et al. Rapamycin provides a therapeutic option through inhibition of mTOR signaling in chronic myelogenous leukemia[J]. Oncol Rep,2012, 27 (2) : 461-6. |
| [18] | Yu ML, Zhang CL, Yuan DD, et al. Panax notoginseng saponins enhances the cytotoxicity of cisplatin via increasing gap junction intercellular communication[J]. Biol Pharm Bull,2012, 35 (8) : 1230-7. DOI: 10.1248/bpb.b110535. |
| [19] | Wang CZ, Xie JT, Bin Z, et al. Notoginseng enhances anticancer effect of 5-Fluorouracil on human colorectal cancer cells[J]. Cancer Chemother Pharmacol,2007, 60 (3) : 69-79. |
| [20] | 王远航, 祝延, 张翠玲, 等. 三七总皂苷联合环磷酰胺节律化疗抗肿瘤效应观察[J]. 北京中医药大学学报,2010, 33 (1) : 36-9. |
 2015, Vol. 35
2015, Vol. 35
