肝内胆管囊性肿瘤(IBCT)是一种少见的起源于肝内胆管上皮的囊性肿瘤,约占肝内囊性病变的5%左右[1],包括肝内胆管囊腺瘤(IBCA)和肝内胆管囊腺癌(IBC)。近年来,随着影像学技术的进步,IBCT特别是IBCA的报道越来越多,但IBC的报道仍较少,且多为个案报道或小样本研究,对IBC的临床病理特征研究仍较少[2-3]。手术切除是目前治疗IBCT的主要方式,完整切除后肿瘤复发或恶变率较低[2, 4],但对于IBC的预后仍有争议,部分学者认为其预后差,远期预后与胆管癌相似[5],也有学者认为如能完整切除肿瘤,远期预后仍较好[6-7],但目前尚缺乏对影响IBC预后的相关因素研究。我们回顾性分析2000年1月~2014年4月我院经术后病理确诊的46例IBC患者的临床资料,旨在提供其相关临床病理特点,并为临床诊疗提供经验。
1 资料与方法 1.1 研究对象与临床资料收集2000年1月~2014年4月46例经术后病理证实为IBC患者的临床资料。分析患者的一般资料、临床表现、实验室检查、影像学表现、手术方式、病理学特征及预后。并与同期行手术治疗的58例IBCA患者的临床资料进行对比,观察两者在一般资料、实验室检查及影像学表现的差异。
1.2 随访所有患者术后1个月开始随访,此后每3月随访1次,如随访1年无复发或转移,则0.5~1年随访1次。随访内容包括肝功能检查、血清肿瘤标记物、腹部超声或CT检查。随访方式为门诊复查或电话随访,如患者未复诊或因联系方式变更无法获知患者当前健康状态则定义为失访。随访始点为患者手术时间,终点为死亡时间或2014年10月。
1.3 统计学方法采用SPSS统计软件19.0 版本对数据进行统计学分析。计量资料采用均数±标准差表示,组间比较采用t检验或秩和检验。计数资料的比较采用χ2 检验或Fisher 精确概率法。单因素生存分析采用kaplan-Meier法和log rank检验。P<0.05为差异有统计学意义。
2 结果 2.1 IBC一般资料及比较46例IBC患者中,男性15例,女性31例,平均年龄为57.0±10.7岁,平均病史时间38.9±92.9月,4例病史时间>10年。56.5%(26/46)的患者主要临床表现为腹痛、腹部不适,21.7%(10/46)的患者表现为黄疸或反复腹痛、发热等胆管炎症状,17.4%(8/46)为查体时意外发现。既往手术史6例:囊肿开窗术3例,反复囊肿穿刺引流术1例,肝囊腺瘤部分切除术1例,肝囊肿内引流1例。
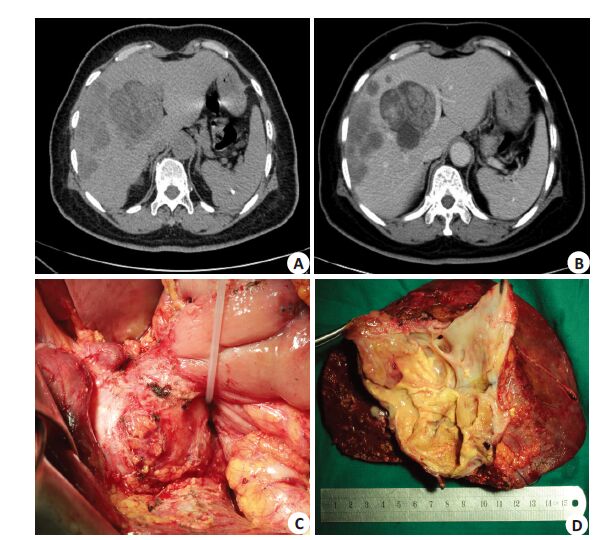
21例患者肝功能检查无明显异常,6例黄疸或胆管炎患者出现明显肝功能异常,1 例术前胆红素最高为443.2 μmol/L。术前影像学检查包括:CT 43例,超声17例,MRI 8例,MRCP 4例,PET-CT 2例。IBC典型的CT表现为:肝内圆形或类圆形多囊肿物,囊壁厚薄不均(40/46,86.9%),内可见分隔(39/46,84.8%),囊壁或分隔处可见乳头状(结节状)结构(40/46,86.9%),囊壁或乳头状结构增强扫描时可见强化(41/46,89.1%)。部分肿瘤内可见钙化灶,钙化灶可位于肿瘤任何位置。肿瘤多为单发,仅2例术前CT示肝内多发占位(图 1A、B)。3例直径<3 cm的肿瘤未呈囊实性改变,均为实性占位,1例合并胆管内癌栓。
|
图 1 肝内胆管囊腺癌CT特征及术中所见 Figure 1 Computed tomographic (CT) and intraoperative findings of IBC. A,B:The CT images showed a primary IBC in the left hepatic lobe with multiplemetastases in the right lobe,internal septas and mural nodules showing mildcontrast enhancement in the venous phase; C,D: Intraoperative finding of theIBC in liver IV segment with exophytic growth and invading the duodenumand internal septas with mural nodules. |
通过与58例IBCA临床资料比较(表 1),二者在性别、平均年龄方面差异具有统计学意义。IBC平均年龄明显高于IBCA(53.0±10.7岁vs 44.3±15.3岁,P=0.03),26.1%(12/46)的IBC 患者年龄>60 岁。男性患者在IBC中比例明显高于IBCA(15/46 vs 8/58,P=0.02),差异具有统计学意义。术前肝功能检查及肿瘤标记物方面,二者差异无统计学意义(P均>0.05,见表 1)。影像学方面,除肿瘤内乳头结构(40/46 vs 36/58,P=0.04)外,二者在肿瘤大小、部位、肿瘤内有无分隔、有无钙化灶、增强扫描时强化方面,差异无统计学意义。
| 表 1 肝内胆管囊腺癌与肝内胆管囊腺瘤患者的临床特征比较 Table 1 Clinical characteristics of IBC and IBCA patients |
所有患者均行手术治疗,36例患者肿瘤完整切除,其中肝楔形切除、肿瘤局部切除等非解剖性肝切除(19例),解剖性肝切除(17例):肝左外叶切除(2例)、左半肝切除(8例)、右后叶切除(1例)、右半肝切除(4例)、左三叶切除(1例)或右三叶切除(1例)。肿瘤未完整切除或姑息性切除10例:肿瘤分别与门静脉、下腔静脉、肝动脉关系密切,行肿瘤大部切除术4例;术后病理提示胆管切缘阳性1例;术中发现腹壁及远处转移行肿瘤活检术3例;术中发现全肝多发转移行肝脏结节切除活检术2例。1例因肿瘤与门静脉关系密切,完整切除肿瘤后行门静脉重建术。2例患者合并胆管结石。
围手术期无患者死亡,11例出现术后并发症:腹腔积液4例,腹腔脓肿2例,切口感染3例,腹腔出血2例,胆瘘3例,3例患者合并2种并发症。仅1例左半肝切除后腹腔出血的患者行再次手术治疗,其余患者均经保守治疗后治愈。平均住院时间10.1±7.3 d。
2.3 病理学检查IBC呈圆形或类圆形,囊壁厚薄不均,切面呈多囊状,内有分隔,囊内可见烂鱼肉状乳头状结构(图 1D),囊液呈清亮色、咖啡色或胆汁样,如合并感染可呈脓性。镜下观:囊壁被覆柱状或复层上皮,肿瘤基质分为卵巢样基质或非卵巢样基质(如纤维组织基质)。根据术后病理,卵巢样基质者27例,非卵巢样基质者19例。根据Nakajima[8]对IBC生长类型分型:IBC局限在囊壁内未侵犯周围肝实质为非浸润型;IBC侵及周围组织或远处转移则分为浸润型(图 1C)。本研究中,浸润型18例,非浸润型28例。淋巴结转移4例,合并胆管内癌栓6例,合并肝包虫病1例。
2.4 随访及预后分析43 例患者获得随访,平均随访时间为44.6±32.7月。完整切除肿瘤者中失访2例,肿瘤未见复发22例,肿瘤复发或转移12例(4例患者行再次手术治疗),死亡10 例。10 例未完整切除肿瘤患者中失访1 例,死亡8例,1例术后45个月仍带瘤存活。死亡患者的临床资料见表 2。患者中位生存时间为56月,总体1年,3年,5年生存率分别为:85.9%,65.2%,47.7%。
| 表 2 18例死亡患者的临床病理资料 Table 2 Information of deaths among the patients with IBC |
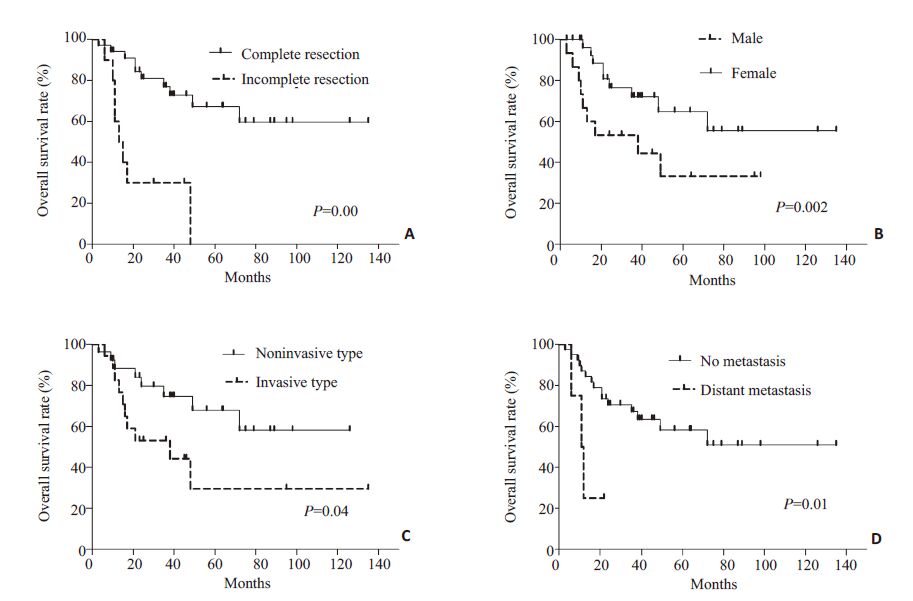
Kaplan-Meier单因素生存分析中(图 2),性别(χ2=4.05,P=0.04)、手术方式(χ2=15.29,P=0.00)、肿瘤生长类型(χ2=5.07,P=0.02)、肿瘤有无远处转移(χ2=6.49,P=0.01)是影响患者预后的重要因素。完整切除肿瘤患者的1、3、5年生存率为90.9%,72.2%,57.9%,而未完整性切除肿瘤患者的1年生存率仅为40%(图 2A)。在完整切除肿瘤的患者中,解剖性切除与非解剖性切除对预后无明显影响(χ2=0.57,P=0.44)。
|
图 2 对影响患者预后的相关因素进行kaplan-Meier单因素分析 Figure 2 In univariate analyses,complete tumor resection (A),the male gender (B),noninvasive tumor growth (C) and absence ofmetastasis (D) were all important favorable prognostic factors for the patients' survival. |
IBC 与IBCA好发与中年女性患者[5, 9],本研究中67.4%(31/46)的患者为女性,年龄为48.8±9.8岁,与文献报道相符[2-3, 5],但IBC平均年龄更高,更易发生于男性患者。目前关于IBC的起源尚不明确,有学者认为其由IBCA恶变而来,也有学者认为其直接起源于肝内胆管,且原发性囊腺癌较囊腺瘤恶变而来的囊腺癌预后要差。Devaney等[10]认为男性IBC多起源于肝内胆管上皮,病程进展迅速,而女性IBC多由IBCA恶变而来,病程进展缓慢。我们的研究与上述结论相似,性别是影响患者预后的重要因素,即使肿瘤完整切除,男性预后仍较差。在我们的随访中,序号为1(表 2)的男性死亡患者,肿瘤虽完整性切除,但3年后肿瘤复发并侵犯胃窦部,再次切除肿瘤并胃大部切除,1年肿瘤再次复发,并侵犯尾状叶、肝门部胆管,腹壁,膈肌。序号为3的男性死亡患者,虽行肿瘤完整切除,但术后6个月后即复发并脑转移。
术前实验室检查对于IBC和IBCA的诊断和鉴别诊断意义不大[11]。多数患者肝功能检查正常,肝功能异常与肿瘤大小无关,与胆道梗阻、感染等继发性改变相关[12-13]。CA19-9及CEA对于IBC和IBCA的鉴别诊断意义有限,即使IBC患者中,大部分患者肿瘤标记物仍正常。近期研究表明,CA19-9及CA125可用于IBC和IBCA的术前鉴别诊断[14],但我们的研究未得到类似结论。可用于术前鉴别诊断的敏感指标仍待进一步研究。
IBC和IBCA的术前诊断主要依赖于影像学检查。典型的CT表现或超声表现为边界清楚的肝内圆形或类圆形囊性肿物,囊壁较厚或厚薄不均,其内可见分隔,超声下囊内多为混合回声或低回声,部分囊壁或分隔处可见乳头状结构,增强扫描时可见囊壁和乳头状结构强化。MRI较CT有更高的软组织分辨率,在显示囊内成分、囊壁结构及与周围组织关系方面优于CT,囊液T1WI 多为等信号,T2WI 多为高信号,囊壁及分隔在T1WI及T2WI均呈稍低信号,动脉期乳头状结构明显强化,门脉期及延迟期持续强化,囊壁或囊内分隔则轻度强化。除IBC更易出现结节状或乳头样结构外,其余影像学表现与IBCA相似,术前较难鉴别诊断[15]。IBC内乳头状结构来源于胆管上皮,与胆管癌具有相同的组织起源。Guillaume[16]对13例IBCT的研究中,2例IBC中局灶性癌变均位于乳头状结构。乳头状结构可能与恶性肿瘤的起源相关,目前仍待进一步研究证实。
完整切除肿瘤是取得良好预后的关键[4, 11]。未完整切除肿瘤的患者中,80%(8/10)的患者死亡。文献报道未完整切除肿瘤患者的复发率高达59.1%,而完整切除的复发率仅为9.5%[4]。手术方式是影响患者预后的重要危险因素,手术力求完整性切除,完整性切除肿瘤的患者5年生存率可达59.7%,高于胆管癌平均20%~30%的5年生存率。如能完整切除肿瘤,解剖性切除与非解剖型切除对预后影响的差异无统计学意义(χ2=0.57,P=0.44)。IBC较少出现淋巴结转移,故无需行预防性淋巴结清扫。3例因腹膜或远处转移无法行手术切除的患者,2例合并淋巴结转移,于术后6,9月因肝功能衰竭而死亡。淋巴结转移可能与晚期肿瘤相关,出现淋巴结转移则提示肿瘤分期晚、预后差。
根据肿瘤基质类型的不同分为:卵巢基质型、无卵巢基质型。卵巢基质仅见于女性,其侵袭性低,预后好。而无卵巢基质型可见于男性或女性患者,易恶变,恶性程度高,预后差。最近研究证实卵巢基质的有无是影响IBC及IBCA预后的独立危险因素[4]。我们的研究未得出类似结论,可能与本研究仅纳入IBC有关,另外,性别与基质类型有着重要的相关关系,卵巢基质型仅出现于女性患者中,这也可能对研究结果造成一定的影响。肿瘤的生长类型是影响预后的重要危险因素(图 2C),浸润型肿瘤即使完整切除后预后仍较差,在死亡患者中,77.8%的肿瘤生长类型为浸润型,2例(序号1.2)浸润型死亡患者其术后复发时间均>3年,对浸润型患者,完整性切除后仍需密切随访。
综上所述,IBC 患者的平均发病年龄明显高于IBCA,且易好发于男性患者。术前难以根据实验室检查及影像学表现对IBC 或IBCA 做出准确的鉴别诊断。性别、手术方式、肿瘤生长类型、有无远处转移是影响患者预后的重要危险因素,完整性切除肿瘤是取得良好预后的关键,对于男性或浸润型的肿瘤患者,术后仍需密切随访。
| [1] | Tsiftsis D, Christodoulakis M, De Bree E, et al. Primary intrahepatic biliary cystadenomatous tumors[J]. J Surg Oncol,1997, 64 (4) : 341-6. DOI: 10.1002/(ISSN)1096-9098. |
| [2] | Sang X, Sun Y, Mao Y, et al. Hepatobiliary cystadenomas and cystadenocarcinomas: a report of 33 cases[J]. Liver Int,2011, 31 (9) : 1337-44. DOI: 10.1111/liv.2011.31.issue-9. |
| [3] | Wang C1, Miao R, Liu H, et al. Intrahepatic biliary cystadenoma and cystadenocarcinoma: an experience of 30 cases[J]. Dig Liver Dis,2012, 44 (5) : 426-31. DOI: 10.1016/j.dld.2011.11.007. |
| [4] | Arnaoutakis DJ, Kim Y, Pulitano C, et al. Management of biliary cystic tumors: a multi-institutional analysis of a rare liver tumor[J]. Ann Surg,2015, 261 (2) : 361-7. DOI: 10.1097/SLA.0000000000000543. |
| [5] | Delis SG, Touloumis Z, Bakoyiannis AA, et al. Intrahepatic biliary cystadenoma: a need for radical resection[J]. Eur J Gastroenterol Hepatol,2008, 20 (1) : 10-4. DOI: 10.1097/MEG.0b013e3282f16a76. |
| [6] | Vogt DP, Henderson JM, Chmielewski E. Cystadenoma and cystadenocarcinoma of the liver: a single center experience[J]. J Am Coll Surg,2005, 200 (5) : 727-33. DOI: 10.1016/j.jamcollsurg.2005.01.005. |
| [7] | Hansman MF, Ryan Jr JA, Holmes JH 4th, et al. Management and long-term follow-up of hepatic cysts[J]. Am J Surg,2001, 181 (5) : 404-10. DOI: 10.1016/S0002-9610(01)00611-0. |
| [8] | Nakajima T, Sugano I, Matsuzaki O, et al. Biliary cystadenocarcinoma of the liver. A clinicopathologic and histochemical evaluation of nine cases[J]. Cancer,1992, 69 (10) : 2426-32. DOI: 10.1002/1097-0142(19920515)69:10<>1.0.CO;2-0. |
| [9] | Seo JK, Kim SH, Lee SH, et al. Appropriate diagnosis of biliary cystic tumors: comparison with atypical hepatic simple cysts[J]. Eur J Gastroenterol Hepatol,2010, 22 (8) : 989-96. DOI: 10.1097/MEG.0b013e328337c971. |
| [10] | Devaney K, Goodman ZD, Ishak KG. Hepatobiliary cystadenoma and cystadenocarcinoma. A light microscopic and immunohistochemical study of 70 patients[J]. Am J Surg Pathol,1994, 18 (11) : 1078-91. DOI: 10.1097/00000478-199411000-00002. |
| [11] | Choi HK, Lee JK, Lee KH, et al. Differential diagnosis for intrahepatic biliary cystadenoma and hepatic simple cyst: significance of cystic fluid analysis and radiologic findings[J]. J Clin Gastroenterol,2010, 44 (4) : 289-93. DOI: 10.1097/MCG.0b013e3181b5c789. |
| [12] | Facy O, Rode A, Mabrut JY. Segment I intrahepatic biliary cystadenocarcinoma impinging on the hepatic vein[J]. J Visc Surg,2012, 149 (6) : 423-5. DOI: 10.1016/j.jviscsurg.2012.06.007. |
| [13] | Gonzalez M, Majno P, Terraz S, et al. Biliary cystadenoma revealed by obstructive jaundice[J]. Dig Liver Dis,2009, 41 (7) : e11-3. DOI: 10.1016/j.dld.2008.01.002. |
| [14] | Zhang FB, Zhang AM, Zhang ZB, et al. Preoperative differential diagnosis between intrahepatic biliary cystadenoma and cystadenocarcinoma: a single-center experience[J]. World J Gastroenterol,2014, 20 (35) : 12595-601. DOI: 10.3748/wjg.v20.i35.12595. |
| [15] | Lewin M, Mourra N, Honigman I, et al. Assessment of MRI and MRCP in diagnosis of biliary cystadenoma and cystadenocarcinoma[J]. Eur Radiol,2006, 16 (2) : 407-13. DOI: 10.1007/s00330-005-2822-x. |
| [16] | Martel G, Alsharif J, Aubin JM, et al. The management of hepatobiliary cystadenomas: lessons learned[J]. HPB (Oxford),2013, 15 (8) : 617-22. DOI: 10.1111/hpb.12026. |
 2015, Vol. 35
2015, Vol. 35
