2. 西安交通大学 先进外科技术与工程研究所, 陕西 西安 710061 ;
3. 西安交通大学 陕西省人民医院肿瘤外科, 陕西 西安 710068
2. Department of Hepatobiliary Surgery, Xi'an Jiaotong University, Xi'an 710061, China ;
3. Department of Surgical Oncology, Shaanxi Provincial People's Hospital, Xi'an 710068, China
骨髓间充质干细胞(BMSCs)是来源于骨髓的中胚层非造血多能干细胞,具有易于获取、增殖迅速、多向分化、基因转染率高、天然调节免疫功能等特点[1] 。BMSCs在特定的诱导条件下可分化为成骨细胞、心肌细胞、神经细胞、胰岛细胞以及肝细胞等[2-4] ,已成为细胞治疗、组织工程重要的种子细胞来源,也是基因治疗的理想靶细胞[5] 。
干细胞在肝损伤、肝再生、肿瘤发生的过程中地位十分重要[6] 。在一定的诱导条件下干细胞可分化为肝样细胞[7-8] ,通过细胞移植技术、组织工程技术等可在肝硬化、肝功能衰竭、代谢性肝病的治疗中发挥作用[9-11] 。这些研究为复杂肝病治疗提供了新的思路,应用前景广阔。
然而,骨髓中BMSCs含量极低,不足骨髓有核细胞总数的0.1%,且在体外扩增过程中极易老化并丧失增殖、分化潜能[1] 。如何在大量扩增的同时,保持良好的分化能力,为细胞移植及组织工程提供数量充足、活力强、生物特性均一的BMSCs,成为国内外学者研究的重点。另一方面,BMSCs肝向分化属于跨胚层定向分化,需要严格的诱导条件和多种生物因子的共同参与,操作难度大,成功率较低[12-13] ,诱导的肝样细胞仅表达肝细胞一部分的标志物和功能,且表达较低,因此,对BMSCs肝向分化诱导方案和培养条件还有待进一步研究。基于此,本实验旨在建立一套简便、可靠、稳定的大鼠BMSCs 分离、培养、鉴定及肝向分化的方法,并对BMSCs的生物学特性进行研究,为BMSCs在肝脏疾病治疗领域的研究及应用提供实验依据。
1 材料和方法 1.1 材料 1.1.1 实验动物健康4周龄雄性SD(Sprague-Dawley)大鼠,体质量100~120 g,由西安交通大学实验动物中心提供,生产许可证号:SCXK(陕)2007-001。饲养室温保持为20~25 ℃,标准饲料喂养,实验过程严格遵照国家科学技术部2006年发布的《关于善待实验动物的指导性意见》。
1.1.2 试剂及仪器DMEM/F12 培养基、DMEM培养基、L-Glutamine、青链霉素(Hyclone)、胎牛血清(Gibco)、2-磷酸-抗坏血酸、β-甘油磷酸二钠盐、丙酮酸钠、L-脯氨酸、IBMX、吲哚美辛、地塞米松、烟酰胺、制瘤素M、胰岛素-转铁蛋白-亚硒酸混悬剂ITS(Sigma)、肝细胞生长因子HGF(Peprotech)、表皮生长因子EGF、碱性成纤维细胞生长因子bFGF(Invitrogen)、胰蛋白酶(碧云天)、CD29、CD34、CD44、CD45、CD90 单克隆抗体(ebiosience)、兔抗大鼠ALB抗体(Abcam)、AFP抗体(Bioworld)、CD90 抗体(博奥森)、FITC标记山羊抗兔二抗(北京鼎国)、DAPI(Genview)。主要仪器包括:超净工作台、CO2恒温培养箱(Thermo Scientific)、倒置相差显微镜、正置荧光显微镜(Olympus)、流式细胞仪(BD)、PCR仪、凝胶成像仪(Bio-Rad)、透射电子显微镜、扫描电子显微镜(Hitachi)。
1.2 方法 1.2.1 大鼠BMSCs分离与培养本实验采用改良的全骨髓差速贴壁法分离培养BMSCs,具体方案如下。10%水合氯醛0.3 mL/100 g腹腔注射麻醉大鼠,75%酒精全身浸泡10 min以消毒,超净工作台内无菌操作迅速取其双侧股骨、胫骨,迅速剔除表面肌肉及结缔组织,采用4 ℃含3%青、链霉素的PBS液清洗3次。剪开长骨两侧干骺端,用预冷的DMEM/F12培养基反复冲洗直至骨髓腔变白,用1 mL空针反复抽吸冲洗液并轻柔吹打助其分散,100目筛网过滤,收集滤液离心900 r/min×5 min,弃上清,用含10% FBS、1%青、链霉素、4 mmol/L谷氨酰胺的DMEM/F12培养基重悬,以5×107/mL密度接种于25 cm2培养瓶中,37 ℃、5% CO2、饱和湿度的培养箱中培养。1.5 h后弃去已贴壁的成纤维细胞、巨噬细胞等成分,并重新将上层细胞悬液小心接种至新瓶,12、24 h 时分别全量换液1 次,此后每72 h 全量换液。因培养基中谷氨酰胺约2周即代谢完全,需注意及时添加。10 d左右细胞可生长至80%融合,采用0.25%胰蛋白酶37 ℃下消化1~2 min,1∶3传代以去除混杂细胞克隆群,每72 h全量换液,每日观察细胞生长情况,选择形态均一、生长良好者继续传代,第3代以后即可用于鉴定及分化实验。
1.2.2 生长曲线测绘取状态良好的P3、P5、P8代细胞,分别以5×103 /孔接种于96孔板中,每孔100 μL。采用CCK8法每日定时在酶联免疫检测仪上测定450 nm吸光度,连续7 d,根据D值分别绘制不同代BMSCs生长曲线以观察比较其增殖情况。
1.2.3 流式细胞术鉴定BMSCs表面标记本实验综合应用多种细胞表面标记物表达来证实体外分离培养细胞纯度,主要包括CD29、CD34、CD44、CD45和CD90。消化收集生长状况良好的P3代BMSCs,PBS洗涤2次后重悬,调整细胞浓度为106/mL,各取100 μL单细胞悬液分别与FITC或PE荧光标记的CD29、CD34、CD44、CD45、CD90单克隆抗体及其同型阴性对照混合,避光冰上孵育40 min,PBS液洗涤3次以除去未结合抗体,用500 μL PBS液重悬后采用流式细胞仪进行检测分析。
1.2.4 BMSCs体外分化能力检测取P3~5代生长状态良好的细胞,分别行体外成脂、成骨、软骨定向诱导分化,以评估其多向分化潜能。按3~5×105/mL密度均匀接种至6孔板内,细胞生长融合达70%左右时开始添加诱导液。诱导液配方如下:①成脂诱导液:DMEM+10% FBS+1%双抗+0.1 mmol/L吲哚美辛+0.5 mmol/LIBMX+10 μg/mL胰岛素+ 1μmol/L地塞米松;②成骨诱导液:DMEM+10% FBS+1%双抗+10 mmol/L β-甘油磷酸钠+50 μmol/L 2-磷酸-L-抗坏血酸钠+1 μmol/L地塞米松;③软骨诱导液:DMEM+10% FBS+1%双抗+100 μg/mL丙酮酸钠+40 μg/mL脯氨酸+50 μg/mL ITS混悬剂+0.1 μmol/L地塞米松。每周2次换液,2周后行油红O染色检测成脂分化能力,行茜素红染色检测成骨分化能力,3周后行甲苯胺蓝染色检测软骨分化能力。
1.2.5 BMSCs体外诱导肝向分化取P3~5代生长状态良好的BMSCs细胞,以3~5×104/mL密度接种于多聚赖氨酸包被的细胞培养板内,24 h后按如下流程依次添加培养基以诱导干细胞分化为肝样细胞。①无血清培养基:DMEM+1%双抗+20 ng/mL EGF+10 ng/mL bFGF,培养2 d;②分化培养基:DMEM/F12+10% FBS+1%双抗+10 ng/mL bFGF+0.61 mg/mL 烟酰胺+20 ng/mLHGF,培养7 d,每3 d换液;③成熟培养基:DMEM/F12+10% FBS+1%双抗+20 ng/mL制瘤素M+1 μmol/L地塞米松+50 μg/mL ITS混悬剂,培养14 d,每3 d换液。
收集诱导分化的细胞,通过倒置相差显微镜、扫描电子显微镜、透射电子显微镜进行细胞形态学变化的观察。行免疫荧光染色法检测相关细胞标志物CD90、ALB、AFP的表达。Trizol法提取细胞RNA,采用RT-PCR法检测内胚层及肝系相关基因ALB、Hnf1a、Cyp1a2、G6pc、A1AT、AFP mRNA的细胞内表达情况。扩增条件:95 ℃变性5 min;进入40个扩增循环:95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸35 s;72 ℃ 5 min,12 ℃持续。引物序列及产物长度如表 1所示。
| 表 1 RT-PCR所用扩增引物序列及产物长度 Table 1 Sequence of the primers and length of the products |
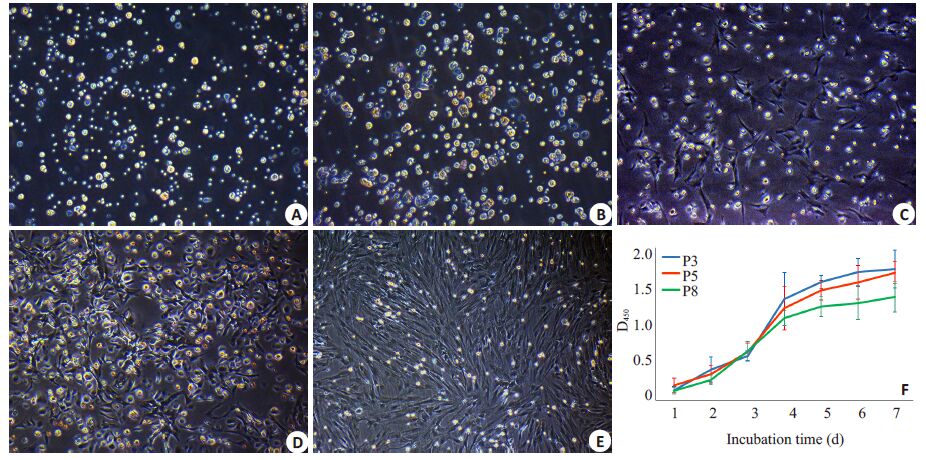
刚接种于培养瓶中的BMSCs大多悬浮于培养液中,细胞呈圆形,大小不均一(图 1A)。24 h后可见大量贴壁细胞呈不规则圆形,换液去除未贴壁细胞(图 1B);48 h后贴壁细胞逐渐铺展开,呈多角形,大小不一,排列不规则;72 h后可见部分小梭形细胞,细胞增殖迅速(图 1C)。培养至第7天,贴壁梭形细胞明显增多,呈现克隆样生长,少数细胞呈“鹅卵石”样,为混杂的造血细胞等(图 1D)。第10天时细胞可增殖至80%融合,按1∶3传代。传代细胞较原代细胞增殖迅速,形态渐趋均一,5 d左右即可达80%融合再次传代。传至P3代,绝大多数细胞均呈梭形、旋涡状生长,沿胞体长轴排列规则紧致,集落中心细胞密集,各集落可有重叠,集落间大小、细胞疏密、排列方式不尽相同(图 1E)。传至P8代,细胞增殖能力稍有下降,形态未见明显变化。
|
图 1 骨髓间充质干细胞形态学鉴定及生长曲线测绘 Figure 1 Morphological identification and proliferative activity of BMSCs (Original magnification: ×100). A: Spherical morphologyand uneven sizes of the bone marrow cells at day 0; B: Irregular round adherent cells at day 1; C,D: The number of the spindlecells gradually increased and formed clones on days 3-7; E: A homogeneous population of BMSCs in passage 3; F: Comparison ofgrowth curves of BMSCs in passages 3,5 and 8 |
CCK-8法测定培养P3、P5、P8代细胞增殖情况,并绘制生长曲线进行比较可见,各代细胞在传代后增殖稳定,生长曲线基本呈S形,呈现典型的潜伏期(1~2 d)、对数生长期(3~5 d)、平台期(6~7 d)。P3、P5代细胞增值能力基本一致,P8代细胞增殖能力较前两者稍有下降,但差异无统计学意义(P>0.05,图 1F)。
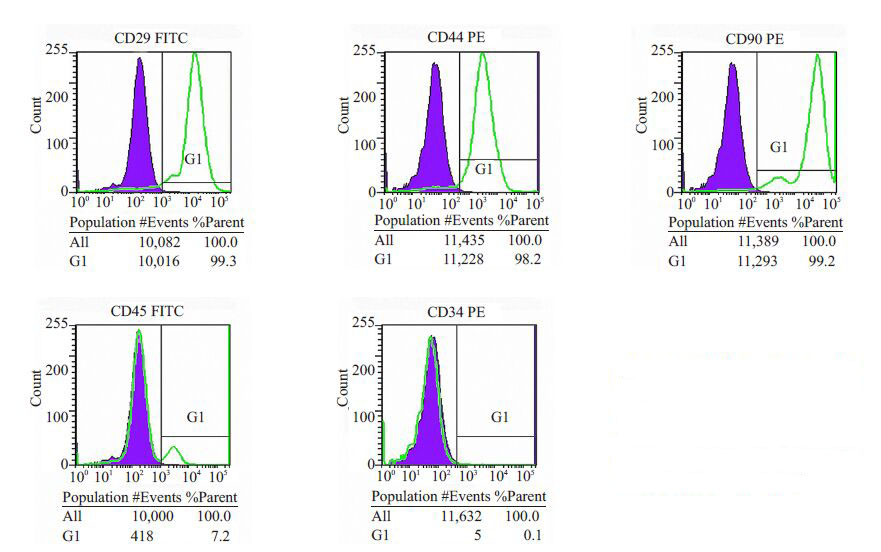
2.2 大鼠BMSCs细胞表面标志物流式分析流式细胞技术检测第3代BMSCs表面标记物的表达特征,结果显示:细胞较均一高表达CD29、CD44、CD90,其阳性率分别为99.3%、98.2%、99.2%,而CD34、CD45则呈阴性表达,分别为7.2%、0.1%(图 2)。检测结果符合细胞纯化鉴定要求。
|
图 2 流式细胞仪检测第3代大鼠骨髓间充质干细胞表面标记物的表达 Figure 2 Surface antigens onpassage 3 BMSCs from SD ratsassayed by flow cytometry |
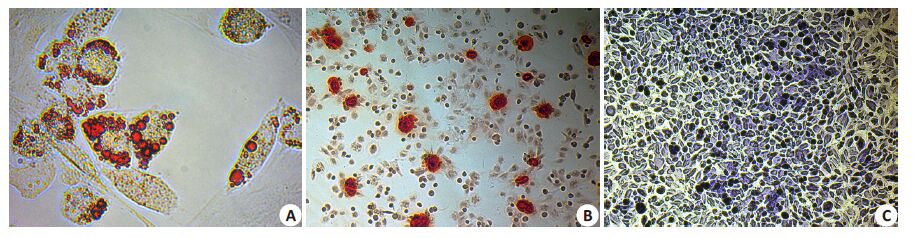
第3代BMSCs经过成脂诱导14 d后,细胞由长梭形逐渐变为圆形、多边形,细胞内部有大量圆形脂滴形成并逐渐增多,并有相互融合趋势,油红O染色可见密集红色脂滴(图 3A)。BMSCs经成骨诱导剂培养14 d后,胞质内颗粒明显增多,细胞呈集落样生长,细胞间可见钙质沉积,结节中心的细胞层叠融合并失去细胞结构,经茜素红染色呈红色致密结节(图 3B)。BMSCs经成软骨细胞诱导剂培养21 d后,体积轻度膨大,形态逐渐由小梭形变为方形、三角形和多角形等,经甲苯胺蓝染色可见,部分细胞呈半透明的软骨细胞形态,质少核小,细胞外有大量蓝色异染性基质(图 3C)。
|
图 3 大鼠BMSCs多向分化能力鉴定 Figure 3 Induced differentiation of bone marrow mesenchymal stem cells into multiple lineages. A: Adipogenic induction at day 14using Oil red O staining (Original magnification: × 400); B: Osteogenous induction at day 14 using alizarin red calcificationnodule staining (Original magnification: × 100); C: Chondrogenic induction at day 21 using toluidine blue staining (Originalmagnification: ×100). |
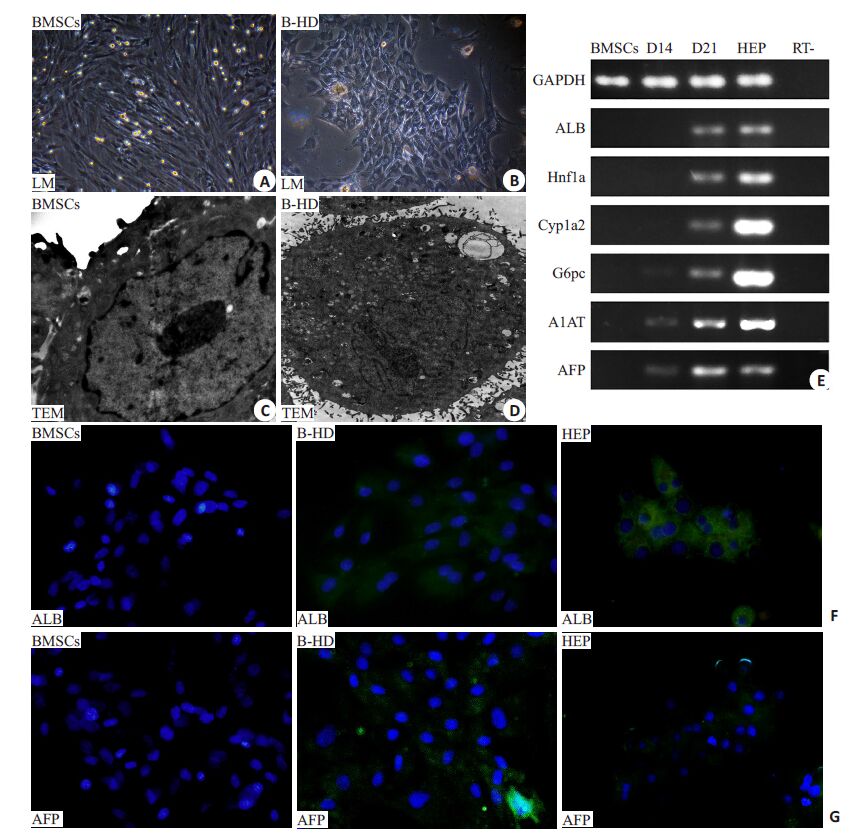
采用添加生长因子的肝系分化液诱导大鼠BMSCs分化,第3天可见细胞增殖明显变缓,细胞原本均一的长梭形形态开始发生变化。至第14天,大多数细胞已失去原有形态,变为多边形、类圆形,贴壁能力减弱,局部有群聚现象。第21天时,细胞进一步变为类似肝细胞的立方形,呈铺路石样外观(图 4A、B)。透射电子显微镜(TEM)观察,BMSCs未诱导前核浆比高,胞质内呈混沌状态,未见成熟细胞器(图 4C);经过肝向诱导,核浆比明显变小,细胞内富集的多种细胞器结构清晰可见,包括线粒体、高尔基体、粗面及滑面内质网、以及少许糖原颗粒(图 4D)。
大鼠BMSCs经过连续诱导分化,内胚层及肝系相关基因表达发生明显改变。RT-PCR结果显示,肝脏特异性合成蛋白ALB和AFP的mRNA水平出现时间依赖性逐步升高,肝细胞内高表达的转录因子Hnf1a、肝脏特异性功能基因和代谢酶基因Cyp1a2、G6pc、A1AT的表达亦随诱导分化时间的延长显著上升(图 4E)。免疫荧光染色法检测ALB(成熟肝细胞标志物)、AFP(肝细胞分化过程中的标志物)在细胞内的表达情况,结果显示,经肝系诱导分化的BMSCs出现ALB阳性表达绿色荧光,但较肝细胞仍弱(图 4E);AFP染色亦呈阳性,强于正常肝细胞内表达(图 4F)。
|
图 4 大鼠BMSCs肝向分化的形态学、免疫学及基因水平检测 Figure 4 Morphological changes,immunofluorescence analysis,and gene expression profile of BMSCs after induceddifferentiation into hepatocyte-like cells. A,B: Morphology of the P3 undifferentiated BMSCs and cells inducedfor hepatic differentiation (B-HD) at day 21 by sequential addition of the conditioned media (Originalmagnification: × 100); C,D: Ultrastructural characteristics of undifferentiated BMSCs and differentiatedhepatocyte-like cells observed using transmission electron microscopy (Original magnification: × 10 000); E:RT-PCR analysis of liver-specific gene (ALB,Hnf1a,Cyp1a2,G6pc,A1AT,and AFP) expression in BMSC-derivedhepatocyte-like cells induced with the conditioned media. The undifferentiated BMSCs and primary hepatocytes(HEP) were used as controls; F,G: Cellular protein expressions (ALB and AFP) in BMSCs,B-HD and hepatocytesanalyzed using immunofluorescence staining (Original magnification: ×200). |
自Friedenstein 等[14] 于上世纪60 年代首次在骨髓中发现BMSCs以来,诸多研究表明,其作为一种成体干细胞,具有广泛地可塑性,可在不同的诱导条件下完成向全部3个胚层的分化;BMSCs可逃过免疫系统监视,可以在主要组织相容性复合体不匹配的同种异体间进行移植;同时又不受法律、伦理争议的制约,易于开展临床应用,这些优势使其成为热门的组织工程和细胞移植种子细胞。啮齿类动物的BMSCs被广泛应用于临床前实验室研究,但其分离、体外扩增、纯化及鉴定都尚缺乏严格统一的标准,因此建立一套简便、可靠、稳定的大鼠BMSCs分离、体外培养及细胞鉴定方法,显得尤为重要。
目前主要的分离获取BMSCs的方法主要有4种[15-17] :全骨髓差速贴壁法、密度梯度离心法、流式细胞仪分选法、免疫磁珠分离法。后两者因易伤细胞、造成污染、增殖缓慢,以及操作复杂、代价昂贵等缺点,并不常用。全骨髓差速贴壁法是根据BMSCs与其他骨髓细胞贴壁时间不同而对其进行体外分离纯化的方法,前者贴壁快、生长迅速,后者因不贴壁而死亡或贴壁缓慢在换液时被除去。密度梯度离心法是利用BMSCs与其他细胞密度不同的特点,用特定密度的细胞分离液将BMSCs分离出来,但此方法易损失BMSCs,且其在传3代后纯度与全骨髓差速贴壁法比较并无显著区别。
本实验即在全骨髓差速贴壁法的基础上进行优化,可快速获得纯度较高的BMSCs。传统的全骨髓贴壁法所筛选的原代细胞中除了BMSCs之外,尚混杂有成纤维细胞、巨噬细胞、单核细胞、造血细胞、红细胞等杂质,其中最易贴壁的是巨噬细胞和成纤维细胞,贴壁性差的是肥大细胞、脂肪细胞、造血细胞等,BMSCs居中,约在接种4~6 h左右贴壁。因此,本实验在1.5 h后收集未贴壁的细胞悬液重新接种,即可减少巨噬细胞和成纤维细胞混杂。接种后12、24 h早期各换液1次,有助于除去原悬液中的大量红细胞、造血干细胞、细胞组织碎片、代谢产物等,既有利于细胞的纯化,又可减少混杂细胞分泌的因子及代谢产物对BMSCs的不利影响。实验结果表明,通过这一方法的优化,在P3代即可高效获得形态均一、增殖迅速、性状稳定的BMSCs用于分化实验,且操作过程简便、实用,减少了频繁传代对细胞的损伤和污染机会,为其作为组织工程种子细胞提供了方便。
由于BMSCs缺乏特异性细胞表面标志物[18] ,对其纯度鉴定常结合多种方法,主要包括:细胞形态及增殖能力、细胞表面标记物表达[19-21] 、多向分化潜能检测等。综合应用上述方法来证实体外分离培养细胞为BMSCs。本实验方法所得的细胞群具有典型的旋涡状生长梭形细胞形态,贴壁及增殖能力与BMSCs基本一致。流式细胞术证实,P3代细胞群高阳性表达BMSCs表面标志物,即整合素家族成员CD29、黏附分子CD44和CD90,阴性表达造血前体细胞标志抗原CD34、白细胞标志抗原CD45,纯度满足实验要求。在成脂、成骨、成软骨诱导条件下,P3代BMSCs分别表现出脂肪细胞、成骨和软骨细胞的表型特征,进一步反证了体外分离培养的细胞为BMSCs,具有良好的多向分化潜能。
根据CCK-8实验绘制的生长曲线,BMSCs 在P3、P5、P8代均经历了典型的潜伏期、对数生长期、平台期,3者增值能力无显著差异。但P8代细胞的增殖能力已出现下降的趋势,我们仍建议采用P3~P5代活力更强的细胞用于诱导分化实验。
生长微环境是诱导干细胞分化的最重要因素,常用的干预手段包括:培养基中添加生长因子;目的细胞的基因转染;目的细胞与干细胞共培养。对于BMSCs向肝系细胞诱导的实验研究,多采用影响肝脏生长发育的细胞因子来模拟肝细胞的生长微环境进行诱导分化[7, 9, 22-23] 。本实验亦运用此类方案来诱导BMSCs向肝系细胞分化。诱导分化培养基中含有多种在肝细胞分化过程中起到重要作用的细胞因子,主要包括:EGF、bFGF、烟酰胺、HGF、制瘤素M等[12, 24-25] 。其中EGF主要促进干细胞上皮化。bFGF是一种毛细血管增殖刺激剂,具有广泛的生物活性,能够调控内胚层细胞向肝细胞转化的发生,是早期肝脏形成的重要因子,在肝脏损伤后的再生过程中亦起到重要作用。制瘤素M是白介素-6家族的细胞因子,有文献表明其与糖皮质激素共存时可促进肝细胞成熟。HGF是作用于肝脏发育及再生过程的最基本因子,有报道称BMSCs可表达HGF受体C-met,启动跨膜信号转导通路,通过Notch信号通路参与BMSCs肝向分化过程,对肝脏发育、成熟、肝损伤后的再生起到十分重要的作用[7, 13, 26-27] 。在本诱导方案中,血清饥饿诱导液作用于BMSCs可使其增殖过程停滞,是预分化的适应过程;分化培养基培养7 d可全面启动BMSCs肝向分化过程,RT-PCR和免疫荧光染色结果证实,多种肝细胞特异性基因被激活,肝细胞标志物和功能逐渐开始表达;继而经过成熟培养基的进一步作用14 d,诱导的肝样细胞渐趋成熟,细胞形态近似肝细胞,胞质内各种细胞器成熟,并发挥旺盛的代谢功能,mRNA水平及肝细胞标志物ALB、AFP表达亦呈时间依赖性显著上升,接近或达到正常肝细胞水平。
总之,本实验建立了一种简便而稳定的大鼠BMSCs分离、体外培养、肝向分化的技术方案,初步证实了利用大鼠BMSCs作为肝脏组织工程种子细胞的可行性,为后续BMSCs用于肝脏疾病治疗的临床应用提供了实验依据。
| [1] | Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature,2002, 418 (6893) : 41-9. DOI: 10.1038/nature00870. |
| [2] | Lee HS, Huang GT, Chiang H, et al. Multipotential mesenchymal stem cells from femoral bone marrow near the site of osteonecrosis[J]. Stem Cells,2003, 21 (2) : 190-9. DOI: 10.1634/stemcells.21-2-190. |
| [3] | Fisher M, Hyzy S, Guldberg RE, et al. Regeneration of bone marrow after tibial ablation in immunocompromised rats is age dependent[J]. Bone,2010, 46 (2) : 396-401. DOI: 10.1016/j.bone.2009.09.029. |
| [4] | Quintavalla J, Uziel FS, Yin J, et al. Fluorescently labeled mesenchymal stem cells(MSCs)maintain multilineage potential and can be detected following implantation into articular cartilage defects[J]. Biomaterials,2002, 23 (1) : 109-19. DOI: 10.1016/S0142-9612(01)00086-2. |
| [5] | Van Damme A, Vanden Driessche T, Collen D, et al. Bone marrow stromal cells as targets for gene therapy[J]. Curr Gene Ther,2002, 2 (2) : 195-209. DOI: 10.2174/1566523024605645. |
| [6] | Soto-Gutierrez A, Navarro-Alvarez N, Yagi H, et al. Stem cells for liver repopulation[J]. Curr Opin Organ Transplant,2009, 14 (6) : 667-73. DOI: 10.1097/MOT.0b013e3283328070. |
| [7] | Lee KD, Kuo TK, Whang-Peng J, et al. In vitro hepatic differentiation of human mesenchymal stem cells[J]. Hepatology,2004, 40 (6) : 1275-84. DOI: 10.1002/(ISSN)1527-3350. |
| [8] | Sgodda M, Aurich H, Kleist S, et al. Hepatocyte differentiation of mesenchymal stem cells from rat peritoneal adipose tissue in vitro and in vivo[J]. Exp Cell Res,2007, 313 (13) : 2875-86. DOI: 10.1016/j.yexcr.2007.05.020. |
| [9] | Ji R, Zhang N, You N, et al. The differentiation of MSCs into functional hepatocyte-like cells in a liver biomatrix scaffold and their transplantation into liver-fibrotic mice[J]. Biomaterials,2012, 33 (35) : 8995-9008. DOI: 10.1016/j.biomaterials.2012.08.058. |
| [10] | Sun J, Yuan Y, Qin H, et al. Serum from hepatectomized rats induces the differentiation of adipose tissue mesenchymal stem cells into hepatocyte-like cells and upregulates the expression of hepatocyte growth factor and interleukin-6 in vitro[J]. Int J Mol Med,2013, 31 (3) : 667-75. |
| [11] | Navarro-Alvarez N, Soto-Gutierrez A, Kobayashi N. Stem cell research and therapy for liver disease[J]. Curr Stem Cell Res Ther,2009, 4 (2) : 141-6. DOI: 10.2174/157488809788167418. |
| [12] | Aurich H, Sgodda M, Kaltwasser P, et al. Hepatocyte differentiation of mesenchymal stem cells from human adipose tissue in vitro promotes hepatic integration in vivo[J]. Gut,2009, 58 (4) : 570-81. DOI: 10.1136/gut.2008.154880. |
| [13] | Chivu M, Dima SO, Stancu CI, et al. In vitro hepatic differentiation of human bone marrow mesenchymal stem cells under differential exposure to liver-specific factors[J]. Transl Res,2009, 154 (3) : 122-32. DOI: 10.1016/j.trsl.2009.05.007. |
| [14] | Friedenstein AJ, Piatetzky S. II, Petrakova KV. Osteogenesis in transplants of bone marrow cells[J]. J Embryol Exp Morphol,1966, 16 (3) : 381-90. |
| [15] | Matsubara T, Tsutsumi S, Pan H, et al. A new technique to expand human mesenchymal stem cells using basement membrane extracellular matrix[J]. Biochem Biophys Res Commun,2004, 313 (3) : 503-8. DOI: 10.1016/j.bbrc.2003.11.143. |
| [16] | Block GD, Locker J, Bowen WC, et al. Population expansion, clonal growth, and specific differentiation patterns in primary cultures of hepatocytesinduced by HGF/SF, EGF and TGF alpha in a chemically defined (HGM) medium[J]. J Cell Biol,1996, 132 (6) : 1133-49. DOI: 10.1083/jcb.132.6.1133. |
| [17] | Tropel P, No?l D, Platet N, et al. Isolation and characterisation of mesenchymal stem cells from adult mouse bone marrow[J]. Exp Cell Res,2004, 295 (2) : 395-406. DOI: 10.1016/j.yexcr.2003.12.030. |
| [18] | Ishii M, Koike C, Igarashi A, et al. Molecular markers distinguish bone marrow mesenchymal stem cells from fibroblasts[J]. Biochem Biophys Res Commun,2005, 332 (1) : 297-303. DOI: 10.1016/j.bbrc.2005.04.118. |
| [19] | Carvalho AD, Garcia Alves AL, Golim MA, et al. Isolation and immunophenotypic characterization of mesenchymal stem cells derived from equine species adipose tissue[J]. Vet Immunol Immunopathol,2009, 132 (2/4) : 303-6. |
| [20] | Belluzzi A, Lanzoni G, Roda G, et al. Mesenchymal stem cells from the gastrointestinal stroma in inflammatory bowel disease (IBD) and colon cancer: Isolation, in vitro expansion and characterization[J]. Gastroenterology,2007, 132 (4, 2) : A553-4. |
| [21] | Jones EA, English A, Kinsey SE, et al. Optimization of a flow cytometry-based protocol for detection and phenotypic characterization of multipotent mesenchymal stromal cells from human bone marrow[J]. Cytometry B Clin Cytom,2006, 70B (6) : 391-9. DOI: 10.1002/(ISSN)1552-4957. |
| [22] | He H, Liu X, Peng L, et al. Promotion of hepatic differentiation of bone marrow mesenchymal stem cells on decellularized celldepositedextracellular matrix[J]. Biomed Res Int,2013 : 406871. |
| [23] | Vater C, Kasten P, Stiehler M. Culture media for the differentiation of mesenchymal stromal cells[J]. Acta Biomater,2011, 7 (2) : 463-77. DOI: 10.1016/j.actbio.2010.07.037. |
| [24] | Wang PP, Wang JH, Yan ZP, et al. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction[J]. Biochem Biophys Res Commun,2004, 320 (3) : 712-6. DOI: 10.1016/j.bbrc.2004.05.213. |
| [25] | Xie JM, Chen JF, Gao Y, et al. Hepatocyte growth factor and fibroblast growth factor-4-induced differentiation of human bone marrow mesenchymal stem cells into hepatocyte-like cells in vitro[J]. J Southern Med Univ,2006, 26 (10) : 1439-42. |
| [26] | Christ B, Dollinger MM. The Generation of hepatocytes from mesenchymal stem cells and engraftment into the liver[J]. Curr Opin Organ Transplant,2011, 16 (1) : 69-75. DOI: 10.1097/MOT.0b013e3283424f5b. |
| [27] | Kang XQ, Zang WJ, Song TS, et al. Rat bone marrow mesenchymal stem cells differentiate into hepatocytes in vitro[J]. World J Gastroenterol,2005, 11 (22) : 3479-84. DOI: 10.3748/wjg.v11.i22.3479. |
 2015, Vol. 35
2015, Vol. 35
