细菌性脑膜炎是中枢神经系统中最常见、最严重的感染,尤其对于免疫系统尚不完善的新生儿,其发病率和病死率都较高[1-2]。随着广谱抗生素的广泛应用,细菌耐药现象越来越普遍,致使新生儿尤其是低出生体质量、极低出生体质量儿的细菌性脑膜炎病死率逐渐增高,补充和替代抗生素治疗的药物和方法研究也越来越受到关注。将益生菌应用于早期新生儿脑膜炎的预防,可克服广谱抗生素的诸多缺点。研究证明益生菌LGG能显著抑制大肠埃希菌K1(E. coli K1)株在新生大鼠肠道黏附与入侵,从而显著降低菌血症与脑膜炎的发生率[3]。但是益生菌是否能够抑制阪崎克罗诺杆菌黏附与入侵,从而降低菌血症与脑膜炎发生率,目前仍不清楚。
鼠李糖乳杆菌(LGG)从属于乳杆菌属,为革兰阳性厌氧菌,无质粒,不能利用乳糖,但可代谢单糖,是从健康人肠道分离出的1株乳杆菌,是研究最广泛的益生菌之一。它能生活在胃肠道,且黏着率高,定植能力强,并具有高效降胆固醇、促进细胞分裂、调节和平衡肠道菌群功能[4],加强对感染的自然防御,对改善多种肠道疾病有积极作用。
阪崎克罗诺杆菌是近年新发现的一种致病菌[5],能引起严重的新生儿脑膜炎、小肠结肠炎和菌血症[6-7],死亡率高达40%~80%[8]。本实验主要研究益生菌LGG能否抑制阪崎克罗诺杆菌黏附和侵袭小肠上皮细胞(Caco-2),减少其穿越血脑屏障的量,从而预防和治疗阪崎克罗诺杆菌引起的小肠结肠炎和脑膜炎。
1 材料与方法 1.1 材料 1.1.1 细胞和菌株结肠腺癌细胞Caco-2由南方医科大学微生物学系保存。阪崎克罗诺杆菌ATCC29544购自ATCC标准珠,LGG由美国加州大学黄胜和教授赠送,大肠杆菌E44和DH5α由南方医科大学微生物学系保存。
1.1.2 培养基MRS培养基、BHI培养基、LB培养基,购自广东环凯微生物科技有限公司。Gbico胎牛血清购自广州鼎国生物科技有限公司。羊血购自广州未来生物科技有限公司。
1.1.3 实验动物SD大鼠窝鼠2~3 d龄8窝,80只,精神状态良好,购自南方医科大学实验动物中心。
1.2 方法 1.2.1 体外细胞模型黏附及侵袭实验体外黏附侵袭实验参考文献[1-2]进行,即细菌接种物用不含抗生素的培养基重悬,以每孔1×107 CFU的细菌量加入培养有Caco-2 细胞的24 孔板内(使细胞感染倍数为100),在37 ℃,5% CO2培养箱中共孵育90 min。为计算黏附细胞的细菌数,细胞用培养基洗3 次,加入100 μL 0.5%Triton X-100裂解细胞(此浓度Triton X-100在0.5 h之内不会影响细菌活性),孵育8 min后,立即加入50 μL蒸馏水。在溶解细胞之前的孵育和清洗阶段,单层细胞都要保持完整。反复吹打后吸出样品,做梯度稀释(10-1~10-4)后涂羊血平板计数菌落数。黏附率=胞内外细菌数/孵育细菌数×100%,重复3次取平均值。
对于侵袭实验,以每孔1×107CFU的细菌量加入培养有Caco-2细胞的24孔板内(使细胞感染倍数为100),在37 ℃,5% CO2培养箱中共孵育90 min。用培养基洗3次,再用含有100 μg/mL庆大霉素的培养基孵育1 h,以杀死细胞外的细菌。用培养基洗3 次,加入100 μL0.5% Triton X-100,8 min 后,立即加入50 μL蒸馏水,溶解细胞。反复吹打,吸出样品做梯度稀释(10-1~10-4)后,涂羊血平板计数菌落数。侵袭率=胞内细菌数/孵育细菌数×100%,或者相对侵袭率,重复3次取平均值。
黏附侵袭实验中,阪崎克罗诺杆菌ATCC29544 为实验菌,大肠杆菌E44为阳性对照菌,DH5a为阴性对照菌。
1.2.2 LGG对阪崎克罗诺杆菌黏附侵袭的抑制实验 1.2.2.1 阪崎克罗诺杆菌对Caco-2 细胞的黏附侵袭ATCC29544与Caco-2细胞分别共孵育1、3、5 h后取样梯度稀释,涂布羊血平板计数,确定最佳黏附侵袭时间。
1.2.2.2 LGG 对Caco-2 细胞的黏附分别用106、107、108、109 CFU不同浓度细菌量的LGG与Caco-2细胞共孵育3 h,取样梯度稀释,涂布MRS平板计数。
1.2.2.3 LGG对阪崎克罗诺杆菌的抑制作用分别用106、107、108 CFU 不同浓度细菌量的LGG与Caco-2细胞共孵育1 h,然后加入致病菌ATCC 29544孵育2 h,取样梯度稀释,涂布羊血平板计数。
1.2.2.4 LGG对阪崎克罗诺杆菌的竞争排斥置换作用本实验分为4 个组,分别为对照组和实验组,对照组:Caco-2+ATCC 29544共孵育3 h。实验组分为3个不同处理组。竞争组:Caco-2+ATCC 29544+LGG 共孵育3 h;置换组:Caco-2+ATCC 29544 共孵育1 h,再加LGG,继续孵育2 h;排斥组:Caco-2+LGG 共孵育1 h,再加ATCC 29544,继续孵育2 h。具体操作同上,涂布羊血平板计数,计算侵袭率,侵袭率=胞内细菌数/孵育细菌数×100%。
1.2.3 动物体内检测LGG对阪崎克罗诺杆菌黏附侵袭的抑制作用本部分分别设计预防和治疗实验,检测LGG在体内对阪崎克罗诺杆菌ATCC 29544的抑制效果,具体分组见表 1。
| 表 1 动物实验分组及处理方法 Table 1 Grouping and treatment of the neonatal rats(n=20) |
本研究经SPSS 13.0软件进行统计学处理,黏附率两组的比较采用t检验方法,黏附率或侵袭率多组间比较采用方差分析,计数以百分率表示,以P<0.05为差异有统计学意义。
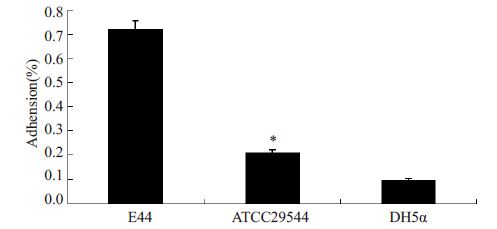
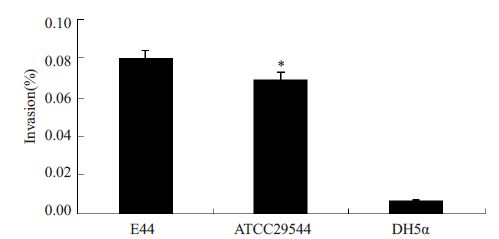
2 结果 2.1 阪崎克罗诺杆菌对Caco-2细胞的黏附侵袭在培养好的Caco-2 细胞中分别加入E44、ATCC29544和DH5α,细菌黏附90 min后涂板计数,结果显示阪崎克罗诺杆菌黏附率为0.2%,比阳性对照组E44 小(P=0.000),比阴性对照组DH5α大(P=0.000,图 1)。侵袭实验待细菌黏附3 h后,加入庆大霉素处理,结果显示其侵袭作用较显著,侵袭率达0.07%(P=0.02),显著高于阴性对照组(P=0.000,图 2)。
|
图 1 ATCC 29544对Caco-2黏附率 Figure 1 Adhesion rate of ATCC29544 to Caco-2 cells. *P=0.000. |
|
图 2 ATCC 29544对Caco-2侵袭率 Figure 2 Invasion rate of ATCC29544 in Caco-2 cells. *P=0.000. |
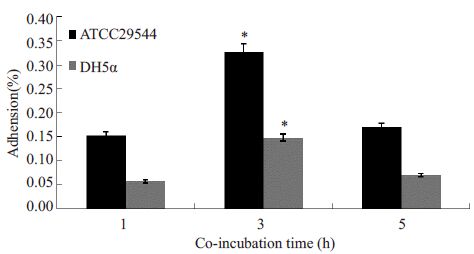
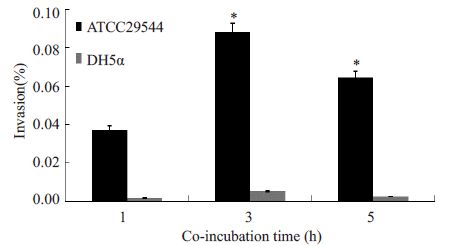
分别用阪崎克罗诺杆菌与Caco-2细胞共孵育1、3和5 h,取各时间点细菌涂板计数,结果显示ATCC29544在感染细胞3 h后对细胞的黏附性和侵袭性最大(P=0.000,图 3,4)。
|
图 3 ATCC 29544对Caco-2黏附共孵育时间 Figure 3 Adhesion co-incubation time of ATCC29544 withCaco-2 cells. *P=0.000. |
|
图 4 ATCC 29544对Caco-2侵袭共孵育时间 Figure 4 Adhesion co-incubation time of ATCC29544 withCaco-2 cells. *P=0.000. |
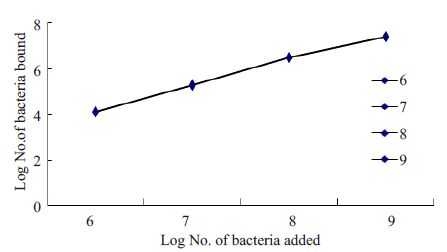
采用不同浓度的LGG黏附Caco-2细胞,结果表明LGG对Caco-2细胞具有黏附性,并且黏附率随着LGG浓度的升高而增加(图 5)。
|
图 5 不同浓度LGG对Caco-2细胞的黏附 Figure 5 Adhesion of different concentrations of LGG toCaco-2 cells. |
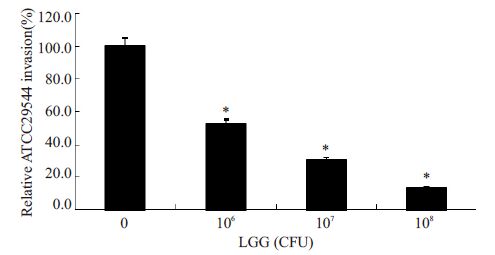
分别用106、107、108 CFU浓度的益生菌LGG与Caco-2 细胞共孵育1 h,然后加入致病菌ATCC29544孵育2 h,庆大霉素处理1 h,涂板计数,结果显示随着LGG菌浓度的增加,阪崎克罗诺杆菌的相对侵袭率明显下降,说明侵入到Caco-2细胞中的致病菌明显减少,抑制作用显著(P=0.000,图 6)。
|
图 6 不同浓度的LGG 抑制ATCC29544对Caco-2细胞的相对侵袭率 Figure 6 Relative invasion rate of ATCC29544 co-incubated withdifferent concentrations of LGG in Caco-2 cells. *P=0.000. |
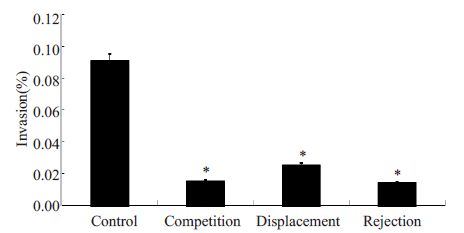
共孵育分别采用竞争、排斥、置换方式,见图 7,结果显示:细胞中加入LGG后,克罗诺杆菌侵袭率显著降低(P=0.000),且竞争和排斥组抑制作用比置换组更明显,统计学具有显著差异,表明益生菌LGG体外可抑制ATCC29544对Caco-2细胞的侵袭。
|
图 7 LGG抑制ATCC29544侵袭的最佳方式 Figure 7 Mechanisms of LGG to inhibit invasion of ATCC29544.*P=0.000. |
通过LGG对乳鼠的预防和治疗实验,结果显示:血液中均无LGG,表明使用LGG后,不会引起益生菌性菌血症;血液中对照组100%检测到ATCC 29544,而预防实验组检测率为60%,治疗实验组检测率为70%;脑脊液检测结果,对照组检测率为70%(预防)和75%(治疗),而实验组为0%(预防)和5%(治疗)。实验组检测到脑膜炎的小鼠数量明显少于对照组,说明LGG在体内可抑制阪崎克罗诺杆菌穿越肠屏障,从而减少进入血脑屏障的细菌数量,用LGG预防和治疗乳鼠阪崎克罗诺杆菌致脑膜炎具有一定效果(表 2)。
| 表 2 LGG对乳鼠ATCC29544致脑膜炎的预防及治疗效果 Table 2 Preventive and therapeutic effect of LGG on ATCC29544-induced meningitis in neonatal rats(n=20) |
黏附是微生物与宿主肠道相互作用的第一步,也是进入肠道的微生物发挥作用的前提。黏附和定植于宿主肠道的能力是益生菌的评价标准之一,益生菌株必须对上皮细胞组织具有黏附性才能长期在肠道中存活并发挥其作用。黏附在肠道的益生菌可以通过空间占位,产生抑菌物质等对肠道病原菌发挥抑制作用,调整肠道菌群平衡[9-10]。同时,黏附也是感染性细菌致病的第l步,如果能抑制病原菌对宿主细胞的黏附,往往能抑制病原菌的致病作用。因此,将益生菌的黏附性能及其对致病菌的黏附抑制作用作为菌株质量评定的重要指标[11-13]。
目前,国内外有关乳酸菌对细胞的黏附及其对病原菌的黏附抑制作用的研究报道较多,并且发现一些有较好黏附性能的益生乳酸菌[14-15],但是关于益生菌LGG对肠上皮细胞的黏附来抑制阪崎克罗诺杆菌的报道较少。肠上皮样细胞系Caco-2细胞是从人结肠腺癌中建立的,是目前研究细菌或病毒与肠道黏膜黏附应用最广泛的细胞模型。该细胞模型能够在体外进行形态功能分化,表现出成熟肠上皮细胞的特性[16]。因此,本试验采用目前国内外学者普遍使用的体外培养Caco-2细胞的方法来评价LGG的黏附能力及其对阪崎克罗诺杆菌的黏附抑制作用,并通过设置竞争排斥置换实验,确定LGG抑制阪崎克罗诺杆菌侵袭主要通过竞争和排斥方式,为乳酸菌更好地应用于生产及探讨其黏附机制提供初步的理论依据。竞争排斥置换实验是根据两种或者两种以上细菌不能同时或者长时间在同一个生态位生存,使两者之间展开竞争,导致其中的一方获胜,可以留在原来的生态龛位继续生存[17]。结果显示当益生菌存在时,它能优先占据有利位置或者分泌某种物质,从而抑制致病菌对机体的黏附和侵袭。
阪崎克罗诺杆菌是乳制品中近年新发现的一种致病菌,能引起严重的新生儿脑膜炎、小肠结肠炎和菌血症,其死亡率极高。引起新生儿脑膜炎致病机制要穿透肠屏障入血造成菌血症才能上行穿过血脑屏障[18]。Huang等[1, 19]人研究已证实,LGG与肠上皮细胞共同孵育,可以阻断E. coli K1 株的黏附、侵袭以及跨细胞作用,且呈剂量依赖性。在此研究基础上,本研究通过Caco-2细胞和乳鼠模型进行体内外实验展开LGG对阪崎克罗诺杆菌黏附侵袭Caco-2的研究,观察益生菌如何抑制阪崎克罗诺杆菌ATCC29544的黏附、侵袭和血行转移,并对肠上皮细胞起到保护性作用。在LGG处理组的新生大鼠中,致病菌肠道定植、菌血症以及脑膜炎都显著减弱。
综上,灌胃益生菌LGG后可以抑制致病菌阪崎克罗诺杆菌致小鼠脑膜炎的发生,临床使用有一定的推广价值,为益生菌LGG在细菌性脑膜炎中的应用提供新的依据。
| [1] | Huang SH, Jang AY. Cellular mechanisms of microbial proteins contributing to invasion of the blood-brain barrier[J]. Cell Microbiol,2001, 3 (5) : 277-87. DOI: 10.1046/j.1462-5822.2001.00116.x. |
| [2] | Brouwer MC, Tunkel AR, Van de Beek D. Epidemiology, diagnosis, and antimicrobial treatment of acute bacterial meningitis[J]. Clin Microbial Rev,2010, 23 (3) : 467-92. DOI: 10.1128/CMR.00070-09. |
| [3] | Schrag SJ, Hadler JL, Arnold KE, et al. Risk factors for invasive, early-onset Escherichia coli infections in the era of widespread intrapartum antibiotic use[J]. Pediatrics,2006, 118 (2) : 570-6. DOI: 10.1542/peds.2005-3083. |
| [4] | Van Baarlen P, Wells JM, Kleerebezem M. Regulation of intestinal homeostasis and immunity with probiotic lactobacilli[J]. Trends Immunol,2013, 34 (5) : 208-15. DOI: 10.1016/j.it.2013.01.005. |
| [5] | Yan QQ, Condell O, Power K, et al. Cronobacter species (formerly known as Enterobacter sakazakii) in powdered infant formula: a review of our current understanding of the biology of this bacterium[J]. J Appl Microbiol,2012, 113 (1) : 1-15. DOI: 10.1111/jam.2012.113.issue-1. |
| [6] | Hunter CJ, Bean JF. Cronobacter: an emerging opportunistic pathogen associated with neonatal meningitis,sepsis and necrotizing enterocolitis[J]. J Perinatol,2013, 33 (8) : 581-5. DOI: 10.1038/jp.2013.26. |
| [7] | Giri CP, Shima K, Tall BD, et al. Cronobacter spp. (previously Enterobacter sakazakii) invade and translocate across both cultured human intestinal epithelial cells and human brain microvascular endothelial cells[J]. Microb Pathog,2012, 52 (2) : 140-7. DOI: 10.1016/j.micpath.2011.10.003. |
| [8] | Holy O, Forsythe S. Cronobacter spp. as emerging causes of healthcare-associated infection[J]. J Hosp Infect,2014, 86 (3) : 169-77. DOI: 10.1016/j.jhin.2013.09.011. |
| [9] | Vlasova AN, Chattha KS, Kandasamy SA, et al. Lactobacilli and bifidobacteria promote immune homeostasis by modulating innate immune responses to human rotavirus in neonatal gnotobiotic pigs[J]. PLoS One,2013, 8 (10) : e76962. DOI: 10.1371/journal.pone.0076962. |
| [10] | Dai C1, Zheng CQ, Jiang M, et al. Probiotics and irritable bowel syndrome[J]. World J Gastroenterol,2013, 19 (36) : 5973-80. DOI: 10.3748/wjg.v19.i36.5973. |
| [11] | Kuisma J, Mentula S, Jarvinen H, et al. Effect of Lactobacillus rhamnosus GG on ileal pouch inflammation and microbial flora[J]. Aliment Pharmacol Ther,2003, 17 (4) : 509-15. DOI: 10.1046/j.1365-2036.2003.01465.x. |
| [12] | Yan F, Polk DB. Lactobacillus rhamnosus GG: an updated strategy to use microbial products to promote health[J]. Functional Food Rev (Print),2012, 4 (2) : 77-84. |
| [13] | MohammedsaeedW, Mcbain AJ, Cruickshank SM, et al. Lactobacillus rhamnosus GG inhibits the toxic effects of staphylococcus aureus on epidermal Keratinocytes[J]. Appl Environ Microbiol,2014, 80 (18) : 5773-81. DOI: 10.1128/AEM.00861-14. |
| [14] | 王斌, 李秋荣, 刘放南, 等. 1株肠道高黏附性乳杆菌的分离鉴定[J]. 中国生物制品学杂志,2008, 21 (6) : 463-6. |
| [15] | Chong ES. A potential role of probiotics in colorectal cancer prevention: review of possible mechanisms of action[J]. World J Microbiol Biotechnol,2014, 30 (2) : 351-74. DOI: 10.1007/s11274-013-1499-6. |
| [16] | Mkelinen H, Tahvonen R, Salminen S, et al. In vivo safety assessment of two Bifidobacterium longum strains[J]. Microbiol Immunol,2003, 47 (12) : 911-4. DOI: 10.1111/mim.2003.47.issue-12. |
| [17] | Dhanani AS, Gaudana SB, Bagchi T. The ability of Lactobacillus adhesin EF-Tu to interfere with pathogen adhesion[J]. Eur Food Res Tech,2011, 232 (5) : 777-85. DOI: 10.1007/s00217-011-1443-7. |
| [18] | Liu Q, Mittal R, Emami CN, et al. Human isolates of cronobacter sakazakii bind efficiently to intestinal epithelial cells in vitro to induce monolayer permeability and apoptosis[J]. J Surg Res,2012, 176 (2) : 437-47. DOI: 10.1016/j.jss.2011.10.030. |
| [19] | Huang SH, He L, Zhou Y, et al. Lactobacillus rhamnosus GG suppresses meningitic E. coli K1 penetration across human intestinal epithelial cells in vitro and protects neonatal rats against experimental hematogenous meningitis[J]. Int J Microbiol,2009 : 647862. |
 2015, Vol. 35
2015, Vol. 35
