血小板源性生长因子(platelet-derived growth factor, PDGF)是体内一种主要的促有丝分裂剂,可以刺激多种组织细胞增殖、迁移。PDGFBB属于PDGF家族,可由内皮细胞、平滑肌细胞、巨噬细胞、某些肿瘤细胞等多种细胞分泌,在PDGF家族成员中,仅PDGFBB能结合所有PDGF受体,使受体磷酸化,活化下游重要的信号分子,参与多种信号转导通路如Ras,PI3K,ERK,MAPK等[1],在动脉粥样硬化、血管再狭窄等心血管疾病的发生发展过程中起非常重要的作用。而平滑肌细胞表型转化这一概念最初在对血管平滑肌细胞(VSMC)的研究中提出来[2],VSMC分为收缩型(分化型)和合成型(增殖型或去分化型)两种类型,当血管受到病理损伤或体外培养的VSMC受到某种因素刺激时,VSMC可从收缩型转化为合成型并获得增殖能力,这个形态、结构和功能的改变过程即称为表型转化[3]。我们前期研究[4]表明,糖尿病性ED大鼠阴茎海绵体平滑肌(CCSM)细胞存在表型转化,CCSM细胞表型转化可以改变阴茎海绵体的正常结构和功能,与ED的发生密切相关。虽然有文献[5-6]报道PDGFBB可促进VSMC增殖、迁移及表型转化,但是在CCSM细胞表型转化和ED方面的研究尚未见报道,它是否会影响CCSM细胞增殖、迁移及表型转化还不清楚。因此本文研究PDGFBB对体外培养的CCSM细胞增殖、迁移及表型转化的影响,并初步研究其作用机制,目的在于探讨CCSM细胞型转化的调控机制。
1 材料和方法 1.1 主要材料和试剂SPF级Wistar大鼠15只(广州南方医科大学实验动物中心提供。许可证号:SCXK(粤)2011-0015)雄性,体质量200 g左右,DMEM/F12培养液(Hyclone公司),胎牛血清(BI公司),0.25%胰蛋白酶消化液(Hyclone公司),抗生素混合液(Sigma公司),重组PDGFBB(preprotech公司),CCK-8(日本同仁化学研究所),TRIzol、逆转录试剂盒及SYBR Premix Ex Taq(TaKaRa公司),FITC标记的羊抗小鼠荧光二抗(碧云天),Alexa Fluor® 555-标记的羊抗小鼠荧光二抗(abcam公司),myocardin一抗(Santa公司),α-SMA一抗(Santa公司),smoothelin一抗(abcam公司),β-actin单克隆抗体(北京锐抗生物公司)。
1.2 大鼠CCSM细胞的分离培养及鉴定 1.2.1 CCSM细胞分离培养采用我们已经报道的改良的组织块培养法[7]培养大鼠CCSM细胞,大鼠麻醉后在无菌条件下快速解剖,分离、切取阴茎海绵体中段,立即置入含1%青霉素及链霉素的无菌PBS液中并移入超净台,仔细剥除海绵体外周纤维脂肪层及尿道海绵体等,用无菌PBS液冲洗2~3次,将海绵体组织剪成1~2 mm小块,按0.5 cm间隔放置到25 cm2培养瓶内(预铺少量含20%血清的培养液)。翻转培养瓶,使有组织小块的一面向上,加入2.5 mL配制好的DMEM/F12完全培养液(含20%胎牛血清,100 U/mL青毒素,100 U/mL链霉素),注意勿使培养液与组织块接触。放入37 ℃、5% CO2细胞培养箱,培养4~5 h后,轻轻翻转培养瓶,使培养液与组织块接触。3~5 d后,置于倒置显微镜下观察,当发现有少许细胞从组织块边缘游出,第2天即清除组织块,补加培养液至4 mL。此后2~3 d换液1次。原代细胞培养至80%~90%融合时,用10% DMEM/F12完全培养液传代培养并用差速贴壁法分离出较纯的CCSM细胞转移至新瓶中,置入培养箱中继续培养。
1.2.2 细胞免疫荧光鉴定传代细胞以每孔1×104个细胞密度接种到预置无菌盖玻片的24孔板中,补充培养液至1 mL,适应性生长24 h,待盖玻片上细胞密度合适,即去除培养液,用PBS液漂洗2次,4%多聚甲醛固定20 min,PBS漂洗3次,每次5 min;予0.25% Triton X-100穿孔15 min,PBS漂洗3次,每次5 min;再用1% BSA(胎牛血清白蛋白)封闭50 min,吸净液体;分别加入1% BSA稀释的α-SMA一抗(1:100稀释)和smoothelin一抗(1:100稀释),振荡两次,4 ℃恒温孵育过夜;用PBS漂洗4次,每次5~10 min,避光分别加入1%BSA稀释的FITC标记的羊抗小鼠荧光二抗(1:100稀释)和Alexa Fluor® 555-标记的羊抗小鼠荧光二抗(1:100稀释),振荡2次,37 ℃恒温孵育30 min,PBS漂洗4次,每次5~10 min;用DAPI进行细胞核染色3~5 min,吸去DAPI液,用PBS液漂洗3次,每次5 min;予抗荧光衰减封片剂封片后,将载玻片和盖玻片放置于荧光倒置显微镜下拍照。
1.3 细胞增殖实验传代细胞以每孔3×103个细胞密度接种到96孔板中,每孔加细胞悬液200 μL,适应性生长24 h,弃培养液,用PBS液漂洗1次。预设置5个浓度组,每组6个复孔,分别加入PDGFBB终浓度分别为0、2.5、5.0、12.5、25.0 ng/mL的无血清DMEM/F12培养液(0.1%BSA)200 μL,将细胞放置于37 ℃、5% CO2培养箱继续培养,24 h和48 h后,每孔分别加入20 μL的CCK-8,继续培养2 h后,在多功能酶标仪中450 nm波长下检测各孔光吸收值,并筛选出最适PDGFBB作用浓度,用于后续实验。
1.4 细胞迁移实验传代细胞按每孔5×105密度接种到6孔板中,每孔补充培养液至2 mL,置于37 ℃、5% CO2培养箱中培养,直到细胞融合至基本铺满整个孔,换无血清DMEM/ F12培养液(0.1% BSA)继续培养24 h使细胞同步化,用200 μL的枪头在培养孔中直线刮除细胞,再用PBS漂洗3次,用筛选出的最适PDGFBB浓度(12.5 ng/mL)的无血清DMEM/F12培养液(0.1% BSA)处理细胞,阴性对照组加0 ng/mL的PDGFBB的无血清DMEM/F12培养液(0.1% BSA)。分别于0、12和24 h在倒置显微镜下观察细胞迁移并拍照。
1.5 荧光定量PCR检测CCSM细胞中转录因子myocardin和表型标志物α-SMA、SMMHC的mRNA表达水平为了了解PDGFBB对大鼠CCSM细胞表型的影响,用终浓度为12.5 ng/mL的PDGFBB(实验组)和0 ng/mL的PDGFBB无血清DMEM/F12培养液(0.1% BSA)(阴性对照组)分别处理CCSM细胞24 h和48 h,收集各组细胞,使用TRIzol提取总RNA,以各组总RNA为模板,用TaKaRa逆转录试剂盒按照说明书分别合成cDNA,然后以磷酸甘油醛脱氢酶(GAPDH)为内参(引物均由上海生物工程公司合成,各引物序列见表 1),进行荧光定量PCR,其反应体系为:SYBR Premix Ex Taq(2×)10.0 μL,正向及反向引物(10 mol/L)各0.4 μL,模板cDNA 2.0 μL,ddH2O补足总体积至20 μL,95℃预变性30 s并按以下PCR反应程序进行40个循环:95 ℃变性5 s,60 ℃退火、延伸30 s,PCR反应后,仪器自动进行熔解曲线分析。每个样品中目的基因相对于空白对照组样品的表达量以2-ΔΔCt(①Ct值代表达到检测荧光阈值的循环数;②△Ct=待测样品目的基因Ct值-待测样品内参的Ct值;③△△Ct=处理后△Ct-处理前△ Ct)表示。
| 表 1 引物和序列 Table 1 Primers and sequences |
为了了解PDGFBB作用CCSM细胞不同时间后,细胞中转录因子myocardin蛋白表达变化。予终浓度为12.5 ng/mL的PDGFBB分别处理细胞0、24及48 h后收集三组细胞,用预冷的PBS缓冲液漂洗3次,每皿中加入100 μL RIPA细胞裂解液(加蛋白酶抑制剂),细胞刮刀收集至无菌EP管中,冰浴裂解30 min后,4 ℃下12 000 g离心15 min。取上清液,加入上清液1/4体积的5×上样缓冲液,煮沸5 min,置于冰上冷却。制备10%分离胶和5%浓缩胶,待胶凝固后,每孔上样10~20 μL的蛋白样品进行SDS-PAGE电泳。电泳参数设置:75 V,30 min;120 V,2~3 h,直至溴酚蓝指示线距胶底2 cm处为止。电泳结束后,根据Marker指示条带确定目的蛋白的位置并切胶。转膜夹板制备好后放入转膜槽进行电泳,冰浴中200 mA恒流1.5~2 h。转膜结束后,将PVDF膜用含5%脱脂奶粉的TBST溶液室温封闭1 h,4 ℃于稀释后的一抗中孵育过夜(抗体稀释液比例:myocardin 1:300,β-actin 1:8000)。TBST溶液漂洗PVDF膜3次,每次10 min,二抗稀释液室温孵育1 h。TBST溶液漂洗PVDF膜3次,每次10 min,利用采用AlphaEase FC软件对western blotting显色区带的灰度值进行采集与分析,目的蛋白表达量以内参β-actin进行标准化,对比分析各实验组间蛋白表达的差异情况。
1.7 统计学分析应用SPSS13.0统计软件分析,两组间差异的比较用两个独立样本t检验;多样本均数比较采用单因素方差分析,多个实验组和一个对照组的比较采用Dunnett法,组间多重比较采用LSD法。P < 0.05表示结果有统计学意义。
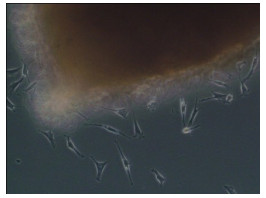
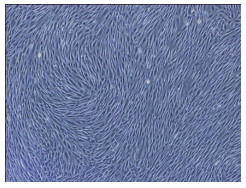
2 结果 2.1 CCSM细胞的培养和鉴定 2.1.1 CCSM细胞的形态及生长特点倒置相差显微镜下观察发现,改良组织块法培养大鼠CCSM细胞,原代第4~5 d有少数梭形细胞从组织块边缘游出逐渐形成细胞晕(图 1A),至22 d左右细胞长满覆盖培养瓶底;传代并经差速离心筛选后的细胞绝大部分呈梭形,呈方向性排列,少部分呈星形。生长密集时,梭型或长梭型的细胞相互交织呈网状,密度高时细胞排列呈束状或旋涡状,有时呈“峰-谷”样生长(图 1B)。
|
图 1A 原代培养第4天少数梭形细胞从组织块边缘爬出 Figure 1A Cell outgrowth from the edge of tissue blocks on day 4 of primary culture (Phase-contrast microscope, original magnification: ×200). |
|
图 1B CCSM细胞呈旋涡状或“峰-谷”样生长 Figure 1B Swirling or "peak-valley" like growth pattern of CCSM cells (Phase contrast microscope, original magnification: ×100). |
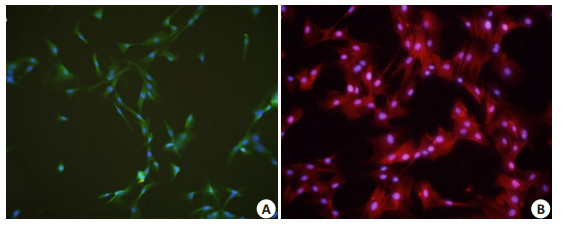
CCSM细胞免疫荧光结果显示(图 2),倒置荧光纤维镜下观察发现,视野内所有细胞核均呈现蓝色荧光,绝大多数细胞呈梭形,约96.5%的细胞胞质呈现绿色荧光为α-SMA,约96%细胞胞质呈现红色荧光为smoothelin阳性的细胞,两者均为阳性的细胞阳性的细胞即CCSM细胞。可见改良组织块法加差速贴壁离心法筛选细胞,可得到较纯的CCSM细胞。
|
图 2 CCSM细胞的免疫荧光鉴定 Figure 2 Immunofluorescence identification of CCSM cells for α-SMA and smoothelin (Original magnification: × 200). A: Immunofluorescence of α-SMA protein; B: Immunofluorescence of smoothelin protein. |
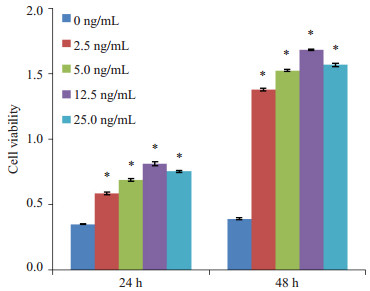
利用CCK-8法,分别采用终浓度为0、2.5、5.0、12.5、25.0 ng/mL的重组PDGFBB作用体外培养的大鼠CCSM细胞,24 h和48 h时用多功能酶标仪读出各孔OD值,结果(图 3)显示,在24 h和48 h时,与阴性对照组(0 ng/mL PDGFBB)相比,各不同浓度的PDGFBB均能明显刺激大鼠CCSM细胞生长和增殖(24 h和48 h时P值均为P < 0.001)。且在终浓度为12.5 ng/mL时,PDGFBB对CCSM细胞的促增殖作用最明显;并以此浓度作为PDGFBB作用CCSM细胞的最适浓度来进行后续实验。
|
图 3 不同浓度的PDGFBB对CCSM细胞增殖活力的影响 Figure 3 Effect of PDGFBB at different concentrations on CCSM cell viability. *P < 0.001 vs control (0 ng/mL PDGFBB). |
利用划痕实验,分别采用0 ng/mL PDGFBB及12.5 ng/mL PDGFBB的无血清DMEM/F12(0.1%BSA)来诱导CCSM细胞迁移,结果(图 4)显示,在12 h和24 h,与阴性对照组相比,PDGFBB能明显增强CCSM细胞的迁移能力。

|
图 4 PDGFBB对CCSM细胞迁移的影响 Figure 4 Effect of PDGFBB on CCSM cell migration (Original magnification: ×40). |
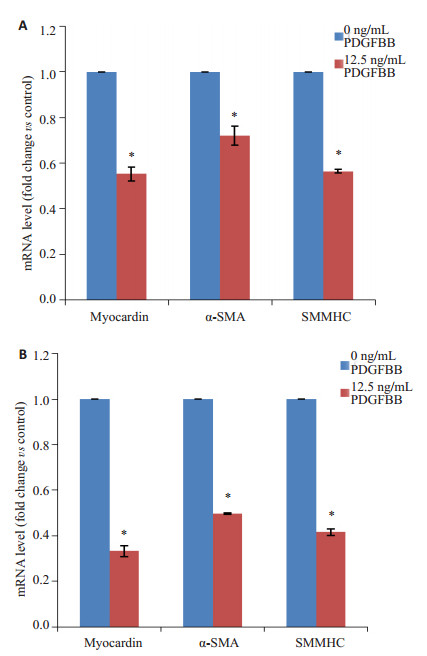
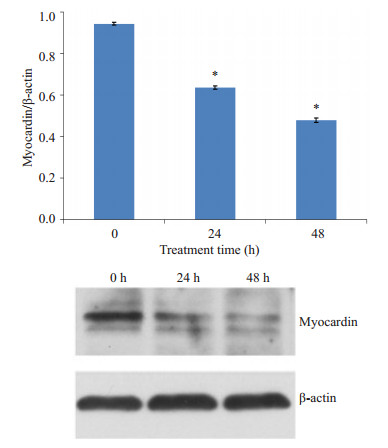
根据2-ΔΔCt确定各目的基因的mRNA表达量,与阴性对照组比较,24 h(图 5A)和48 h(图 5B)时PDGFBB组CCSM细胞中myocardin mRNA表达分别下降45%、66%;α-SMA mRNA表达分别下降28%、50%;SMMHC mRNA表达分别下降44%、58%。可见,PDGFBB能下调CCSM细胞转录因子myocardin及收缩型表型标志物α-SMA、SMMHC及的表达,进而说明PDGFBB可促进CCSM细胞表型转化。根据western blotting检测结果(图 6)显示,与0 h相比,PDGFBB刺激CCSM细胞24 h时,细胞中myocardin蛋白表达减少(P < 0.001);与0 h相比,PDGFBB刺激CCSM细胞48 h时,CCSM细胞中myocardin蛋白表达显著减少(P < 0.001);说明在48 h内细胞中myocardin蛋白表达水平随着PDGFBB作用时间延长而逐渐降低。推断myocardin可能参与调控PDGFBB诱导的CCSM细胞表型转化。
|
图 5 PDGFBB刺激24 h(A)和48 h(B)时对CCSM细胞表型转化的影响 Figure 5 Effect of PDGFBB on CCSM cell phenotypic modulation at 24 h (A) and 48 h (B). *P < 0.01 vs control (0 ng/mL PDGFBB). |
|
图 6 PDGFBB处理不同时间对CCSM细胞中myocardin蛋白表达的影响 Figure 6 Effect of PDGFBB on myocardin protein expression in CCSM cells at different time points. *P < 0.001 vs control (0 h). |
在阴茎勃起过程中,CCSM为各种因素作用的终末组织,处于核心地位。CCSM细胞约占海绵体组织40%~52%[8]。CCSM细胞表型转化在器质性ED发生的过程中起非常重要的作用,然而调控CCSM细胞表型转化的机制尚不清楚。
研究发现PDGFBB能促进VSMC增殖、趋化及使细胞从收缩型向合成型转化[5-6, 9]。然而,PDGFBB是否对类似的CCSM细胞有相似的作用还不清楚。Aversa等[10]研究报道,PDGFBB及PDGF受体可在CCSM细胞中表达,PDGFBB可以改变海绵体组织中平滑肌与纤维结缔组织的比例,导致阴茎海绵体纤维化和ED的发生。推断PDGFBB可能影响CCSM细胞表型并在器质性ED的发生起重要作用。
本研究首先用不同浓度的重组PDGFBB刺激体外培养的大鼠CCSM细胞,发现各浓度PDGFBB均能明显促进CCSM细胞增殖,并且筛选出PDGFBB作用CCSM细胞的最适浓度为12.5 ng/mL。细胞划痕实验证实,PDGFBB能明显趋化CCSM细胞,增强其迁移能力。虽然PDGFBB能显著促进CCSM细胞增殖、迁移,但是在器质性ED的阴茎病理标本中,未发现CCSM细胞增生,反而有显著减少,这与我们的结果不一致,考虑可能器质性病变时还有其他复杂的机制参与体内CCSM细胞的凋亡,如糖尿病时低氧诱导CCSM细胞凋亡[11]等,因此还需要大量的体内实验进一步探索。然而病理结果发现器质性ED如糖尿病性ED的大鼠CCSM细胞外基质沉积,并出现纤维化[12]。文献报道,VSMC表型转化可调节细胞外基质成分的变化并促进血管纤维化[13]。同样,CCSM细胞表型发生转化,使得其合成细胞外基质的能力增加,促进海绵体纤维化[11],进而导致ED的发生。因此我们主要研究大鼠CCSM表型转化。为此,本实验用重组PDGFBB处理CCSM细胞24 h和48 h后,分别设置阴性对照组,用荧光定量PCR的方法分析CCSM细胞中转录因子myocardin及收缩型表型标志物α-SMA、SMMHC的表达情况,结果发现,在24 h和48 h时PDGFBB均能不同程度地下调CCSM细胞中myocardin、α-SMA和SMMHC的表达。说明PDGFBB可诱导CCSM细胞发生表型转化。另外,我们采用Western blotting检测PDGFBB处理CCSM细胞不同时间后,细胞中myocardin的蛋白表达变化,结果显示,在48 h内myocardin蛋白表达随PDGFBB作用时间延长而下调。Myocardin是平滑肌细胞表型调控过程中重要的调控因子,其与SRF及CArG盒结合形成三元复合物共同调节平滑肌细胞表型[14],并且我们前期研究[15-16]也显示,糖尿病性ED大鼠阴茎海绵体组织中myocardin蛋白表达下调,并且阴茎海绵体过表达myocardin能够逆转CCSM细胞的表型转化和改善糖尿病性ED大鼠的勃起功能。上述结果表明,myocardin可能参与调控PDGFBB诱导的CCSM细胞表型转化。
我们前期对CCSM细胞表型转化尤其是糖尿病性ED的CCSM细胞表型转化方面做了大量研究,然而对其发生表型转化的调控机制研究尚少,本研究结果表明,PDGFBB不仅能促进体外培养的CCSM细胞增殖、迁移,更重要的是,其可诱导CCSM细胞发生表型转化,可能参与糖尿病、呼吸睡眠低通气综合征等器质性ED的发生发展。Myocardin随着PDGFBB作用时间的延长而下调,说明myocardin可能参与调控PDGFBB诱导的CCSM细胞表型转化。然而器质性ED时CCSM细胞发生表型转化是由许多因素共同参与的,其具体分子机制仍不清楚;PDGFBB诱导CCSM细胞表型转化的机制亦非常复杂,涉及许多信号通路,仍需深入研究。
| [1] | Bonner JC. Regulation of PDGF and its receptors in fibrotic diseases[J]. Cytokine Growth Factor Rev,2004, 15 (4) : 255-73. DOI: 10.1016/j.cytogfr.2004.03.006. |
| [2] | Wissler RW. The arterial medial cell, smooth muscle, or multifunctional mesenchyme?[J]. Circulation,1967, 36 (1) : 1-4. DOI: 10.1161/01.CIR.36.1.1. |
| [3] | Rensen SS, Doevendans PA, Van Eys GJ. Regulation and characteristics of vascular smooth muscle cell phenotypic diversity[J]. Neth Heart J,2007, 15 (3) : 100-8. DOI: 10.1007/BF03085963. |
| [4] | Wei AY, He SH, Zhao JF, et al. Characterization of corpus cavernosum smooth muscle cell phenotype in diabetic rats with erectile dysfunction[J]. Int J Impot Res,2012, 24 (5) : 196-201. DOI: 10.1038/ijir.2012.16. |
| [5] | Lee MH, Kwon BJ, Seo HJ, et al. Resveratrol inhibits phenotype modulation by platelet derived growth factor-bb in rat aortic smooth muscle cells[J]. Oxid Med Cell Longev,2014 : 572430. |
| [6] | Gan J, Li P, Wang Z, et al. Rosuvastatin suppresses platelet-derived growth factor-BB-induced vascular smooth muscle cell proliferation and migration via the MAPK signaling pathway[J]. Exp Ther Med,2013, 6 (4) : 899-903. |
| [7] | 万波, 韦安阳, 叶挺宇, 等. 改良组织块法培养SD大鼠阴茎海绵体平滑肌细胞[J]. 南方医科大学学报,2010, 30 (3) : 494-7. |
| [8] | El-Sakka AI. Yassin a a.amelioration of penile fibrosis:myth or reality[J]. J Androl,2013, 31 (4) : 324-35. |
| [9] | Salabei JK, Cummins TD, Singh M, et al. PDGF-mediated autophagy regulates vascular smooth muscle cell phenotype and resistance to oxidative stress[J]. Biochem J,2013, 451 (3) : 375-88. DOI: 10.1042/BJ20121344. |
| [10] | Aversa A, Basciani S, Visca P, et al. Platelet-derived growth factor (PDGF) and PDGF receptors in rat corpus cavernosum: changes in expression after transient in vivo hypoxia[J]. J Endocrinol,2001, 170 (2) : 395-402. DOI: 10.1677/joe.0.1700395. |
| [11] | Lv B, Zhao J, Yang F, et al. Phenotypic transition of corpus cavernosum smooth muscle cells subjected to hypoxia[J]. Cell Tissue Res,2014, 357 (3) : 823-33. DOI: 10.1007/s00441-014-1902-0. |
| [12] | Zhou F, Li GY, Gao ZZ, et al. The TGF-β1/Smad/CTGF pathway and corpus cavernosum fibrous-muscular alterations in rats with streptozotocin-induced diabetes[J]. J Androl,2012, 33 (4) : 651-9. DOI: 10.2164/jandrol.111.014456. |
| [13] | Touyz AA. Angiotensin Ⅱ and vascular injury[J]. Curr Hypertens Rep,2014, 6 (16) : 431. |
| [14] | Long X, Bell RD, Gerthoffer WT, et al. Myocardin is sufficient for a smooth muscle-like contractile phenotype[J]. Arterioscler Thromb Vasc Biol,2008, 28 (8) : 1505-10. DOI: 10.1161/ATVBAHA.108.166066. |
| [15] | He SH, Wei AY, Yang Y, et al. Reduced expression of myocardin and serum response factor in the cavernous tissue of diabetic rats[J]. Andrologia,2012, 44 (Suppl 1) : 518-22. |
| [16] | He S, Zhang T, Liu Y, et al. Myocardin restores erectile function in diabetic rats: phenotypic modulation of corpus cavernosum smooth muscle cells[J]. Andrologia,2015, 47 (3) : 303-9. DOI: 10.1111/and.2015.47.issue-3. |
 2015, Vol. 35
2015, Vol. 35