输血治疗不但可以挽救患者生命,还有利于患者术后恢复,但同时也存在诸多风险及不良反应。由于血液资源有限,血源短缺问题突出[1]。血液保护受到了全社会的普遍重视。急性高容量血液稀释(acute hypervolemic hemodilution, AHH)复合自体血液回收(intra operative blood salvage, IOBS)是血液保护的重要措施之一。
近年来,AHH因为能够减少异体血的输入而广泛应用于临床[2-4],AHH后机体内环境产生渗透压的改变,会对红细胞的结构和功能存在影响。而国内外就AHH对患者红细胞超微结构及力学性能的影响,尚未见文献报道。国内王小平,黄艳等[5-6]利用原子力显微镜观察了IOBS对红细胞形态的影响,但就AHH复合IOBS对红细胞功能影响的研究仅局限于对红细胞压积、脆性及变形能力等血液流变学方面的探讨[7-8],通过原子力显微镜观察AHH复合IOBS后患者红细胞超微结构及力学性能的影响,国内外均未见相关研究报道,AHH复合IOBS的安全性及有效性尚需进一步探讨。
因此,本研究拟应用原子力显微镜对红细胞进行纳米分辨率成像,研究AHH复合IOBS对患者红细胞形态与生物力学的影响,从纳米观的角度,深入探讨手术前、AHH后及IOBS后红细胞形态结构、机械力学性能的变化,为AHH复合IOBS对患者术中失血疗效与安全性的研究提供分子血液流变学方面的理论依据,为解决日益紧张的临床用血问题提供新的思路和方法。
1 资料与方法 1.1 一般资料经本院伦理委员会批准后,术前和患者及家属签署知情同意书,选取择期全麻下拟行骨科脊柱、全髋关节置换、骨盘切开复位内固定等复杂、手术时间长、且术中出血多的患者20例为研究对象,患者男13例,女7例,年龄18~65岁,身高155~183 cm,体质量45~83 kg,ASAⅠ~Ⅱ级。患者均无严重心血管疾病,无肿瘤和血液疾病,无自身免疫性疾病以及内分泌疾病,肝肾功能、电解质、血常规、凝血功能的检查指标无明显异常。
1.2 麻醉方法患者进入手术室前30 min肌肉注射阿托品0.5 mg、苯巴比妥钠0.1 g。入室后行右侧颈内静脉穿刺,测中心静脉压(CVP),行桡动脉穿刺,监测有创动脉血压,术中常规监测ECG、SpO2、HR和尿量,麻醉脑电/意识深度监测仪(Narcotrend)监测麻醉深度。麻醉诱导:静脉注射咪唑安定0.05~0.1 mg/kg,丙泊酚1~2 mg/kg,枸橼酸舒芬太尼0.3~0.5 μg/kg,维库溴铵0.1 mg/kg,气管插管后接全麻机行机械通气,氧流量2 L/min,潮气量6~8 mL/kg,呼吸频率12~15次/min,吸入氧浓度100%,吸呼比1:2,保持PetCO2在35~40 mmHg。麻醉维持采用七氟烷吸入,静脉间断追加舒芬太尼和维库溴铵维持麻醉。
1.3 高容量血液稀释(AHH)患者在入室后以乳酸林格氏液补充术前液体丢失量,并在麻醉诱导前15 min,按15 mL/kg,25~35 mL/kg/h快速输入羟乙基淀粉130/0.4氯化钠注射液,维持血细胞比容大于25%。
1.4 自体血回收(IOBS)并回输使用北京万东医疗技术公司BW-8100A自体血液回收机,连接各管道时注意要严格按照无菌操作要求。使用肝素盐水(肝素12 500 U加入到生理盐水500 mL,肝素钠生理盐水与吸入血液比为1:5,即每1 mL回收血含5 U肝素钠)。200 mL预充血液回收机的双腔管和过滤器,并控制吸引压力在100~150 mmHg,尽可能避免空气与血液混同吸入,以减少对红细胞的破坏。当储血过滤器内血液超过500 mL时,将血液引入,经过离心、分离、洗涤等一系列自动化程序,将细胞碎片、抗凝剂、脂肪滴、术中所使用的各种药物及游离血红蛋白等分离至废液袋内,得到浓缩红细胞回收至储血袋,手术中或手术后回输给患者。手术中根据出血情况调节泵速(常用500 mL/min),离心机运转参数为5600 r/min。
1.5 取材与观察 1.5.1 观测前样品的取材与制备患者分三个时段采集红细胞标本,分别于入手术室开放静脉后即刻(T1)(基础状态),切皮前即刻(T2)(AHH后),经外周静脉取血2 mL,于血液回收机回收处理获得的红细胞回输患者时,经连接输血器的三通取血2 mL(T3)。用肝素行抗凝处理。把25%的戊二醛用PBS缓冲液稀释成2.5%的戊二醛,充分混合。在行红细胞样品滴样前剥离出新鲜表面,取20 μL处理好的红细胞滴加在盖玻片表面后,立刻用2.5%的戊二醛固定20 min,使用滤纸吸去多余的戊二醛,再用蒸馏水冲洗3次,用滤纸吸去过量的水,室温条件下自然风干备用。
1.5.2 对样品进行测量使用OLYMPUS荧光显微镜(BX51TF,日本)对T1、T2、T3时点的红细胞,在1000倍放大率下浏览整个玻片大范围的红细胞,随机选取其中1000个红细胞,计算其畸形率,(球形、椭圆形、梨形、花瓣形、破碎红细胞)计算出百分比,取均数进行比较。
同样选取3个时点的红细胞样品片,利用原子力显微镜AFM(Autoprobe CP, Thermomicroscopes, 美国)进行观察和检测。在室温下大气条件下,使用曲率半径小于10 nm的Si扫描探针。在大气条件中对红细胞进行成像及细胞表面机械力学性能的测量。测量细胞体积等形貌变化时,采用tapping模式成像。对于力学测量采用contact模式测量。扫描以后图像平滑处理,以消除慢扫描方向的噪音。
1.6 统计学处理AFM的数据的分析主要基于AFM自带软件(IP 2.1)以及Origin 6.0。研究数据采用SPSS 13.0统计学软件进行处理。计量资料采用正态性检验和方差齐性检验,用均数±标准差表示,计数资料采用χ2检验,P < 0.05为差异有统计学意义。
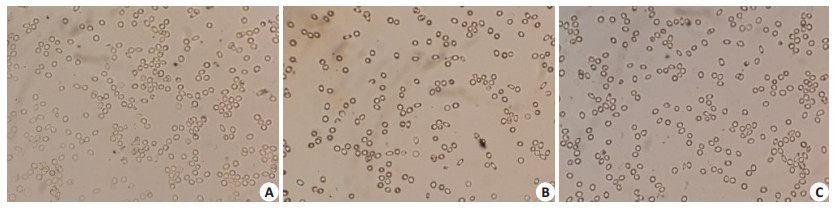
2 结果 2.1 荧光显微镜下大范围红细胞形貌变化荧光显微镜下大范围红细胞的形貌如图 1所示。患者术前静脉血、高容量血液稀释后静脉血、血液回收后血液的红细胞畸形率分别为(2.6±1.3)%、(19.3±1.6)%、(17. 6±1.4)%。患者在T1时点的红细胞畸形率显著低于T2和T3(n=20,P > 0.05),而T2和T3两个时点的红细胞畸形率并无显著差异。
|
图 1 荧光显微镜下3个时点大范围红细胞的形貌图 Figure 1 Fluorescent microscopy showing the morphology of red blood cells from samples taken before operation (A), after acute hypervolemic hemodilution (B), and after blood salvage (C) (Original magnification, ×1000). |
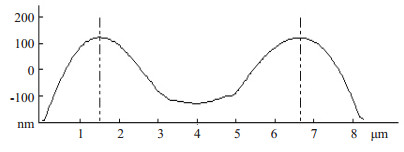
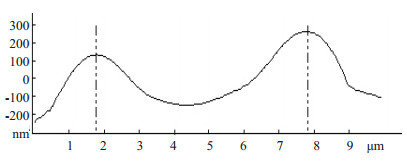
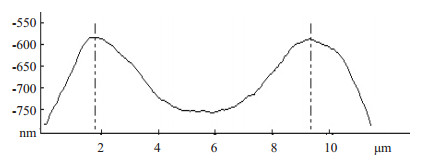
AFM下单个红细胞的形貌变化和细胞高度曲线图(图 2~6)。图 3中A、B、C对应AFM观察得到3个时点单个红细胞的二维形貌图所在的剖面,蓝色的“+”标记的是该细胞的最大高度处,其分别对应图 4、5、6三个细胞高度曲线图的两条竖虚线。从对比可以看出,患者术前的红细胞的形态较为完整,轮廓表面清晰平滑,弧线流畅,呈典型的双面凹陷圆盘形(图 2A、图 3A和图 4);经过高容量血液稀释后静脉血红细胞虽然仍为双凹圆盘状,还算规则,部分出现重叠和褶皱,呈肿胀改变,细胞高度曲线图显示细胞直径增加,表面最大高度降低,中心凹陷明显减少(图 2B、图 3B和图 5);血液回收后血液的红细胞形貌则较为接近术前状态,但红细胞膜表面和中心位置均较为粗糙,有不规则隆起,并有不规则附着物杂乱分布,细胞高度曲线图显示细胞直径虽然也有增加,但与T2相比,表面最大高度增高,中心凹陷增加(图 2C、图 3C和图 6)。

|
图 2 AFM下3个时点单个红细胞的三维形貌图 Figure 2 AFM showing the 3D morphologies of a single red blood cell from from samples taken before operation (A), after acute hypervolemic hemodilution (B), and after blood salvage (C). |

|
图 3 AFM下3个时点单个红细胞的二维形貌图 Figure 3 AFM showing 2D morphologies of a single red blood cell from samples taken before operation (A), after acute hypervolemic hemodilution (B), and after blood salvage (C). |
|
图 4 术前红细胞的高度曲线图 Figure 4 Height profile of red blood cells before operation. |
|
图 5 高容量血液稀释后红细胞的高度曲线图 Figure 5 Height profile of red blood cell after acute hypervolemic hemodilution. |
|
图 6 血液回收后红细胞的高度曲线图 Figure 6 Height profile of red blood cells after blood salvage. |
通过AFM对3个时点红细胞力学性能进行研究,T1、T2、T3时点红细胞的压痕深度分别为7.14±0.96、7.26±1.15、7.23±1.47 nm,相互比较均无显著差异;膜形变恢复力分别为7.68±1.85、7.32±1.52、6.94±1.23 nm,相互比较也均无显著差异。而3个时点的黏附吸引力分别为2.53±1.23、2.09±0.93、12.85±2.45 nN,T3时点明显高于其他两个时点(P > 0.05);调理线程分别为21.73±2.47、19.92±2.63、31.26±2.85 nm,T3时点也均明显高于其他两个时点(P > 0.05)。
3 讨论原子力显微镜(AFM)在分子生物学、细胞生物学以及生物医学等领域的应用正日益变得广泛[9-10]。AFM是纳米生物学研究的重要工具,能够准确地测量到生物样品表面超微结构和微生物样品的生物机械性质,比如细胞的硬度、粘附力以及抗原-抗体亲和力分析等[11-12],实现细胞形态和膜表面纳米结构及力学机械性能变化的可视化,探讨微生物表面结构和功能之间的关系。近年来国内外已有学者结合AFM和血液流变学来研究红细胞[13]。
红细胞变形性和聚集性是研究红细胞微观流变学的重要参考依据。近年来,关于红细胞临床血液流变学的研究被人们关注并已有较为深入的研究,但对红细胞分子血液流变学的研究还很少,尤其是目前有关AHH复合IOBS对红细胞形态和力学性能的影响的研究还未见报道,AHH复合IOBS的安全性及有效性尚需进一步探讨。在本研究中,我们利用原子力显微镜(AFM),观察患者施行AHH复合IOBS后红细胞的超微结构和机械力学性能的变化,探讨AHH复合IOBS对红细胞形态和力学的影响。
AHH虽已成为血液保护的有效措施,但对于出血量较大的患者,AHH的效果相对有局限。为了最大程度地减少术中输入异体血,从而达到合理节约用血的目的,比较完善的措施是AHH与IOBS的联合应用。在这方面国内外的研究取得了一些进展。有学者研究证明[7-8],AHH对机体丢失的电解质和血浆渗透压起到补充和稳定的作用,而IOBS可将血液稀释后下降的红细胞压积进一步提高,两者地联合应用起到相互之间取长短的作用,对机体内环境不会产生显著不良影响。故可安全用于大量出血的非血液回收禁忌的手术当中。
动物研究表明[14],血液稀释后,回输血液回收机处理过的浓缩红细胞,对机体的凝血功能有一定的改善作用,IOBS通过把机体产生的组织碎片、脂肪细胞、破坏的细胞基质、游离血红蛋白、抗凝剂和血浆等全部清除,输血的安全性得到了大大提高,明显降低了围手术期的输血需求[15-16],同时IOBS还能降低患者的医疗费用[17]。
但也有学者认为IOBS对红细胞的影响会因为施行不同的方法而产生不同的效果[18-19]。术中自体血液回收过程中的负压吸引、微孔滤过、高速离心及大量清洗液清洗等也对红细胞造成一定程度的破坏,甚至导致红细胞破裂和溶血,尤其骨科手术术野还有大量的骨碎屑与脂肪滴。因此,回收自体血的红细胞内在质量即红细胞的携氧、供氧能力,是我们所最为关注的核心问题。本研究中,荧光显微镜下观察到高容量血液稀释后静脉血、血液回收后血液的红细胞畸形率均显著高于患者术前静脉血红细胞畸形率,而高容量血液稀释后静脉血、血液回收后两个时点的红细胞畸形率并无显著差异,这种改变和细胞功能存在怎样的联系,还有待进一步的研究。
细胞的硬度越小时其变形能力越大[20],而可变形性被公认为红细胞能够在体内存活的基本条件。研究发现,AHH后患者循环功能稳定,红细胞在聚集指数下降的同时变形指数升高, 但氧的输送多变化不大,不会对大脑和肝肾功能的稳定产生不良影响[21-22]。同时,有研究认为血液稀释使红细胞压积下降时会对其携氧能力和内脏灌注压产生不良影响,进而影响内脏器官的氧供并激发全身性炎症反应,使患者术后感染的几率增加。红细胞的双凹圆盘形是影响红细胞变形能力的重要因素之一。在本研究中,通过AFM观察中对比可以看出,患者术前的红细胞的形态较为完整,呈典型的双面凹陷圆盘形,而经过高容量血液稀释后静脉血红细胞虽然仍为双凹圆盘状,但呈肿胀状态,直径增加,表面最大高度降低,中心凹陷明显减少,血液回收后血液的红细胞形貌则较为接近术前状态,但也有表面最大高度和中心凹陷的变化,表明经过血液回收后,部分严重变形、破裂的红细胞已被分离出去,形态相对完整的细胞则重新回输给患者,这在一定程度上保证了患者生理内环境的相对稳定。
同时,本研究中通过AFM对3个时点红细胞力学性能进行研究,各时点压痕深度和膜形变恢复力相互比较均无显著差异,在一定程度上肯定了AHH复合IOBS这一血液保护措施的安全性。其中黏附吸引力和调理线程的变化,可以在一定程度上认为使用胶体进行高容量血液稀释,可以使血液黏度下降,血液流动性改善,红细胞变形能力和免疫黏附功能改善。但经过血液回收后红细胞黏度增大,血液黏附性增加,可能是由于血液回收机管道产生的吸引以及预充液等引起钙离子内流等原因引起。
在本研究中,利用AFM从纳米改变的角度观察AHH复合IOBS这一血液保护措施对红细胞的影响,对单个细胞进行成像观测和纳米结构的研究,探索红细胞的形貌结构,力学性能的变化等问题,而这种变化对患者病理生理功能有何影响,还有待进一步探讨。同时,由于研究时间等原因,本研究样本量还不够大,这都需要在以后的研究中进一步完善。
综上所述,AHH复合IOBS可增加红细胞的畸形率、改变红细胞的AFM形貌结构和黏附特性, 这种改变是否影响红细胞的功能,进而影响患者的病理生理功能,还有待进一步研究。
| [1] | Lin PC, Hsu CH, Huang CC, et al. The blood-saving effect of tranexamic acid in minimally invasive total knee replacement: is an additional pre-operative injection effective?[J]. J Bone Joint Surg Br,2012, 94 (7) : 932-6. |
| [2] | Jin SL, Yu BW. Effects of acute hypervolemic fluid infusion of hydroxyethyl starch and gelatin on hemostasis and possible mechanisms[J]. Clin Appl Thromb Hemost,2010, 16 (1) : 91-8. DOI: 10.1177/1076029608330474. |
| [3] | Tang J, Wu G, Peng L. Pharmacokinetics of propofol in patients undergoing total hip replacement: effect of acute hypervolemic hemodilution[J]. Anaesthesist,2011, 60 (9) : 835-40. DOI: 10.1007/s00101-011-1907-y. |
| [4] | Chen YQ, Chen Y, Ji CS, et al. Clinical observation of acute hypervolemic hemodilution in scoliosis surgery on children[J]. Zhonghua Yi Xue Za Zhi,2008, 88 (41) : 2901-3. |
| [5] | 王小平, 吴扬哲, 蔡继业, 等. 自体血液回收对患者红细胞膜表面超微结构的影响[J]. 中华麻醉学杂志,2007, 27 (6) : 527-30. |
| [6] | 黄艳, 聂偲, 田玲玲, 等. 用原子力显微镜观察术中失血回收对红细胞形态的影响[J]. 中国病理生理杂志,2012, 28 (2) : 380-4. |
| [7] | 欧珊, 周乐顺, 白树荣, 等. 急性高容血液稀释加术中血液回收对骨科患者的影响[J]. 中华创伤杂志,2013, 29 (3) : 273-7. |
| [8] | 金善良, 叶扬, 于布为. 临床常用液体离体血液稀释对凝血功能的影响[J]. 上海医学,2014, 37 (4) : 292-6. |
| [9] | Watanabe-Nakayama T, Machida S, Harada I, et al. Direct detection of cellular adaptation to local cyclic stretching at the single cell level by atomic force microscopy[J]. Biophys J,2011, 100 (3) : 564-72. DOI: 10.1016/j.bpj.2010.12.3693. |
| [10] | Müller DJ, Dufrêne YF. Atomic force microscopy: a nanoscopic window on the cell surface[J]. Trends Cell Biol,2011, 21 (8) : 461-9. DOI: 10.1016/j.tcb.2011.04.008. |
| [11] | Jin H, Zhong X, Wang Z, et al. Sonodynamic effects of hematoporphyrin monomethyl ether on CNE-2 cells detected by atomic force microscopy[J]. J Cell Biochem,2011, 112 (1) : 169-78. DOI: 10.1002/jcb.22912. |
| [12] | Jin H, Xing X, Zhao H, et al. Detection of erythrocytes influenced by aging and type 2 diabetes using atomic force microscope[J]. Biochem Biophys Res Commun,2010, 391 (4) : 1698-702. DOI: 10.1016/j.bbrc.2009.12.133. |
| [13] | Chen X, Feng L, Jin H, et al. Quantification of the erythrocyte deformability using atomic force microscopy: correlation study of the erythrocyte deformability with atomic force microscopy and hemorheology[J]. Clin Hemorheol Microcirc,2009, 43 (3) : 243-51. |
| [14] | Haas T, Innerhofer P, Klingler A, et al. Re-transfusion of salvaged washed red cells improves clot formation in pigs as measured by rotational thrombelastometry (ROTEM)[J]. Eur J Anaesthesiol,2008, 25 (6) : 473-8. DOI: 10.1017/S0265021508003736. |
| [15] | Mirza AH, Aldlyami E, Bhimarasetty C, et al. The role of peri-operative cell salvage in instrumented anterior correction of thoracolumbar scoliosis: a case-controlled study[J]. Acta Orthop Belg,2009, 75 (1) : 87-93. |
| [16] | Waters JH, Dyga RM, Waters JF, et al. The volume of returned red blood cells in a large blood salvage program: where does it all go?[J]. Transfusion,2011, 51 (10) : 2126-32. DOI: 10.1111/j.1537-2995.2011.03111.x. |
| [17] | Boese CK, Gallo TJ, Weis M, et al. Efficacy and cost-effectiveness of a blood salvage system in primary total knee arthroplasty--a retrospective match-controlled chart review[J]. Iowa Orthop J,2011, 31 : 78-82. |
| [18] | Yazer MH, Waters JH, Elkin KR, et al. A comparison of hemolysis and red cell mechanical fragility in blood collected with different cell salvage suction devices[J]. Transfusion,2008, 48 (6) : 1188-91. DOI: 10.1111/j.1537-2995.2008.01670.x. |
| [19] | Gueye PM, Bertrand F, Duportail G, et al. Extracellular haemoglobin, oxidative stress and quality of red blood cells relative to perioperative blood salvage[J]. Clin Chem Lab Med,2010, 48 (5) : 677-83. |
| [20] | Lekka M, Laidler P. Applicability of AFM in cancer detection[J]. Nat Nanotechnol,2009, 4 (2) : 72-3. DOI: 10.1038/nnano.2009.036. |
| [21] | Yang ZJ, Price CD, Bosco G, et al. The effect of isovolemic hemodilution with oxycyte, a perfluorocarbon emulsion, on cerebral blood flow in rats[J]. PLoS One,2008, 3 (4) : e2010. DOI: 10.1371/journal.pone.0002010. |
| [22] | Gravante G, Ong SL, Metcalfe MS, et al. Effects of hypoxia due to isovolemic hemodilution on an ex vivo normothermic perfused liver model[J]. J Surg Res,2010, 160 (1) : 73-80. DOI: 10.1016/j.jss.2008.09.024. |
 2015, Vol. 35
2015, Vol. 35