2. 西安交通大学医学院第二附属医院 病理科,陕西 西安 710004
2. Department of Pathology, Second Affiliated Hospital of Xian Jiaotong Uniersity College of Medicine, Xi'an 710004, China
自1991年Hamlyn等[1]从人的血浆中提纯,并且运用质谱、高效液相色谱和生物免疫学等方法证实这种内源性洋地黄物质与哇巴因在分子结构、理化性质、生物学特征相一致以来,内源性哇巴因(endogenoue ouabain, EO)的研究倍受学者们的关注。随后,越来越多的研究资料结果显示,EO在高血压病的发生,发展中起到重要的作用[2-4]。但是,其确切的作用机制尚未阐明。大多数的学者认为,EO是一种来源于肾上腺的新的肾上腺激素[1, 5-6]。研究结果也提示,血浆EO可能是与细胞膜钠泵上的强心苷结合位点结合,致使钠泵的转运活动受到了抑制,进而使细胞内Na+浓度出现升高,激活了钠钙交换器(NCX)的转运,使细胞内Ca2+浓度出现升高,进而滑面内质网(smooth endoplasmic reticulum, S/ER)摄取及储存更多的Ca2+,致使细胞内Ca2+信号增强,最终引起相应的生物学效应[3-4, 7-8]。近几年来还有学者提出,EO可以影响肾小管重吸收功能,导致肾脏排钠障碍,进而导致血压升高[9-11]。本课题组的以往的研究结果也提示EO可以改变细胞钠泵的活性,并且与血压升高密切相关[12-14]。因此,本课题组在原有研究的基础上,拟采用体外细胞学实验方法,进一步探讨哇巴因对血管平滑肌细胞内Ca2+浓度的影响,结果可能为高血压的发病机理和治疗提供科学的实验依据。
1 研究材料和方法 1.1 主要试剂和仪器成年雄性SD大鼠1只,6周龄,体质量150 g,购于西安交通大学医学院实验动物中心;3H-ouabain购自美国Sigma公司;D-MEM/F-12培养基、胎牛血清(FBS)购自Hyclone公司;Fluo3-AM购自北京泛博生物化学有限公司;a-SM-actin单克隆抗体、SP免疫组化染色试剂盒均系福州迈新生物技术开发有限公司产品。倒置显微镜系上海沪杏光学仪器有限公司(XSP-19CP);倒置荧光显微镜系德国Leica(DMI30008);多功能酶标仪系瑞士Tecan(Infinite -M200)。
1.2 大鼠胸主动脉血管平滑肌细胞的原代培养、传代培养及鉴定采用脊椎脱臼法迅速处死SD大鼠,暴露出胸腔,沿胸主动脉于主动脉弓处剪断血管。取出血管后迅速转移置于盛有预冷Hanks液的培养皿中,充分洗涤,剥除结缔组织和脂肪。然后纵向剖开血管,去除内皮,将血管剪成1 mm×1 min大小的组织块。将组织块平均分散到12孔培养板的3孔中,再用眼科直镊将组织块完全铺展开来,组织块间距约2~3 mm,盖上培养板盖将培养板翻扣过来,放入37 ℃,5% CO2细胞培养箱2~3 h。前4 d绝对静置,第5天后首次换液。每3~5 d换液1次。当培养板中的细胞长到80%即可传代。每孔加入0.5 mL/孔0.25%胰蛋白酶+0.02% EDTA,置于37 ℃,5% CO2培养箱中2~4 min,加入1.5 mL Hanks液,然后将细胞悬液转移到离心管,1000 r/min×5 min离心,离心,弃上清液,加入适量20% FBS的DMEM培养基,按照1:2或1:3的标准传代培养。本研究根据血管平滑肌细胞的形态学特征,在倒置显微镜下观察细胞的生长规律和形态。选用特异性a-肌动蛋白(a-SM-actin)单克隆抗体对细胞进行免疫组织化学鉴定(按SP试剂盒说明书),设立阴性对照。
1.3 放射自显影术检测哇巴因与VSMCs的结合能力 1.3.1 饱和实验将生长状态良好的细胞,用0.25%胰酶消化,离心,重悬,计数,向每个反应管中加入等量的细胞悬液,在总结合管中加入不同浓度3H-哇巴因(0.1、1、10 nmol/L),在其对应的非特异结合管中先加入固定浓度未标记哇巴因(0.1 mmol/L),然后再加入不同浓度3H-哇巴因,加入DMEM至200 μL。混匀,37 ℃,5% CO2培养箱孵育150 min,加入冰冷的PBS缓冲液终止反应,1500 r/min×5 min离心,共3次,弃上清液,10%的福尔马林溶液固定细胞,3000 r/min×5 min离心,弃上清液,将管底的细胞团块转移到滤纸片上,60 ℃ 30 min烘干,然后紧贴感光胶片,曝光,显影,定影,冲洗胶片。
1.3.2 竞争实验将生长状态良好的细胞,用0.25%胰酶消化,离心,重悬,计数,向每个反应管中加入等量的细胞悬液,在每管中加入固定浓度3H-哇巴因(50 nmol/L),然后分别加入未标记哇巴因(终浓度为2、4、6、8、10 μmol/L),加入DMEM至200 μL。余操作同饱和实验。
1.4 Fluo 3-AM检测VSMCs内Ca2+浓度 1.4.1 哇巴因是VSMCs内Ca2+浓度的变化在96孔黑色培养板中培养VSMCs细胞,细胞生长至指数生长期后,弃上清,加入等体积的不同浓度哇巴因(哇巴因的浓度分别为:6.25、12.5、25、50、100、200、400、800、1600、3200 nmol/L),总反应体积为200 μL,混匀,37℃,5% CO2细胞培养箱孵育60min,弃上清液,Hanks液冲洗2次,加入30 μL Fluo3-AM工作液(空白对照除外),37 ℃,5% CO2培养箱孵育50 min,Hanks液2次,10%福尔马林溶液固定,infinite M200Pro多功能酶标仪检测荧光强度,倒置荧光显微镜观察。常规设置空白、阴性对照。
1.4.2 钠泵截断性片段对哇巴因引起的VSMCs内Ca2+浓度的变化在96孔黑色培养板中培养VSMCs细胞至指数生长期后,弃上清,加入含等量的哇巴因(10 nmol/L)细胞培养液100 μL,同时分别加入不同量的钠泵α2亚单位截断性片段溶液(终浓度分别为0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.40 mg/mL),37 ℃,5% CO2培养箱孵育30 min后,弃上清液,加入30 μL Fluo3-AM工作液,37 ℃,5% CO2培养箱孵育50 min,弃上清液,37 ℃,5% CO2培养箱孵育50 min,Hanks液2次,10%福尔马林溶液固定,加入适量PBS,重悬,infinite M200Pro多功能酶标仪检测荧光强度,倒置荧光显微镜观察。常规设置空白、阴性对照。
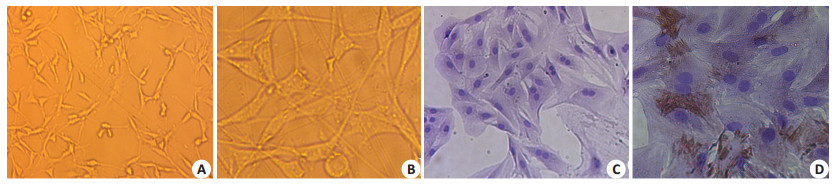
2 结果 2.1 大鼠胸主动脉血管平滑肌细胞的培养及鉴定在倒置显微镜下可见原代平滑肌细胞呈现出不同的形态,有长梭形、不规则和三角形等,细胞浆较为丰富,细胞核居中,细胞折光性强,当细胞致密生长时呈“峰-谷”样结构(图 1A、B)。同时,采用平滑肌细胞特异性a-平滑肌-肌动蛋白(a-SM-actin)抗体对VSMCs进行免疫组织化学鉴定,结果显示:细胞核居中,而胞浆内有棕褐色阳性颗粒(图 1C、D),即表达VSMCs的特征性标志物a-SM-actin。
|
图 1 VSMCs的原代培养及免疫组织化学鉴定a-SM-actin的表达 Figure 1 VSMCs in primary culture and their identification by immunochemistry. A: Variable morphologies of the primary VSMCs. Most of the cells present with an elongate fusiform morphology, but some appear irregular or triangular (Original magnification: × 40); B: Cell nuclei of the primary VSMCs reside in the center of the cells (Original magnification: ×100). C: Negative control (Original magnification: × 100). D: Positive expression of α-SM-actin. |
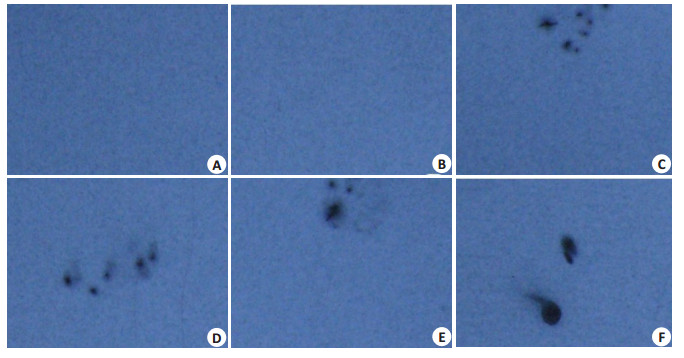
结果显示:当3H-哇巴因浓度为0.1 nmol/L,在其对应的胶片上均未发现任何显影;当3H-哇巴因浓度为1.0 nmol/L,不论在总结合管以及非特异结合管所对应的胶片上均出现了点状灰色显影;当3H-哇巴因浓度增高至10 nmol/L时,在总结合管以及非特异结合管所对应的胶片出现了黑色团状阴影(图 2)。提示随着3H-哇巴因浓度的增加,VSMCs结合的3H-哇巴因数量增加。
|
图 2 3H-哇巴因和VSMCs的饱和实验 Figure 2 Saturation experiments of the binding of 3H-ouabain with VSMCs. A, C, E: Total binding of 3H-ouabain with VSMCs. B, D, F: Nonspecific binding of 3H-ouabain with VSMCs. T: total binding. N: non-specific binding. A: 0.1 nmol/L 3H-ouabain, B: 0.1 mmol/L ouabain + 0.1 nmol/L 3H-ouabain, C: 1.0 nmol/L 3H-ouabain; D: 0.1 mmol/L ouabain + 1.0 nmol/L 3H-ouabain; E: 10 nmol/L 3H-ouabain; F: 0.1 mmol/L ouabain + 10 nmol/L 3H-ouabain. The black stains on the film represent 3H-ouabain binding to the cells, which increase with 3H-ouabain concentration. |
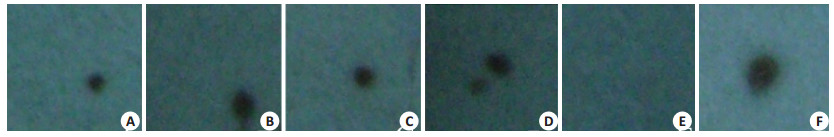
在50 nmol/L 3H-哇巴因存在下,未标记哇巴因浓度为2、4、6、8 μmol/L的实验管所对应的胶片上出现点状黑色阴影,而未标记哇巴因浓度为10 μmol/L的实验管所对应的胶片未出现阴影,提示在3H-哇巴因浓度一定的情况下,随着未标记哇巴因浓度的增加,VSMCs结合的3H-哇巴因数量大致随着未标记哇巴因浓度增加而减少(图 3)
|
图 3 3H-ouabain与ouabain和VSMCs间的竞争实验 Figure 3 Competitive experiments of binding of ouabain and 3H-ouabain with VSMCs. A: 2 μmol/L ouabain+50 nmol/L 3H-ouabain, B: 4 μmol/L ouabain+50 nmol/L 3H-ouabain, C: 6 μmol/L ouabain+50 nmol/L 3H-ouabain, D: 8 μmol/L ouabain+50 nmol/L 3H-ouabain, E: 10 μmol/L ouabain+50 nmol/L 3H-ouabain, F: 50 nmol/L 3H-ouabain. |
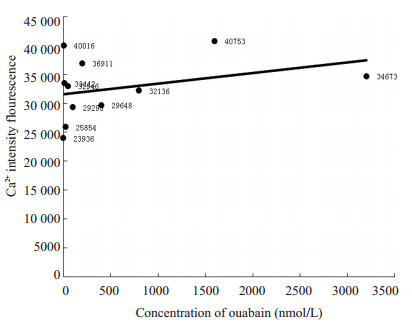
采用多功能酶标仪检测在不同浓度的哇巴因作用下VSMCs内Ca2 +荧光强度的变化情况。实验检测结果显示:当哇巴因浓度在0~3200 nmol/L范围内,随着哇巴因浓度的增加,细胞内Ca2+荧光强度呈现增强趋势(图 4)
|
图 4 不同哇巴因浓度对VSMCs Ca2+荧光强度的影响 Figure 4 Effect of different ouabain concentrations on Ca2+ fluorescence intensity in VSMCs. |
细胞内Ca2+荧光强度呈现实验组>空白对照>阴性对照的趋势。荧光强度越大,说明细胞内负载的Ca2+荧光探针浓度越高,即Ca2+浓度越高。因此,推测实验组细胞内的Ca2+浓度较高。该结果提示:哇巴因能够使VSMCs内Ca2+浓度增加(图 5),并且存在一定范围内的剂量依赖性。
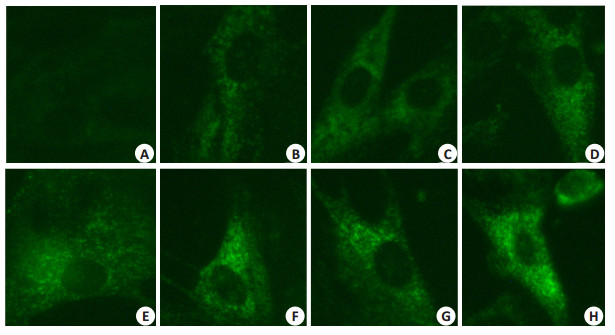
|
图 5 哇巴因对VSMCs内Ca2+荧光强度的影响 Figure 5 Effect of different concentrations of ouabain on Ca2+ fluorescence intensity in VSMCs observed under inverted fluorescence microscope (Original magnification: ×200). A: Blank control; B: Negative control; C-H: 6.25, 12.5, 25, 100, 400, 1600 nmol/L ouabain, respectively. |
结果显示:不同浓度的钠泵α2亚单位截断性片段(0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.40 mg/mL)减弱了哇巴因引起的VSMCs内Ca2+浓度的变化。提示:钠泵α2亚单位截断性片段可以改善或拮抗哇巴因对大鼠血管平滑肌细胞内的钙离子的变化。
3 讨论近年来的研究证实,不论高血压动物模型,还是30~40%原发性和继发性高血压人群血浆中的EO水平均呈现一定程度的升高[2, 15-16]。有研究显示,正常大鼠在正常饮食状态下,通过给予皮下微型渗透泵泵入哇巴因3~4周后,大鼠出现血压增高[2, 4, 9, 15]。除此之外,哇巴因诱导的高血压大鼠的血压能够被哇巴因的拮抗剂Rostafuroxin(PST-2238),地高辛抗体所拮抗[15-17]。本课题组近年来发现的特异性哇巴因结合肽[18],在动物实验中也表现出一定的降低血压的作用。以上研究均表明EO在高血压的发病机制中扮演着一定的角色。
有资料显示,EO与细胞膜钠泵的结合是其发生作用的关键性部位[3, 9, 19-21]。钠泵,即Na+-K+-ATP酶,维持着大多数细胞质低Na+高K+的生理状态,而且在肾脏对Na+的重吸收过程中也发挥关键作用。本研究采用放射自显影术检测哇巴因与血管平滑肌细胞的结合能力。饱和实验结果显示,随着3H-哇巴因浓度的增加,VSMCs结合的3H-哇巴因数量增加(图 2)。竞争实验结果显示,在3H-哇巴因浓度一定的情况下,随着未标记哇巴因浓度的增加,VSMCs结合的3H-哇巴因数量大致随着未标记哇巴因浓度增加而减少(图 3)。但是由于实验条件的限制,对其竞争和饱和实验尚没有做到定量分析,仅获得了一个定性的结果,但是,本实验的结果已经显示哇巴因与VSMCs结合的细胞学基础,为高哇巴因高血压的病理生理机制奠定基础。
Ca2+是一种广泛通用的细胞内信号,参与多种细胞功能的调节。在正常的生理状态下,生物体内的Ca2+处于一种动态平衡状态,即钙稳态,细胞内Ca2+浓度为10 nmol/L~1 μmol/L,而细胞外Ca2+浓度高达1~2 mmol/L,两者相差上千倍,这样的分布状态,与机体内存在参与Ca2+浓度调控的相关结构是分不开的。当然血管平滑肌也不例外,概括起来可分为三类:介导Ca2+内流的离子通道、Ca2+外排的离子通道以及钙库Ca2+释放和重摄取的离子通道,分别介导细胞外Ca2+的内流、细胞内Ca2+外排以及钙库内Ca2+的释放和重摄取的过程。近年来有研究人员提出哇巴因通过调控主要由钠泵和IP3R所构成的微结构域来影响细胞内Ca2+离子浓度,并以钙波和钙振荡的形式表现出来[7, 22]。
本研究采用钙离子荧光探针(Fluo3-AM)来检测不同浓度的哇巴因在短时间内作用于大鼠血管平滑肌细胞,进一步观察细胞内Ca2+的浓度变化。研究结果发现, 哇巴因作用于血管平滑肌细胞,使其内的荧光强度明显增强,而荧光强度强弱间接显示细胞内Ca2+浓度,即:哇巴因作用于VSMCs,使其细胞内Ca2 +的浓度明显升高。荧光定量分析结果还显示,当哇巴因浓度在0~3200 nmol/L范围内,随着哇巴因浓度的增加,细胞内的Ca2+荧光强度大致呈现出增强的趋势(图 4,5)。实验中,一方面可能由于荧光淬灭及检测仪器的误差,影响了其半定量分析的精确性,但是,在一定范围内,哇巴因与细胞内荧光强度呈现增强的趋势。另一方面,从一个侧面反映了在短时间哇巴因作用下细胞内Ca2+浓度是不稳定的,它很可能处于一种动态变化中,也可能如同在此前的一些研究发现,短时间的哇巴因作用使得细胞出现低频的钙振荡[7-8, 10, 22]。结果还显示,在较低浓度(6.25 nmol/L)的哇巴因就能够显著地引起细胞内Ca2+浓度的升高,提示低浓度哇巴因即可使细胞内钙离子升高,这一结果,为哇巴因高血压大鼠动物模型的建立提供了细胞学基础。随后的研究结果也证实钠泵截断性片段可以改善哇巴因对细胞内钙离子的影响(图 6),进一步提示哇巴因与钠泵相结合,并且其结合能力可以被调节,也为其潜在应用价值提供了细胞学基础。
综上所述,该研究是本课题组前期研究的基础上,立足于哇巴因对血管平滑肌细胞内Ca2+的影响,运用细胞放射性自显影技术及钙离子荧光探针方法,进一步证实了哇巴因与细胞间作用后所产生的离子效应,与目前的研究结果基本一致,可能是哇巴因导致血压升高的主要原因,为哇巴因高血压的病理生理学研究以及治疗学都提供了科学的数据,开辟了新的思路,奠定了坚实的基础。
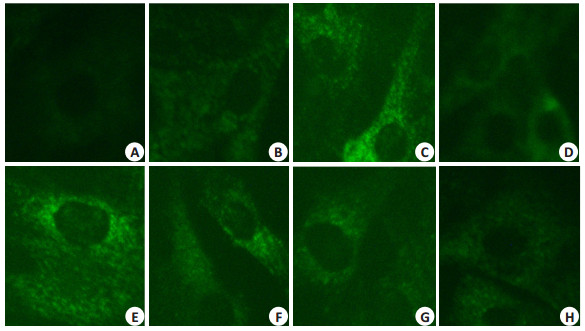
|
图 6 钠泵α2亚单位截断性片段拮抗哇巴因对VSMCs内Ca2+荧光强度的影响 Figure 6 Effect of ouabain and the truncated fragment of sodium pump α2 subunit on Ca2+ fluorescence intensity in VSMCs (Original magnification: ×200). A: Blank control; B: Negative control; C: 10 nmol/L ouabain; D: 0.40 mg/mL of the truncated fragment; E: 10 nmol/L ouabain + 0.05 mg/mL truncated fragment; F: 10 nmol/L ouabain+0.10 mg/mL truncated fragment; G: 10 nmol/L ouabain+0.20 mg/mL truncated fragment; H: 10 nmol/L ouabain+0.40 mg/mL truncated fragment. |
| [1] | Hamlyn JM, Blaustein MP, Bova S, et al. Identification and characterization of a ouabain-like compound from human plasma[J]. Proc Natl Acad Sci USA,1991, 88 (14) : 6259-63. DOI: 10.1073/pnas.88.14.6259. |
| [2] | Bagrov AY, Shapiro JI. Endogenous digitalis: pathophysiologic roles and therapeutic applications[J]. Nat Clin Pract Nephrol,2008, 4 (7) : 378-92. DOI: 10.1038/ncpneph0848. |
| [3] | Hamlyn JM, Blaustein MP. Salt sensitivity, endogenous ouabain and hypertension[J]. Curr Opin Nephrol Hypertens,2013, 22 (1) : 51-8. |
| [4] | Hamlyn JM, Manunta P. Endogenous ouabain: a Link between Sodium intake and hypertension[J]. Curr Hypertens Rep,2011, 13 (1) : 14-20. DOI: 10.1007/s11906-010-0161-z. |
| [5] | Schoner W. Ouabain, a new steroid hormone of adrenal gland and hypothalamus[J]. Exp Clin Endocrinol Diabetes,2000, 108 (7) : 449-54. DOI: 10.1055/s-2000-8140. |
| [6] | Zhang MJ, Lu ZR, Yang J, et al. Expression of endogenous ouabain in multiple adrenal tumors[J]. J Xi'an Medical University,2001, 13 (2) : 110-2. |
| [7] | 于丁, 石晓路, 李军霞, 等. 哇巴因对心肌细胞钙瞬变及收缩力的作用[J]. 中国药理学通报,2011, 27 (5) : 691-4. |
| [8] | Fontana JM, Burlaka I, Khodus G, et al. Calcium oscillations triggered by cardiotonic steroids[J]. FEBS J,2013, 280 (21) : 5450-5. DOI: 10.1111/febs.12448. |
| [9] | Manunta P, Messaggio E, Casamassima N, et al. Endogenous ouabain in renal Na (+) handling and related diseases[J]. Biochim Biophys Acta,2010, 1802 (12) : 1214-8. DOI: 10.1016/j.bbadis.2010.03.001. |
| [10] | Khodus GR, Kruusmägi M, Li J, et al. Calcium signaling triggered by ouabain protects the embryonic kidney from adverse developmental programming[J]. Pediatr Nephrol,2011, 26 (9) : 1479-82. DOI: 10.1007/s00467-011-1816-y. |
| [11] | Manunta P, Ferrandi M, Messaggio E, et al. A new antihypertensive agent that antagonizes the prohypertensive effect of endogenous ouabain and adducin[J]. Cardiovasc Hematol Agents Med Chem,2006, 4 (1) : 61-6. DOI: 10.2174/187152506775268811. |
| [12] | 原卫清, 王颢, 吕卓人, 等. 一肾一夹"高血压大鼠肾脏皮质钠泵α亚单位的基因表达[J]. 中国病理生理杂志,2001, 17 (1) : 46-9. |
| [13] | Wang H, Yuan W, Lu Z. Effects of ouabain and digoxin on gene expression of Sodium pump alpha-subunit isoforms in rat myocardium[J]. Chin Med J,2001, 114 (10) : 1055-9. |
| [14] | Ren YP, Zhang MJ, Zhang T, et al. Dual effects of ouabain on the regulation of proliferation and apoptosis in human umbilical vein endothelial cells: involvement of Na (+)-K (+)-ATPase α-subunits and NF-κB[J]. Int J Clin Exp Med,2014, 7 (5) : 1214-22. |
| [15] | Ferrari P, Torielli L, Ferrandi M, et al. PST2238: a new antihypertensive compound that antagonizes the long-term pressor effect of ouabain[J]. J Pharmacol Exp Ther,1998, 285 (1) : 83-94. |
| [16] | Ferrari P. Rostafuroxin: an ouabain-inhibitor counteracting specific forms of hypertension[J]. Biochim Biophys Acta,2010, 1802 (12) : 1254-8. DOI: 10.1016/j.bbadis.2010.01.009. |
| [17] | Song H, Karashima E, Hamlyn JM, et al. Ouabain-digoxin antagonism in rat arteries and neurones[J]. J Physiol,2014, 592 (Pt 5) : 941-69. |
| [18] | Ferrandi M, Molinari I, Rastaldi MP, et al. Rostafuroxin protects from podocyte injury and proteinuria induced by adducin genetic variants and ouabain[J]. J Pharmacol Exp Ther,2014, 351 (2) : 278-87. DOI: 10.1124/jpet.114.217133. |
| [19] | Lingrel JB. The physiological significance of the cardiotonic steroid/ ouabain-binding site of the Na, K-ATPase[J]. Annu Rev Physiol,2010, 72 : 395-412. DOI: 10.1146/annurev-physiol-021909-135725. |
| [20] | 李成浩, 商黔惠, 姜黔峰, 等. 哇巴因对自发性高血压大鼠和Wistar-Kyoto大鼠动脉平滑肌细胞钠泵基因表达的影响[J]. 中华高血压杂志,2010, 18 (6) : 559-64. |
| [21] | 张明娟, 杨军, 朱参战, 等. 采用In-fusion技术表达, 纯化钠泵a3亚单位膜外区截断性片段[J]. 四川大学学报:医学版,2009, 40 (2) : 203-7. |
| [22] | Tian J, Xie ZJ. The Na-K-ATPase and calcium-signaling microdomains[J]. Physiology (Bethesda),2008, 23 (4) : 205-11. DOI: 10.1152/physiol.00008.2008. |
 2015, Vol. 35
2015, Vol. 35