2. 中南大学肿瘤研究所,教育部重点实 验室,湖南 长沙 410078 ;
3. 中南大学湘雅医院 肿瘤科,湖南 长沙 410008 ;
4. 中南大学湘雅医院 分子医学中心,湖南 长沙 410008
2. Department of Radiology, Xiangya Hospital, Central South University, Changsha 410008, China ;
3. Department of Oncology, Xiangya Hospital, Central South University, Changsha 410008, China ;
4. Center for Molecular Medicine, Xiangya Hospital, Central South University, Changsha 410008, China
鼻咽癌好发于东南亚,尽管放、化疗效果较好,但部分鼻咽癌仍对放疗或放、化疗抗拒,导致肿瘤残留、复发或转移,预后较差,探讨新的生物学靶标将有助于制定个体化的诊断、治疗方案和及时调整治疗方案。T1WI动态增强MRI(DCE-MRI)通过追踪观察静脉内注射对比剂通过血管的过程,分析动态增强的时间-信号强度曲线,可以获得反映肿瘤血管的动力学参数。目前对DCE-MRI的信号变化的后处理有定性、半定量或定量分析三种方法。定性方法仅分析时间一信号强度曲线形态,半定量方法计算时间一信号强度曲线获得多种指标如:曲线下面积(AUC)等,这些方法均不能精确反映组织内的对比剂浓度,参数与组织生理和对比剂动力学的关系不明确,且易受扫描仪影响[1-3]。定量方法运用药物动力学模型技术,对时间-浓度曲线进行数学拟合,演算出各种能反映肿瘤血管结构和功能的各种定量参数[4-6],其中Ktrans值作为肿瘤血流的标志物已经获得公认[7-8],并被美国国立癌症研究所(US NCI)推荐为抗癌治疗试验的主要观察终点之一[9],并将Ktrans值作为预测放疗疗效的指标。以往的研究多为横断面研究,即仅选择治疗前、治疗中或治疗后的Ktrans值为观测指标[10]。本文旨在纵向研究鼻咽癌治疗前、治疗中或治疗结束时各DCE-MRI定量血流动力学参数的变化及其对预后评估的价值。
1 资料与方法 1.1 患者湘雅医院自2007年3月~2009年4月鼻咽癌患者24例。患者年龄31~64岁,其中男17例,女7例。全部取活检组织病理切片均由两位副教授或以上病理医生阅读,按WHO标准病理分型全部为低分化鳞状上皮细胞癌。按第六版UICC/AJCC分期系统标准进行分期[11],Ⅱ期15例(T2aN0M0 3例,T1N1M0 5例,T2aN1M0 5例,T2bN0M0 2例),Ⅲ期6例(T2bN2M0 2例, T3N0M0 1例,T3N1M0 3例),Ⅳa期3例(T4N0M0 1例,T4N1M0 2例)。
1.2 放射治疗方法所有患者均给予根治性放疗,头颈部热塑记忆体膜固定体位,在模拟定位机下摄片定位,根据其磁共振图象制定设野计划,使用不规则挡铅的适形放疗。采用6MV-X线常规分割照射,5次/周,2 Gy/次,连续放射治疗7周,总剂量为70 Gy。
1.3 MRI检查方法患者分别于放疗前1~2 d(Pre-RT)、放射剂量为50 Gy时(RT 50 Gy)和放疗结束时(RT 70 Gy)进行常规MRI和DCE-MRI扫描。采用德国西门子Sonata 1.5T超导型磁共振仪(Syngo MR 2002B, SIEMENS)和标准头部线圈,患者均采用仰卧位头侧先进。
MRI常规扫描:T2加权成像(T2WI)采用快速自旋回波(TSE)序列,重复时间(TR)为4200 ms,回波时间(TE)为98 ms;T1加权成像(T1WI)采用自旋回波(SE)序列,TR为450 ms,TE为10 ms;层厚5 mm,间隔参数0.30,层数为19,FOV为240×195,矩阵为256×208。
DCE-MRI:MRI常规扫描开始前即于足背静脉置入静脉留置针。采用TurboFLASH成像序列行DCE-MRI,参考横断位T2WI图像,选取病灶最大层面为中心扫描。扫描参数为: TR/TE为199 ms/1.05 ms,TI为100 ms,FOV为260 mm×210 mm,矩阵128×96,翻转角度200,层厚为6 mm,间距1.2 mm,层数为10,时间分辨率为4 s,共90个时相,成像时间共360 s。扫描至第5个时相结束时开始用高压注射器经肘前静脉团注Gd-DTPA (总量为0.2 mmol/kg,速率为4 mL/s),团注结束后再注入等容积生理盐水冲洗导管;最后行常规增强的横断位、矢状位、冠状位T1WI检查,增强扫描采用脂肪抑制T1WI。
1.4 DCE-MRI数据后处理,计算Ktrans值、Kep值、Ve值采用nordicICE(版本2.3.6)软件对原始DCE-MRI原始数据进行后处理,处理步骤如下:利用软件自动设定时间-信号强度曲线的基线范围、时间分辨率等;运用聚类分析技术自动确定同侧颈总动脉(约5个像素大小)为感兴趣区(ROI),以该ROI的时间-信号强度曲线为动脉流入函数(AIF);以两腔室模型为基础,采用动脉流入函数动力学矫正分析的去卷积技术计算出反映血管通透性和血管内、外间隙容积的各种定量参数。Ktrans值:对比剂由血浆转移至血管外细胞外间隙(extravascular, extracellular space, EES)的容积转运常数,单位为(1/min)。kep值:对比剂由EES转移至血浆的速度常数。Ve值:对比剂在EES的分布容积(等同于EES)。重建各种参数图,参照增强T1WI横断位图像上选择肿瘤最大层面,勾画整个肿瘤组织为ROI,计算出肿瘤Ktrans (1/miute),取相同的ROI分别计算出其它定量参数值。
1.5 疗效评价近期疗效评价:分别于放疗前Pre-RT和放疗中RT 50 Gy时的增强扫描T1WI横断位图像上选择肿瘤最大层面,勾画整个肿瘤面积,计算放疗中RT 50 Gy时的肿瘤消退率(RS0-50),公式为(Pre-RT面积-RT 50 Gy面积)/Pre-RT面积×100%。
远期疗效评价:采用查阅病案、电话随访的方式进行随访。
1.6 统计学方法所有数据用均数±标准差表示。使用SPSS11.5统计软件分析:两样本均数的比较采用t检验;多个样本间两两比较采用方差分析的q检验;相关性研究采用Pearson方法。P < 0.05认为有统计学意义;P < 0.01认为有显著统计学差异。
2 结果 2.1 鼻咽癌肿瘤组织DCE-MRI时间-信号强度曲线类型及各类型间定量参数(Ktrans值、Kep值、Ve值)的比较24例鼻咽癌DCE-MRI时间-信号强度曲线类型分别为:Ⅰ型曲线为快速强化达到高峰后,对比剂快速清除,即“速升下降”型,共8例;Ⅱ型曲线为快速强化达到高峰后,对比剂缓慢清除,信号强度达到高峰后变化幅度小于波峰高度的10%,即“速升平台”型,共10例;Ⅲ型曲线为缓慢持续强化,即“逐渐上升”型[12],共6例。大部分肿瘤为Ⅰ型和Ⅱ型曲线,于30~50 s左右快速强化达到高峰,少部分肿瘤的时间-信号强度曲线为缓慢持续强化。
三种不同类型强化曲线的鼻咽癌的Ktrans、kep、Ve值比较见表 1,结果显示,Ⅲ型曲线肿瘤的kep明显低于其它两类肿瘤,其余大多数参数的差别无统计学意义。
| 表 1 不同类型时间-信号强度曲线的鼻咽癌各DCE-MRI定量参数比较 Table 1 Comparison of DCE-MRI quantitative parameters among NPC patients with different types of time-signal intensity curve (Mean±SD) |
放疗中、放疗结束时肿瘤实质Ktrans值、Kep值均呈逐渐下降趋势,而Ve值呈上升趋势。放疗结束时肿瘤实质的Ktrans值与放疗前的差别有统计学意义。放疗中、放疗结束时肿瘤实质的Kep、Ve值即与放疗前的差别有统计学意义(采用q检验,表 2)
| 表 2 放疗中、放疗结束时肿瘤实质Ktrans值、Kep值、Ve值分别与放疗前的比较 Table 2 Comparison of Ktrans, kep, Ve values between Pre-RT and RT (50 Gy), RT (70 Gy) |
放射治疗中(50 Gy),RS0-50为9.12%~98.10%。RS0-50与放疗前肿瘤组织的Ktrans值呈正相关,r为0.569,P值为0.005,与放疗中RT(50 Gy)肿瘤组织的Ktrans值呈负相关,r为-0.717,P值为0.001,与放疗前的K ep值、Ve值无明显相关,P值均大于0.05。图 1显示高肿瘤消退率患者放疗中RT(50 Gy)时Ktrans值下降明显,图 2显示低肿瘤消退率患者放疗中RT(50 Gy)时Ktrans值变化不明显。
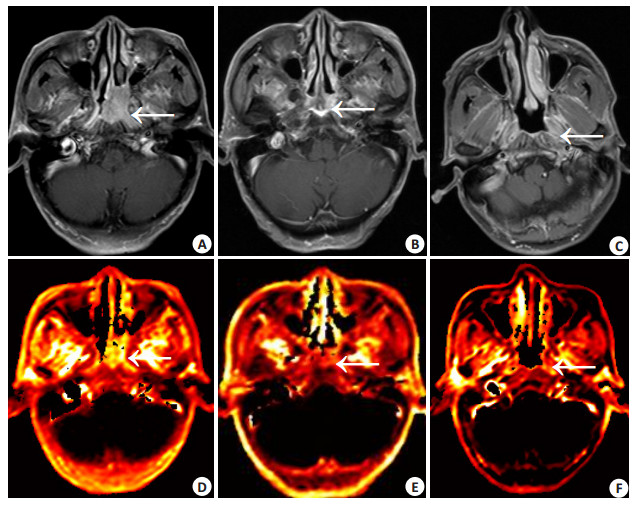
|
图 1 高肿瘤消退率患者,Ktrans值的变化 Figure 1 Changes of Ktrans value in patients with high regression rate. Contrast-enhanced and fat-suppression T1-weighted images for the pre-RT (A), RT 50 Gy (B) and RT 70 Gy (C). Tumor with homogeneous enhancement (arrows) was observed on the left side, and the CRS0-50 was 89.03%. Ktrans maps for the pre-RT (D), RT 50 Gy (E) and RT 70 Gy timepoints (F) showed that Ktrans value of the tumor decreased significantly from 0.2662 (1/min) for pre-RT to 0.1071 (1/min) for RT 50 Gy and 0.0497 (1/min) for RT 70 Gy. |
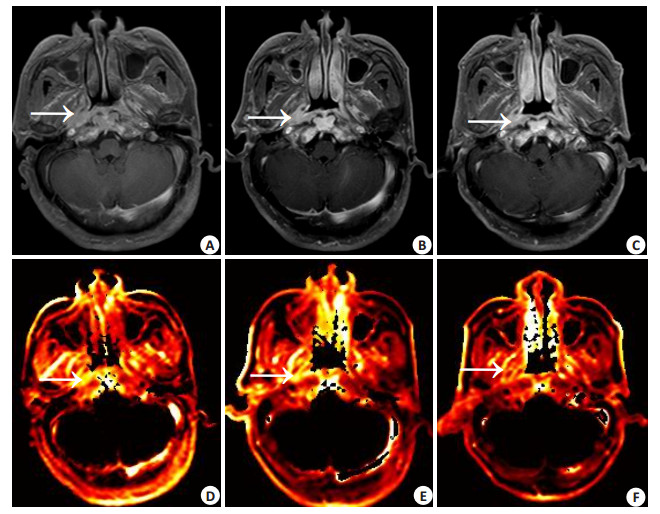
|
图 2 低肿瘤消退率患者,Ktrans值的变化 Figure 2 Changes of Ktrans value in patients with a low regression rate. Contrast-enhanced and fat-suppression T1-weighted images for the pre-RT (A), RT 50 Gy (B) and RT 70 Gy (C). Tumor with homogeneous enhancement (arrows) was observed on the right side, and the CRS0-50 was 32.10%. Ktrans maps for the pre-RT (D), RT 50 Gy (E) and RT 70 Gy (F) showed that Ktrans value of the tumor decreased mildly from 0.1891 (1/min) for pre-RT to 0.1622 (1/min) for RT 50 Gy and 0.1429 (1/min) for RT 70 Gy. |
2.4患者随访结果与放疗结束时Ktrans值、Kep值、Ve值的关系
所有患者随访均超过3年,失访1例,失访率为4.2%。全组共有5例患者为肿瘤所致死亡,3例出现远处转移,其中2例为骨转移,1例为肺转移。比较死亡、转移病例与其他患者放疗结束后的Ktrans值、Kep值、Ve值的差异均无统计学意义(P值分别为0.071、0.122、0.895)。
3 讨论团注的小分子钆螯合物顺磁性对比剂(相对分子质量小于千道尔顿 < 1000)首过肿瘤组织毛细血管床时,约12%~45%能以一定的速率渗漏至达EES,缩短T1效应,使信号增高、T1变化率与局部组织对比剂浓度相关,采用T1WI DCE-MRI获得包括对比剂静脉注入前、注入中和注入后的一系列图像,运用合适的药物动力学模型技术,对时间-浓度曲线进行数学拟合,演算出定量动力学参数。定量分析通常采用的动力学模型有单腔室和双腔室两种,本研究采用的是Tofts等[13]提出的双腔室动力学模型,该模型目前应用较广,双腔室分别代表微血管和血管外组织间隙,采用AIF动力学矫正分析的去卷积技术,重复性好,通过探测信号和分割,并结合动脉解剖结构、流体动力学、DCE-MRI时间分辨率,该方法过程可以节约时间,并能去处操作者间固有的误差,提高肿瘤治疗前后动态参数的可比性[14-15]。获得的参数如:Ktrans是指对比剂从血管内向EES的容积转运常数,主要与血流灌注和血管通透性有关,kep是对比剂由EES转移至血浆的速度常数。Ve是对比剂在EES的分布容积。根据质量守恒原理,Ktrans=kep·Ve[13]。
Ktrans值是对比剂由血浆转移至EES的容积转运常数,是肿瘤血流、内皮表面积和内皮通透性的复杂函数。Ktrans值的解释依赖于要评估的组织类型和潜在的生理学环境,当血管通透性非常高的组织,对比剂渗漏至EES几乎不受限,此时血流灌注是决定对比剂动力学的主要因素,Ktrans值大致等于单位体积组织的血流灌注[13]。国外研究已经将Ktrans值作为预测放疗疗效的指标,George ML研究显示直肠癌治疗前的Ktrans值与疗效有关,高Ktrans值提示疗效好[15]。研究显示头颈部癌放疗敏感组患者治疗前Ktrans值高于疗效中间组,且差异存在统计学意义[17-18];Chawla等[19]研究发现,头颈部鳞癌放疗有效组原发肿瘤及转移病灶Ktrans值高于无效组,但差异无统计学意义。
放射治疗的辐射使肿瘤组织毛细血管壁肿胀、变性、坏死,管腔变窄,血栓形成导致血流灌注减少和血管渗漏性降低,甚至局部纤维化,因此降低Ktrans值[20]。但是不同的肿瘤组织对放疗的敏感性并不一致,本研究也显示放疗中(50 Gy),肿瘤组织的Ktrans值虽然下降,但尚无统计学意义,提示不同个体肿瘤组织对同一放射治疗方案的反应可能存在差异。放射线照射肿瘤组织时,在富氧状态下能够形成更多的氢氧自由基,从而增强放射线对肿瘤细胞DNA的损伤。研究显示富氧状态下肿瘤细胞的放疗敏感性是乏氧状态下的3~5倍[21-22]。
本研究显示RT 50 Gy时的肿瘤消退率与治疗前肿瘤组织的Ktrans值呈正相关,是由于肿瘤区域血供丰富,而且血管通透性高,微循环含氧血量高,氧弥散不受阻碍,局部组织含氧量高,对放疗更为敏感,而低灌注的肿瘤区域血供少,含氧量低,容易发生放疗抗拒。治疗前肿瘤组织的Ktrans值能够反映血流灌注及组织氧合状态,可评估鼻咽癌肿瘤放疗敏感性。RT 50 Gy时的肿瘤消退率与RT 50 Gy时肿瘤组织的Ktrans值呈负相关,提示放疗敏感的肿瘤组织其Ktrans值下降也较快,放射治疗除了使肿瘤组织毛细血管损伤导致血流灌注下降外,其杀死肿瘤细胞会导致血管抑制。放疗前肿瘤组织的高Ktrans值及RT 50 Gy时Ktrans值下降明显均提示放射治疗敏感,可作为鼻咽癌放疗早期疗效评估指标。
放疗结束时RT 70 Gy时肿瘤组织的Ktrans值进一步下降,提示放射治疗晚期肿瘤组织的血管通透性下降,对比剂渗漏至血管外很少甚至无渗漏,这时血管通透性是决定Ktrans值的主要因素,Ktrans值接近于血管渗透性和渗漏表面积的乘积,且明显低于放疗前。追踪随访发现4例死亡患者和3例转移患者RT 70 Gy时肿瘤组织的Ktrans值与其他患者的差别无统计学意义,分析原因可能为:本研究的Ktrans值为整层肿瘤组织所有像素的平均值,并没有考虑Ktrans值的异质性分布,尤其是放射治疗晚期肿瘤复发、残留区域与肿瘤坏死、纤维化可能并存,部分肿瘤组织异质性可能更加明显;患者预后影响因素很多,Ktrans值可能只是预后的因素之一。探讨放射治疗结束后肿瘤组织Ktrans值的异质性与患者预后的关系将是我们下一步研究内容。
k ep和Ve被文献推荐为肿瘤治疗试验的次要观察终点[23]。kep是指对比剂由EES转移至血浆的速度常数,放射治疗后肿瘤组织血流灌注减少和血管渗漏性降低,对比剂由EES转移至血浆的速度会减慢,故不难理解放射治疗后的kep值的下降。Ve是指对比剂在EES的分布容积,等同于EES。本研究显示全部病例治疗后的肿瘤组织的Ve值出现不同程度增高,这可能与由于放射治疗后肿瘤细胞减少、细胞密度减低、间质成分相对增加而、细胞外血管外间隙的增加有关,放疗后血管渗透性减低可导致对比剂缓慢和长时间的积聚可能也是导致Ve值升高的原因[22-23]。也有文献认为两腔室模型是假定组织血流灌注好,因此不适合分析肿瘤坏死区域[13],本研究也显示两者与肿瘤消退率的无明显相关性。
采用规范的DCE-MRI方法,以两腔室模型为基础,运用动脉流入函数动力学去卷积技术,可以获得DCE-MRI定量动力学参数(Ktrans、kep、Ve)。鼻咽癌放疗过程中DCE-MRI各定量血流动力学参数变化明显,DCE-MRI定量动力学参数可无创性监测鼻咽癌放射治疗过程中肿瘤血管生成和血管通透性的改变。放疗前和放疗中肿瘤组织Ktrans值可作为鼻咽癌放疗早期疗效评估指标,为鼻咽癌个体化治疗和治疗方案修正提供依据。鼻咽癌放疗远期疗效与Ktrans值的关系需进一步研究。
| [1] | Takashima S, Noguchi Y, Okumura T, et al. Dynamic Mr imaging in the head and neck[J]. Radiology,1993, 189 (3) : 813-9. DOI: 10.1148/radiology.189.3.8234709. |
| [2] | 胡丽霞, 朱进, 周阳泱, 等. 鼻咽癌动态增强MRI参数与临床病理特征的关系[J]. 中国医学影像技术,2014, 30 (4) : 514-7. |
| [3] | 林蒙, 余小多, 李琳, 等. MRI动态增强对鼻咽癌同步放化疗敏感性的预测研究[J]. 临床放射学杂志,2014, 33 (5) : 689-94. |
| [4] | O'connor JP, Jackson A, Parker GJ, et al. DCE-MRI biomarkers in the clinical evaluation of antiangiogenic and vascular disrupting agents[J]. Br J Cancer,2007, 96 (2) : 189-95. DOI: 10.1038/sj.bjc.6603515. |
| [5] | Bajpai J, Gamanagatti S, Sharma MC, et al. Noninvasive imaging surrogate of angiogenesis in osteosarcoma[J]. Pediatr Blood Cancer,2010, 54 (4) : 526-31. |
| [6] | Wu X, Jeong EK, Emerson L, et al. Noninvasive evaluation of antiangiogenic effect in a mouse tumor model by DCE-MRI with Gd-DTPA cystamine copolymers[J]. Mol Pharm,2010, 7 (1) : 41-8. DOI: 10.1021/mp900153f. |
| [7] | Jackson A, O'connor JP, Parker GJ. Imaging tumor vascular heterogeneity and angiogenesis using dynamic contrast-enhanced magnetic resonance imaging[J]. Clin Cancer Res,2007, 13 (12) : 3449-59. DOI: 10.1158/1078-0432.CCR-07-0238. |
| [8] | Zweifel M, Padhani AR. Perfusion MRI in the early clinical development of antivascular drugs: decorations or decision making tools[J]. Eur J Nucl Med Mol Imaging,2010 : S164-82. |
| [9] | NCI, CIP, MR. Workshop on translational research in cancer: recommendations for MR measurement methods at 1·5-Tesla and endpoints for use in phase 1/2a trials of anti-cancer therapeutics affecting tumor vascular function// [C], 2006. |
| [10] | Zahra MA, Hollingsworth KG, Sala E, et al. Dynamic contrastenhanced MRI as a predictor of tumour response to radiotherapy[J]. Lancet Oncol,2007, 8 (1) : 63-74. DOI: 10.1016/S1470-2045(06)71012-9. |
| [11] | Kalogera-Fountzila A, Karanikolas D, Katodritis N, et al. Prognostic factors and significance of the revised 6th edition of the AJCC classification in patients with locally advanced nasopharyngeal carcinoma[J]. Strahlenther Onkol,2006, 182 (8) : 458-66. DOI: 10.1007/s00066-006-1538-4. |
| [12] | Kuhl CK, Mielcareck P, Klaschik S, et al. Dynamic breast Mr imaging: are signal intensity time course data useful for differential diagnosis of enhancing lesions[J]. Radiology,1999, 211 (1) : 101-10. DOI: 10.1148/radiology.211.1.r99ap38101. |
| [13] | Tofts PS, Brix G, Buckley DL, et al. Estimating kinetic parameters from dynamic contrast-enhanced T (1)-weighted MRI of a diffusable tracer: standardized quantities and symbols[J]. J Magn Reson Imaging,1999, 10 (3) : 223-32. DOI: 10.1002/(ISSN)1522-2586. |
| [14] | Wilkinson ID, Jellineck DA, Levy D, et al. Dexamethasone and enhancing solitary cerebral mass lesions: alterations in perfusion and blood-tumor barrier kinetics shown by magnetic resonance imaging[J]. Neurosurgery,2006, 58 (4) : 640-6. DOI: 10.1227/01.NEU.0000204873.68395.A0. |
| [15] | O'connor JP, Carano RA, Clamp AR, et al. Quantifying antivascular effects of monoclonal antibodies to vascular endothelial growth factor: insights from imaging[J]. Clin Cancer Res,2009, 15 (21) : 6674-82. DOI: 10.1158/1078-0432.CCR-09-0731. |
| [16] | George ML, Dzik-Jurasz AS, Padhani AR, et al. Non-invasive methods of assessing angiogenesis and their value in predicting response to treatment in colorectal cancer[J]. Br J Surg,2001, 88 (12) : 1628-36. DOI: 10.1046/j.0007-1323.2001.01947.x. |
| [17] | Agrawal S, Awasthi R, Singh A, et al. An exploratory study into the role of dynamic contrast-enhanced (DCE) MRI metrics as predictors of response in head and neck cancers[J]. Clin Radiol,2012, 67 (9) : e1-5. DOI: 10.1016/j.crad.2012.03.005. |
| [18] | Kim S, Loevner LA, Quon H, et al. Prediction of response to chemoradiation therapy in squamous cell carcinomas of the head and neck using dynamic contrast-enhanced Mr imaging[J]. AJNR Am J Neuroradiol,2010, 31 (2) : 262-8. DOI: 10.3174/ajnr.A1817. |
| [19] | Chawla S, Kim S, Dougherty L, et al. Pretreatment siffusionweighted and dynamic contrast-enhanced MRI for prediction of local treatment response in squamous cell carcinomas of the head and neck[J]. American J Roentgenology,2013, 200 (1) : 35-43. DOI: 10.2214/AJR.12.9432. |
| [20] | Juan CJ, Chen CY, Jen YM, et al. Perfusion characteristics of late radiation injury of parotid glands: quantitative evaluation with dynamic contrast-enhanced MRI[J]. Eur Radiol,2009, 19 (1) : 94-102. DOI: 10.1007/s00330-008-1104-9. |
| [21] | Rudat V, Stadler P, Becker A, et al. Predictive value of the tumor oxygenation by means of pO2 histography in patients with advanced head and neck cancer[J]. Strahlenther Onkol,2001, 177 (9) : 462-8. DOI: 10.1007/PL00002427. |
| [22] | Nordsmark M, Overgaard J. A confirmatory prognostic study on oxygenation status and loco-regional control in advanced head and neck squamous cell carcinoma treated by radiation therapy[J]. Radiother Oncol,2000, 57 (1) : 39-43. DOI: 10.1016/S0167-8140(00)00223-1. |
| [23] | Leach MO, Brindle KM, Evelhoch JL, et al. The assessment of antiangiogenic and antivascular therapies in early-stage clinical trials using magnetic resonance imaging: issues and recommendations[J]. British J Cancer,2005, 92 (9) : 1599-610. DOI: 10.1038/sj.bjc.6602550. |
 2015, Vol. 35
2015, Vol. 35
