2. 重庆医科大学 药物高校工程研究中心,重庆 400016
2. Department of Respiratory Medicine, Department of Histology and Embryology, Chongqing Medical University, Chongqing 400016, China
烟草烟雾化学成分复杂,目前已发现烟草烟雾中含有7000余种化学成分[1],其中包括大量的自由基[2]。当吸入烟草烟雾时,大量的自由基可导致机体中氧化剂和抗氧化剂失衡,发生氧化应激反应,可直接损伤呼吸道和肺泡上皮细胞,在烟草烟雾导致的肺损伤中,如慢性阻塞性肺部,慢支炎,肺气肿等疾病中起着核心作用[3]。研究表明氧化应激与细胞凋亡的发生密切相关[4]。在慢性阻塞性肺疾病病患者的肺组织中,发现大量凋亡细胞,且吸烟者较不吸烟者肺组织内凋亡细胞数量明显增多[5]。故烟草诱导的肺细胞凋亡可能参与慢性阻塞性肺疾病的发生发展过程。
脂质转运蛋白(PLTP)广泛表达于人和动物的血浆和组织中,主要促进血浆脂蛋白,脂蛋白与细胞间脂质及相关物质转运与交换,近年来逐渐成为非特异性炎症免疫反应领域中的研究热点[6]。脂质是肺泡表面活性物质的重要成分,肺组织具有合成与分解血脂及脂蛋白功能,肺泡Ⅱ型上皮细胞含有脂蛋白酶,提示肺脏具有强大脂质代谢能力[7]。已有研究发现,PLTP与呼吸系统疾病密切相关。首先,正常人类和大鼠的肺组织是PLTPmRNA表达最为丰富的器官。其次原位杂交证实正常肺组织内肺泡Ⅱ型上皮细胞表达并分泌PLTP,是肺泡表面活性物质的重要组成成分[8]。体内实验证实,PLTP基因缺失小鼠肺功能严重受损,而对照组小鼠功能正常。低氧能够诱导小鼠肺泡Ⅱ型上皮细胞PLTP基因表达上调。Wehinger等[9]发现PLTP可促进人单核巨噬细胞(THP1)凋亡,但在肺泡细胞中的作用还未见报道。且Marian等[10]研究发现吸烟可上调PLTP表达活性。故我们认为PLTP可能参与烟草烟雾诱导的肺泡细胞凋亡过程。
本研究检测烟草提取物诱导体外培养RLE-6TN细胞凋亡过程中,PLTP和cleaved caspase-3的表达情况,再通过敲除RLE-6TN中PLTP的表达,观察烟草提取物对RLE-6TN凋亡的影响,明确PLTP是否参与了烟草烟雾诱导的肺泡上皮细胞凋亡的过程,以期为烟草烟雾引起的肺损伤性疾病的防治找到新的靶点。
1 材料和方法 1.1 主要试剂大鼠肺泡II型上皮细胞(RLE-6TN)购自上海必畅生物科技有限公司(细胞来自美国模式培养物集存库,货号:CRL-2300,国内传代)。高糖DMEM培养基、胎牛血清、胰蛋白酶均购自美国GIBICO;Hoechst染色试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配置试剂盒、兔抗鼠Cleaved caspase-3单克隆抗体均购自碧云天生物技术研究所;PLTP、GAPDH抗体以及辣根过氧化物酶标记山羊抗兔IgG购于美国Santa;ECL发光液购自美国Milipore;宏升牌香烟购自重庆烟草公司。
1.2 细胞培养RLE-6TN细胞于含10%胎牛血清的高糖DMEM完全培养基中,37 ℃,5% CO2及饱和湿度条件下常规培养,2~3 d后,细胞融合度达到80%时,用0.25%胰酶消化传代,所有实验均选用对数生长期细胞。
1.3 烟草烟雾提取物的制备宏升牌香烟,每只烟含焦油11 mg,一氧化碳17 mg,尼古丁1.1 mg。根据Chapman等[11]描述的烟草提取物制备方法进行操作。简述如下:(1)去香烟滤嘴;(2)点燃香烟并安放于抽吸装置上;(3)匀速抽吸,使烟雾匀速通过10 mL无血清的DMEM培养基,每支香烟持续燃烧2 min;(4)抽吸完10支香烟后,停止抽吸;(5)调节烟草-DMEM培养基混合物pH至7.4,用0.22 μm的过滤器除菌,即为烟草烟雾提取物;(6)使用Beckman DU 640分光计(Fullerton, CA, USA),测定吸光度值(320 nm),约为1.36±0.12,将此时的烟草提取物浓度设为100%。根据实验需要将100%烟草提取物进一步稀释至所需浓度。
1.4 流式细胞术检测细胞凋亡取1×105个RLE-6TN细胞,接种于培养瓶,分别设置对照组和实验组,每组3个复孔。实验组分别加入浓度为0.5%,1.0%,2.0%的烟草提取物处理24 h,而对照组则只加入同样体积的培养液。经胰酶消化后,4 ℃ PBS洗涤2次,1000 r/min离心5 min后收集全部细胞,按照Annexin V-FITC/PI双染细胞检测试剂盒说明书操作:加入500 μL的Binding Buffer液重悬细胞,加入5 μL的Annexin-V混匀后在加入5 μL的碘化丙啶(PI)混匀,室温避光反应10 min,流式细胞仪检测分析。
1.5 Hoechst染色及细胞核形态的观察取防脱盖玻片浸泡酒精消毒后,置于六孔板内,接种细胞约(1×105/孔)。分别设置对照组和实验组,每组设置3个复孔。培养24 h后,实验组加入浓度为0.5%,1.0%,2.0%的烟草提取物, 对照组加入等容积的培养液,培养48 h后,吸尽培养液,每孔加入固定液1 mL,固定30 min。去除固定液,4 ℃预冷PBS洗两次,3 min/次。吸尽PBS后,加入Hoechst33258染色液1 mL,染色5 min。吸去染色液,PBS清洗两次,3 min/次。滴1~2滴抗荧光淬灭封闭液,盖上盖玻片,避免产生气泡。荧光显微镜下观察细胞核形态,激发光波长为350 nm,发射光波长为460 nm。随机选取3个视野并拍照。
1.6 SiRNA化学敲降RLE-6TN细胞中的PLTP表达并检测PLTP的表达量取融合度为50%的RLE-6TN贴壁细胞进行SiRNA转染,并将细胞分为干扰组和对照组。取无酶、洁净的EP管加入500 μL的OPTIM培养基+50 pmol的siRNA+ 5 μL RNAmax转染试剂,轻轻吹打混匀,室温静置20 min。将贴壁的RLE-6TN细胞用PBS清洗两次,除去残留的血清,干扰组加入OPTIM-SiRNA-RNAmax混混悬液,对照组加入等量的OPTIM-RNAmax混悬液,再加入无血清的DMEM培养液,定容至2 mL,培养48 h后,收集总蛋白,检测PLTP的蛋白表达量。SiRNA-PLTP序列如下所示:PLTP-rat-1416干扰序列:正义链:5'GGACCUUCGAAGGUUUCAATT3';反义链:5'UUGAAACCUUCGAAGGUCCTT3';PLTP-rat-987干扰序列:正义链:5'CUGGAGCCUUCUCAAC AAATT3',反义链:5'UUUGUUGAGAAGGCUCCAG TT3';PLTP-rat-867干扰序列:正义链:5'GCGUAG UUCUGUGGAUGAATT3',反义链:5'UUCAUCCAC AGAACUACGCTT3'。
1.7 Western blot检测PLTP和Cleaved caspase-3蛋白的表达取5×105个RLE-6TN细胞接种于培养瓶中,设置对照组和实验组,37 ℃培养24 h后实验组分别加入终浓度为0.5%,1.0%,2.0%烟草提取物,对照组则加入等量的培养液。再常规培养处理48 h后,加入IP+PMSF(IP/PMSF=50)细胞裂解液100 μL于冰上细胞30 min,12 000 r/min离心14 min,吸取上清液,BCA试剂盒测定蛋白浓度。每点样孔加40 µg蛋白样品液,SDS-PAGE凝胶电泳分离蛋白质。蛋白转膜,5%的脱脂牛奶封闭2 h。采用兔抗鼠多抗PLTP(1:500),内参GAPDH(1: 1000),4 ℃孵育过夜。TBST漂洗3次,每次10 min。分别加入二抗山羊抗兔IgG(1:1000)常温孵育2 h。TBST溶液漂洗如前, ECL试剂发光,胶片曝光。运用图像分析软件Quantity One分析条带的灰度值,目的条带的灰度值比上内参的灰度值表示蛋白质相对表达水平。
1.8 统计学分析采用Graphpad Prism 5.0软件进行统计学分析和作图,实验数据用均数±标准差表示,多组数据比较采用单因素方差分析,组间两两比较采用LSD检验;检验结果P < 0.05差异有统计学意义。
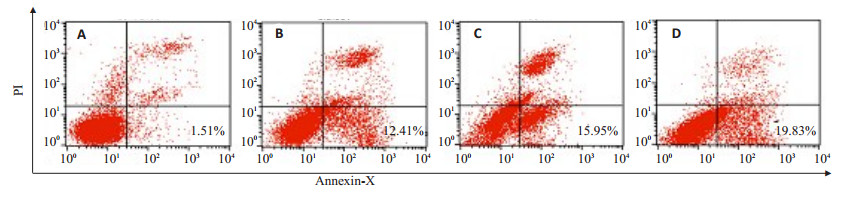
2 结果 2.1 烟草烟雾提取物对可诱导RLE-6TN细胞发生早期凋亡将0.5%,1.0%,2.0%烟草提取物分别作用RLE-6TN细胞24 h后,流式细胞结果(图 1B~D)示:细胞早期凋亡率分别为(12.127±0.932)%,(14.640±0.734)%和(18.663±0.964)%, 与(图 1A)正常对照组(1.68±0.098)%比较,差异有统计学意义(图 1,表 1,P < 0.05)。
|
图 1 流式细胞术检测烟草提取物作用RLE-6TN细胞后各组细胞凋亡率 Figure 1 Apoptosis rate of RLE-6TN cells after CSE exposure detected by flow cytometry. A: Control group; B: 0.5% CSE-treated group; C: 1.0% CSE-treated group; D: 2.0% CSE-treated group. |
| 表 1 烟草提取物对RLE-6TN细胞凋亡的影响 Table 1 Apoptosis rate of RLE-6TN cells after CSE exposure (Mean±SD, n=3) |
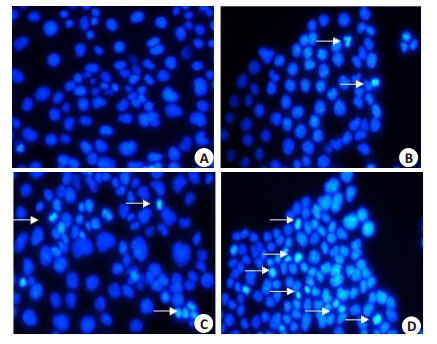
图 2结果示,对照组RLE-6TN细胞发出均匀的蓝色荧光,胞核未见明显凋亡变化(图 2A)。RLE-6TN细胞经0.5%,1.0%,2.0%烟草提取物分别作用48 h后,细胞核出现不同程度的核染色质浓缩聚集,核碎裂,核边集,发出较强的蓝白色荧光;白色箭头所示为已发生凋亡的细胞。随着烟草提取物浓度升高,细胞凋亡增加(图 2B~D)。
|
图 2 烟草烟雾提取物对RLE-6TN细胞核形体变化的影响 Figure 2 Morphological changes of CSE-treated RLE-6TN cells (Original magnification: × 400). A: Control group; B: 0.5% CSE-treated group; C: 1.0% CSE-treated group; D: 2.0% CSE-treated group. |
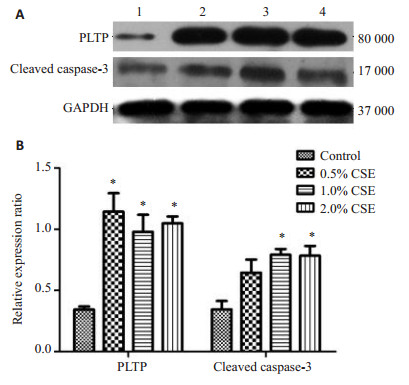
不同浓度的烟草提取物作用RLE-6TN细胞48 h后,检测PLTP和激活型caspase-3蛋白表达量(图 3A)。烟草提取物处理组PLTP蛋白的表达上调,与对照组比较差异有统计学意义(P < 0.05)。烟草提取物处理组激活型caspase-3的蛋白表达上调。其中0.5%烟草提取物组激活型caspase-3蛋白表达量与对照组比较,无明显变化(P > 0.05);1.0%和2.0%烟草提取物组激活型caspase-3的表达量,与对照组比较,差异有统计学意义(P < 0.05)。故后续实验选用2.0%烟草提取物作为处理因素(图 3B)。
|
图 3 WB检测PLTP及Cleaved caspase-3蛋白表达量 Figure 3 Protein expression of PLTP and cleaved caspase-3 detected by Western blotting. A: Western bloting; B: Quantitative analysis of expressions of PLTP and cleaved caspase-3. 1: Control group; 2: 0.5% CSE-treated group; 3: 1.0% CSE-treated group; 4: 2.0% CSE-treated group. *P < 0.05 vs control group. |
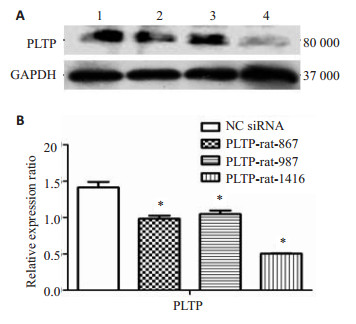
将吉玛公司合成的3条siRNA-PLTP转染入RLE-6TN细胞中,48 h后检测PLTP的蛋白表达量(图 4A)。如图 4B所示,PLTP-rat-1416干扰组,PLTP表达量最低,与阴性对照组相比,差异有统计学意义(P < 0.05)。故选用PLTP-rat-1416进行后续实验。
|
图 4 检测经siRNA-PLTP干扰后RLE-6TN细胞中PLTP的蛋白表达 Figure 4 Western blotting for detecting PLTP protein expression in RLE-6TN cells after siRNA-PLTP transfection. A: Protein bands in Western bloting; B: Quantitative analysis of PLTP expression. 1: Negative control group; 2: PLTP-rat-867 group; 3: PLTP-rat-987 group; 4: PLTP-rat-1416 group. *P < 0.05 vs control group. |
为进一步研究PLTP在烟草烟雾诱导的RLE-6TN细胞凋亡中的作用,我们将PLTP化学敲降后,检测烟草提取物对激活型caspase-3表达的影响(图 5A)。结果表明,将RLE-6TN细胞中的PLTP敲降后,能部分逆转烟草提取物诱导的激活型caspase-3的表达(图 5B)。
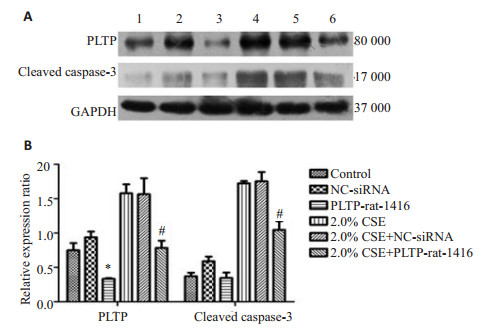
|
图 5 WB检测RLE-6TN中PLTP和Cleaved caspase-3的表达量 Figure 5 Protein expression of PLTP and cleaved caspase-3 in cells with different treatments detected by Western blotting. A: Protein bands; B: Quantitative analysis of expressions of PLTP and cleaved caspase-3. 1: Control group; 2: siRNA negative control group; 3: PLTP-rat-1416 group; 4: 2.0%CSE-treated group; 5: 2.0%CSE+siRNA negative control group; 6: 2.0%CSE+ PLTP-rat-1416 group. *P < 0.05 vs control group. #P < 0.05 vs 2.0% CSE treatment group. |
吸烟是导致慢阻肺的主要危险因素[11]。1984年版《美国卫生总监报告》指出,在美国导致慢阻肺病人死亡的原因中,吸烟占80%~90% [12];Lu等[13]开展的一项前瞻性队列研究发现,在100万因吸烟致死的病人中,45%死于慢性阻塞性肺炎。已有研究证明,烟草烟雾可诱导多种细胞凋亡,如人支气管上皮细胞、肺血管内皮细胞和气道平滑肌细胞等[14-16]。有研究发现,凋亡可能与慢性阻塞性肺疾病的发生和疾病进展有关,在吸烟的慢阻肺病人的肺组织中,发现大量的凋亡细胞[5],但其机制复杂,目前尚不明确。
本实验采用了流式细胞结果显示,烟草提取物可诱导RLE-6TN细胞发生早期凋亡。经烟草提取物处理细胞24 h后,细胞早期凋亡率由(1.68±0.098)%增加至(18.663±0.964)%(P < 0.001),具有浓度依赖性(图 1)。Hoechst染色法发现烟草提取物可使RLE-6TN细胞核发生核碎裂,核边集,染色质浓缩聚集等典型的凋亡表现(图 2)。Western blot检测烟草提取物对RLE-6TN细胞PLTP蛋白及激活型caspase-3蛋白表达的影响。结果显示烟草提取物能诱导PLTP和激活型caspase-3蛋白的表达上调(图 3)。为进一步论证,PLTP在烟草烟雾诱导的RLE-6TN细胞凋亡中的作用,我们敲除PLTP在细胞中的表达,发现PLTP敲除后,能逆转烟草提取物对caspase-3凋亡相关蛋白的激活(图 5)。
PLTP的首次报道应追溯至1985年,其主要功能是参与低密度脂蛋白与高密度脂蛋白间的磷脂转运, 修饰HDL分子大小及脂质组成[17]。随着对PLTP研究的不断深入,其在非特异性炎症免疫反应领域中作用正逐渐地引起人们的关注。Wehinger等[9]发现过表达PLTP可促进人单核巨噬细胞凋亡。我们的既往研究发现,氧化性低密度脂蛋白可通过RAS/ERK信号通路诱导PLTP表达上调,并进一步促进TGF-β1的合成[18]。另有有研究表明,TGF-β具有抗凋亡和促凋亡的双重作用[19]。它既可以促进肺泡上皮细胞凋亡[20],又可以减轻血管平滑肌细胞受凋亡的影响[21]。TGF-β1作为TGF-β蛋白家族成员之一,也参与细胞凋亡的调控[22-23]。本实验发现经烟草提取物处理后的RLE-6TN细胞,PLTP和激活型caspase-3蛋白的表达上调(图 3)。敲除PLTP在细胞中的表达后,能逆转烟草提取物对caspase-3蛋白的激活(图 5)。提示烟草提取物可能通过PLTP诱导RLE-6TN细胞中caspase-3的激活,从而促进细胞凋亡。其可能的分子信号机制为CSE激活RAS/ERK信号通路诱导PLTP的表达,并通过促进TGF-β1的合成,进而诱导大鼠肺泡上皮细胞凋亡。
综上所述,烟草烟雾中的有害物质能诱导肺泡上皮细胞的凋亡。其凋亡机制可能为烟草烟雾诱导肺泡上皮细胞中的PLTP蛋白表达增高,进一步激活caspase-3,进而引起凋亡的发生。通过研究PLTP在烟草烟雾提取物诱导的大鼠肺泡上皮细胞凋亡中的作用,可以为临床上防治吸烟引起肺泡上皮细胞损伤相关性疾病,如肺气肿、慢性阻塞性肺疾病等的防治提供新的治疗靶点。
| [1] | Hoffmann D, Rathkamp G, Rubin J. Comparison of the yields of several selected components in the smoke from five major Turkish tobacco varieties[J]. Food Cosmet Toxicol,1967, 5 (1) : 37-8. |
| [2] | Perfetti TA, Rodgman A. The complexity of tobacco and tobacco smoke [J]. Contrib Tob Res, 24(2011): 215-232. |
| [3] | Rahman I, Macnee W. Role of transcription factors in inflammatory lung diseases[J]. Thorax,1998, 53 (7) : 601-12. DOI: 10.1136/thx.53.7.601. |
| [4] | Bicer M, Senturk T, Signak IS, et al. Effects of off-pump versus on-pump coronary artery bypass grafting: apoptosis, inflammation, and oxidative stress[J]. Heart Surg Forum,2014, 17 (5) : E271-6. DOI: 10.1532/HSF98.2014326. |
| [5] | Henson PM, Vandivier RW, Douglas ID, et al. And repair in chronic obstructive pulmonary disease[J]. Thorac Soc,2006, 3 (6) : 713-7. |
| [6] | Schlitt A, Blankenberg S, Bickel C, et al. PLTP activity is a risk factor for subsequent cardiovascular events in CAD patients under statin therapy: the AtheroGene Study[J]. J Lipid Res,2009, 50 (4) : 723-9. DOI: 10.1194/jlr.M800414-JLR200. |
| [7] | Russo TA, Wang ZD, Davidson BA, et al. Surfactant dysfunction and lung injury due to the E.coli virulence factor hemolysin in a rat pneumonia mode[J]. Am J Physiol Lung Cell,2010, 8 (4) : 623-5. |
| [8] | Jiang XC, D'armiento J, Mallampalli, et al. RKExpression of plasma phospholipid transfer protein mRNA in normal and emphysematous lungs and regulation by hypoxia[J]. J Biol Chem,1998, 273 (25) : 15714-48. DOI: 10.1074/jbc.273.25.15714. |
| [9] | Wehinger A, Tancevski I, Schgoer W, et al. Phospholipid transfer protein augments apoptosis in THP-1-derived macrophages induced by lipolyzed hypertriglyceridemic plasma[J]. Arterioscler Thromb Vasc Biol,2007, 27 (4) : 908-15. DOI: 10.1161/01.ATV.0000259361.91267.8c. |
| [10] | Cheung MC, Wolfbauer G, Deguchi H. Human plasma phospholipid transfer protein specific activity is correlated with HDL size: implications for lipoprotein physiology[J]. Biochim Biophys Acta,2009, 1791 (3) : 206-11. DOI: 10.1016/j.bbalip.2008.12.010. |
| [11] | Chapman KR, Mannino DM, Soriano JB, et al. Epidemiology and costs of chronic obstructive pulmonary disease[J]. Eur Respir J,2006, 27 : 188-207. DOI: 10.1183/09031936.06.00024505. |
| [12] | Department of Health and Human Services. The Health Consequences of Smoking: Chronic obstructive lung disease. A Report of the Surgeon General. Washington, DC: Superintendent of Documents [C]. US Government Printing Office, 1984. |
| [13] | Liu BQ, Peto R, Chen ZM, et al. Emerging tobacco hazards in China: 1[J]. Retrospective proportional mortality study of one million deaths, BMJ,1988, 317 (7170) : 1411-22. |
| [14] | Lin XX, Yang XF, Jiang JX, et al. Cigarette smoke extract-induced BEAS-2B cell apoptosis and anti-oxidative Nrf-2 up-regulation are mediated by ROS-stimulated p38 activation[J]. Toxicol Mech Methods,2014, 24 (8) : 575-83. DOI: 10.3109/15376516.2014.956909. |
| [15] | Sakhatskyy P GM, Lu Q EA. Cigarette smoke-induced lung endothelial apoptosis and emphysema are associated with impairment of FAK and eIF2α[J]. Microvasc Res,2014 (94) : 80-9. |
| [16] | Aravamudan B, Kiel A, Prakash YS, et al. Cigarette smoke-induced mitochondrial fragmentation and dysfunction in human airway smooth muscle[J]. Am J Physiol Lung Cell Mol Physiol,2014, 306 (9) : 840-54. DOI: 10.1152/ajplung.00155.2013. |
| [17] | Riikka V, Ye D, Metso J, et al. Plasma phospholipid transfer activity and its deficiency leads to diminished atherosclerotic lesion development[J]. Arterioscler Thromb Vasc Biol,2007, 27 (8) : 578-86. |
| [18] | Guo LL, Chen YJ, Wang T, et al. Ox-LDL-induced TGF-β1 production in human alveolar epithelial cells:involvement of the Ras/ERK/PLTP pathway[J]. J Cell Physiol,2012, 227 (9) : 3185-91. DOI: 10.1002/jcp.24005. |
| [19] | Amelia Sánchez-Capelo. Dual role for TGF-β1 in apoptosis[J]. Cytokine & Growth Factor Reviews,2005, 16 (1) : 15-34. |
| [20] | Yanagisawa K, Osada H, Masuda A, et al. Induction of apoptosis by Smad3 and down-regulation of Smad3 expression in response to TGF-beta in human normal lung epithelial cells[J]. Oncogene,1998, 17 (13) : 1743-7. DOI: 10.1038/sj.onc.1202052. |
| [21] | Pollman MJ, Naumovski L, Gibbons GH. Vascular cell apoptosis: cell type-specific modulation by transforming growth factor-beta1 in endothelial cells versus smooth muscle cells[J]. Circulation,1999, 99 (15) : 2019-26. DOI: 10.1161/01.CIR.99.15.2019. |
| [22] | Campion EM, Hakimjavadi R, Loughran ST, et al. Repression of the proapoptotic cellular BIK/NBK gene by Epstein-Barr virus antagonizes transforming growth factor beta 1-Induced B-Cell apoptosis[J]. J Virol,2014, 88 (9) : 5001-13. DOI: 10.1128/JVI.03642-13. |
| [23] | Cencetti F, Bernacchioni C, Bruni P, et al. TGF-β1 evokes myoblast apoptotic response via a novel signaling pathway involving S1P4 transactivation upstream of Rho-kinase-2 activation[J]. FASEB J,2013, 27 (11) : 4532-46. DOI: 10.1096/fj.13-228528. |
 2015, Vol. 35
2015, Vol. 35
