2. 南方医科大学珠江医院泌尿外科,广 东 广州 510282 ;
3. 澳门理工学院高等卫生学校,澳门 999078
2. Department of Urology, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China ;
3. School of Health Sciences, Macao Polytechnic Institute, Macao 999078, China
膀胱癌作为泌尿系重大疾病和三大泌尿系肿瘤疾病之一,中国人群泌尿系肿瘤中其发病率占第一位,随着诊疗技术和发展和人们经济水平的提高,越来越多的膀胱癌可以得到诊断和治疗,但近年来,随着膀胱癌的诊断治疗的局限性日趋凸显,需要新的治疗方法和理念来改善现状[1-2]。微小RNAs(miRNAs)作为一类非编码单链小RNAs,广泛存在于人体各组织脏器中,其可通过在转录水平影响其靶基因信使RNA的稳定性或者转录后水平抑制翻译从而调控靶基因的表达水平,并通过这个机制影响细胞的相应的生物学行为,近年研究发现,miRNA在人类肿瘤、胚胎发育及代谢类等多种疾病中都扮演着重要作用[3-5]。微小RNA-34a(miR-34a)是miR-34家族中的一员,miR-34a参与调控多种恶性肿瘤的发生发展[6-14],但在调控膀胱癌细胞周期中还不十分清楚,有待进一步研究。本研究利用miR-34a模拟物及抑制物作为工具,以人膀胱癌细胞J82作为模型,旨在研究miR-34a对膀胱癌细胞周期调节的影响,并探讨其机制。
1 材料与方法 1.1 细胞与实验试剂膀胱癌细胞J82购自中科院上海细胞库。用含10%胎牛血清的1640培养基常规培养于5% CO2,37 ℃培养箱中。
胎牛血清、DMEM培养基及流式检测试剂盒购自南京凯基生物有限公司;转染试剂Lipofectamine2000、逆转录试剂及荧光定量PCR试剂购自美国Invitrogen;miR-34a模拟物(mimics)、抑制物(inhibitor)及miR-34a荧光定量PCR检测引物由广州锐博生物科技公司设计并合成。表面粘附分子CD44,CDK4,CDK6,CyclinD1,CyclinD3及抗GAPDH抗体购自美国CST。双荧光素酶报告基因试剂盒购自美国Promega。
1.2 实验分组将膀胱癌细胞J82根据不同处理因素分别分组,其中转染miR-34a模拟物为过表达组,相应转染miR-34a抑制物为低表达组,转染无意序列的为阴性对照组。按照Lipofectamine2000试剂说明书常规转染,方法简述如下:将20 pmol的microRNA及6 μL脂质体分别稀释于250 μL无血清培养基,室温静置5 min后轻柔混匀,再室温静置10 min后均与加入各组培养板中,使microRNA的终浓度为10 nmol/L,温箱培养6 h后换为完全培养基常规培养48 h行后续实验。
1.3 实时荧光定量PCR(Realtime-qPCR)收集各组转染48 h后的J82细胞,Trizol一步法提取其中总RNA,常规逆转录合成cDNA,利用RealtimeqPCR试剂盒PCR扩增,ABI7300检测并分析细胞中miR-34a的表达水平。
1.4 双荧光素酶报告基因实验将J82细胞以1×105/孔密度接种于24孔板,第2天当细胞约70%融合时,利用Lipofectamine 2000共转染包含有CD44的3'UTR的荧光素酶质粒和miR-34a模拟物或抑制物,常规培养48 h后,按照双荧光素酶报告基因检测试剂盒(Promega)在多功能酶标仪上测定并分析。
1.5 蛋白免疫印迹(Western blot)实验收集转染处理48 h后的J82细胞,加入适量RIPA裂解液,获取细胞总蛋白液,加入适量SDS上样缓冲液100 ℃水浴解除蛋白交联。各组蛋白样品行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭2 h,然后依次孵育一抗4 ℃过夜及辣根过氧化物酶标记的二抗室温1 h后化学发光法显影,检测细胞中CD44,CDK6,CyclinD1,CyclinD3及CPT1A的表达情况,以GAPDH作为内参。
1.6 周期实验按照上述实验分组转染细胞,48 h后收集各组细胞,分别计数5×104,加入预冷70%乙醇,于4 ℃固定过夜,或-20 ℃长期固定,离心收集细胞,以1 mL的PBS洗细胞一次,加入500 μL PBS含50 μg/mL溴化乙锭(PI),100 μg/mL RNase A,0.2% Triton X-100,4 ℃避光孵育30 min,流式细胞仪检测分析,实验重复3次。
1.7 统计学方法用SPSS18.0统计学软件进行统计分析。实验数据以均数±标准差表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-34a在膀胱癌细胞系J82和膀胱癌组织中低表 达及在J82中过表达和抑制miR-34a表达通过运用实时定量PCR在膀胱癌组织和细胞系中检测miR-34a的表达,发现miR-34a在膀胱癌细胞系J82和膀胱癌组织中处于低表达水平,J82中转染miR-34a mimics可显着升高J82细胞中的miR-34a水平,mimics组比阴性对照组,P < 0.05;而转染miR-34a inhibitor可明显抑制J82细胞中的miR-34a水平,inhibitor组比阴性对照组(P < 0.05,图 1)
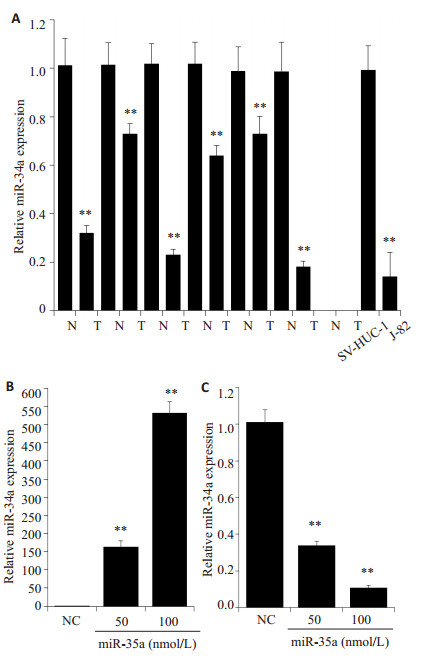
|
图 1 mir-34a的表达检测 Figure 1 Real-time PCR detection of miR-34a expression in bladder cancer tissues and J82 cells (A) and in J82 cells transfected with miR-34a mimics (B) and miR-34a inhibitor (C). |
2.2 miR-34a可影响膀胱癌细胞J82周期,主要表现为S期的变化
通过在膀胱癌细胞J82中分别转染miR-34amimics,miR-34a-inhibitor和相对应的阴性对照,转染了miR-34a-mimics后S期细胞相对转染了阴性对照(33.24%)比例降低,降低为16.11%(图 2A),转染了miR-34a-inhibitor后S期细胞相对转染了阴性对照(33.90%)比例升高,升高为44.52%,通过实验重复后进行统计学分析,具有显着差异性,P < 0.05(图 2B)。通过免疫印迹技术检测miR-34a对J82细胞中CD44表达的影响,结果提示:随着miR-34a-mimics成功转染入细胞中,CD44的表达下降,随着miR-34a-inhibitor成功转染入细胞中,CD44的表达升高,这表明miR-34a在J82细胞中可影响CD44的表达水平进而产生相应的细胞生物学行为的改变(图 2C)。
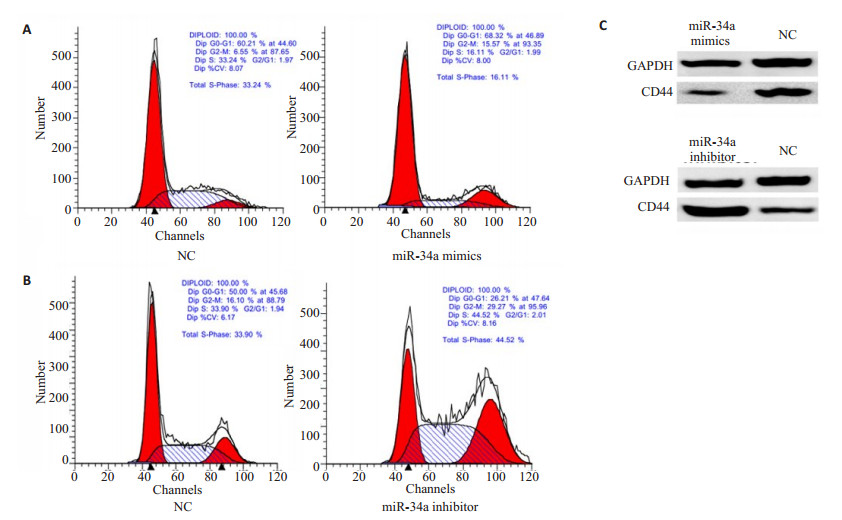
|
图 2 J82细胞周期的变化检测及CD44表达水平的改变检测 Figure 2 Flow cytometry for detecting cell cycle changes in J82 cells transfected with miR-34a mimics (A) and miR-34a inhibitor (B) and Western blotting for detecting their effects on CD44 expression (C). |
生物信息学网站分析及相关文献报道提示CD44可以作为miR-34a的潜在靶点,因此通过双荧光素酶报告基因实验证实miR-34a对CD44野生型的3'UTR活性的作用。miR-34a mimics可使CD44的3'UTR活性降低约33%(P < 0.05),而miR-34a inhibitor可使CD44野生型的3’ UTR活性升高近1.26倍(P < 0.05,图 3)。
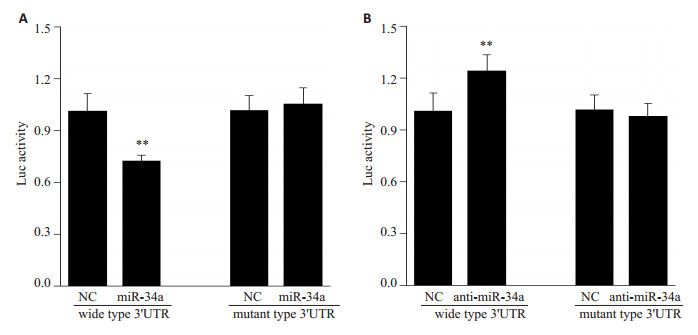
|
图 3 荧光素酶报道实验J82细胞中检测mir-34a对CD44野生型及突变型3'端非编码区活性的影响 Figure 3 Luciferase reporter assay for detecting the activation of 3'UTR of CD44 in J82 cells transfected with miR-34a mimics (A) and miR-34a inhibitor (B). **P < 0.05 vs NC group. |
通过在膀胱癌细胞J82中成功转染miR-34amimics后,用免疫印迹技术检测细胞周期相关蛋白的变化,我们发现miR-34a-mimics转染组相对于阴性对照组CyclinD1,CyclinD3,CDK4和CDK6的表达水平均有所下降,同时用事实定量PCR技术进行表达验证,得到同样的结论,差异具有统计学意义(P < 0.05)。这说明miR-34a可以通过部分影响细胞周期相关蛋白的变化,进而表现出对膀胱癌细胞J82细胞周期的影响(图 4)。
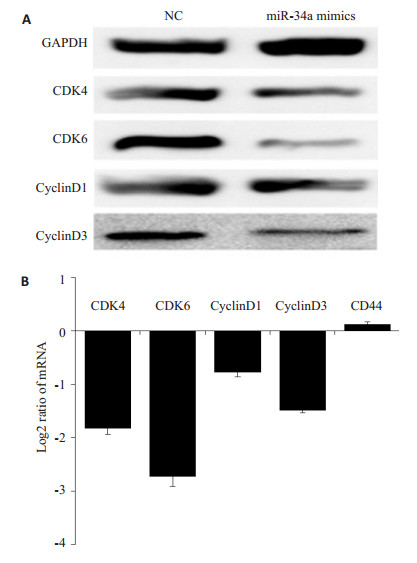
|
图 4 在J82细胞中过表达mir-34a后检测细胞周期相关蛋白的表达变化 Figure 4 Western blotting (A) and qPCR (B) for detecting changes in the expression levels of some cycle-related proteins in J82 transfected with miR-34a mimics and miR-34a inhibitor. |
通过RNA干扰技术,J82细胞中当CD44被干扰后,细胞周期发生了显着的变化,主要表现为S期的缩减,S期细胞比例降低为19.68%,而联合转染CD44和miR-34a-mimics后发现S期细胞比例为26.88%,相对转染CD44和阴性对照组S期细胞比例为52.21%有较大下降,但是较单独转染miR-34a-mimics S期细胞比例为16.11%又有显着地上升,说明CD44可以部分回复miR-34a对膀胱癌细胞周期的影响(图 5),综上所述,miR-34a影响膀胱癌细胞J82的细胞周期的变化是通过靶向CD44来实现的。
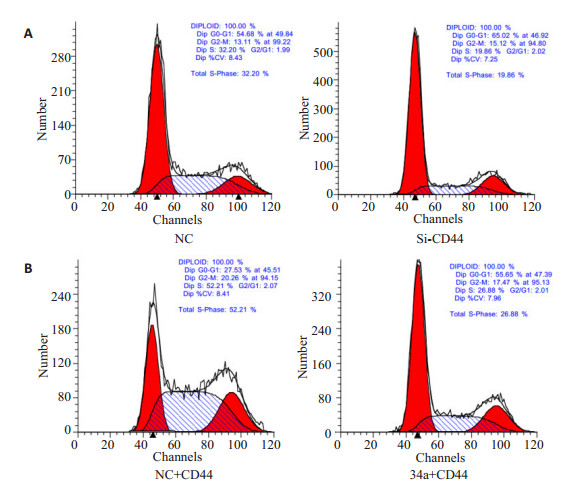
|
图 5 检测J82细胞在CD44表达抑制后及共转染mir-34a-mimics和CD44质粒后细胞的周期变化 Figure 5 Flow cytometry for analyzing cell cycle changes in J82 cells with CD44 downregulation and with CD44 and mir-34a co-transfection. |
此前研究表明,miRNAs作为小分子非编码RNA,大小在18~22nt之间,可结合于其靶基因mRNA的3'UTR区域,在转录后水平抑制其靶基因的表达,或者促进该mRNA降解,参与了多种人类疾病如炎症,肿瘤的发生发展及胚胎发育器官形成等多种病理生理学进程。miR-34a作为miR-34家族其中的一员,在人类多种恶性疾病中如前列腺癌,肾癌,膀胱癌,乳腺癌等多种恶性肿瘤中异常表达[15-17],通过调控CD44、PTEN、TP53、NOTCH1、CDK6及BCL2等凋亡、细胞周期相关基因参与肿瘤的发生发展[18-22]。
但miR-34a在膀胱癌细胞中调节细胞周期的变化目前还不十分清楚,为了进一步丰富膀胱癌发生发展的分子生物学理论。我们在膀胱癌组织和细胞系J82中对mir-34a的基础表达进行实时定量PCR检测,结果表明mir-34a在膀胱癌组织中呈现出普遍性低表达,同时相对于膀胱正常细胞系SV-HUC-1细胞J82中mir-34a是低表达的,从上述结果表明了mir-34a在膀胱癌的发生发展中起着重要的调节功能。我们通过在膀胱癌细胞中调节miR-34a的表达,通过免疫印迹技术检测干预miR-34a表达后CD44和细胞周期相关蛋白的表达变化,发现CD44蛋白的表达水平与miR-34a的表达量呈负相关,信使RNA水平基本上无变化,此外细胞周期相关蛋白CDK4,CDK6,CyclinD1和CyclinD1随着miR-34a在J82中过表达后表达量均呈下降趋势,且细胞周期各期细胞比例均出现了较大的变化,表现为S期比例在减少。这些结果说明了miR-34a是在转录后水平调节CD44的表达,并可通过一系列复杂的调控方式影响了细胞周期相关蛋白的表达变化从而宏观的表现出细胞周期的改变。我们知道,任何细胞生物学行为的改变都有与之相关的基因的蛋白表达水平的变化,于是我们在后续通过RNA干扰去除CD44的表达发现,CD44被显着去除内源性表达后,J82细胞S期比例下降。我们在J82细胞中共转染miR-34a-mimics和CD44质粒,分别相对应共转染miR-34a-mimics和NC,J82细胞S期比例有所增加,这些结果表明CD44可以在膀胱癌细胞J82中做为调节细胞周期的因子之一,同时说明CD44可以部分回复miR-34a对周期调节的影响。CD44在调节J82细胞周期的同时,其表达水平与细胞周期相关蛋白表达水平也呈现出一个正相关关系,呈现出一个复杂的网络调节关系,具体相互调节机制有待更加深入的研究。
CD44是一个表面粘附分子,并可以作为膀胱癌和前列腺癌的肿瘤标志物[23-26],一般认为其在人类多数恶性肿瘤的增殖和分化过程中起到重要的调控作用。CD44表达增加可促进肿瘤细胞的增殖和转移同时抑制其分化潜能,相反CD44的表达下降可抑制细胞周期进程同时促进祖细胞向成熟细胞分化。既往已有研究报道miR-34a可结合在CD44的3'非编码区,参与其转录后调控,我们的荧光素酶报告实验和免疫印迹结果也证实了miR-34a可以调控CD44的蛋白表达。
综上所述,我们的研究发现,在人膀胱癌细胞中过表达miR-34a,可以降低CD44的表达水平,而低表达miR-34a可抑制上述过程。我们通过Western blot验证了miR-34a对CD44蛋白水平的影响,通过流式细胞术证实miR-34a通过调控CD44的表达影响膀胱癌细胞J82周期的变化,证明了miRNA-34a是通过直接靶向CD44对膀胱癌细胞周期的影响。
| [1] | Schrader AJ, Sevinc S, Olbert PJ, et al. Gender-specific characteristics and survival of renal cell carcinoma[J]. Urologe A,2008, 47 (9) : 1182. DOI: 10.1007/s00120-008-1832-0. |
| [2] | Bukowski RM. Prognostic factors for survival in metastatic renal cell carcinoma update 2008[J]. Cancer,2009, 115 (10) : 2273-81. |
| [3] | Fatica A, Fazi F. MicroRNA-Regulated pathways in hematological malignancies: how to avoid cells playing out of tune[J]. Int J Mol Sci,2013, 14 (10) : 20930-53. DOI: 10.3390/ijms141020930. |
| [4] | Ling H, Fabbri M, Calin GA. MicroRNAs and other non-coding RNAs as targets for anticancer drug development[J]. Nat Rev Drug Discov,2013, 12 (11) : 847-65. DOI: 10.1038/nrd4140. |
| [5] | He Y, Jiang X, Chen J. The role of miR-150 in normal and malignant hematopoiesis[J]. Oncogene,2014, 33 (30) : 3887-93. DOI: 10.1038/onc.2013.346. |
| [6] | Medimegh I, Omrane I, Privat M, et al. MicroRNAs expression in triple negative vs Non triple negative breast cancer in Tunisia: interaction with clinical outcome[J]. PLoS One,2014, 9 (11) : e111877. DOI: 10.1371/journal.pone.0111877. |
| [7] | Corcoran C, Rani S, O'driscoll L. miR-34a is an intracellular and exosomal predictive biomarker for response to docetaxel with clinical relevance to prostate cancer progression[J]. Prostate,2014, 74 (13) : 1320-34. DOI: 10.1002/pros.22848. |
| [8] | Yu GP, Zhong N, Chen GQ, et al. Downregulation of PEBP4, a target of miR-34a, sensitizes drug-resistant lung cancer cells[J]. Tumour Biol,2014, 35 (10) : 10341-9. DOI: 10.1007/s13277-014-2284-3. |
| [9] | Li XJ, Ren ZJ, Tang JH. MicroRNA-34a: a potential therapeutic target in human cancer[J]. Cell Death Dis,2014, 5 (8) : e1327. |
| [10] | Wu H, Huang M, Liu Y, et al. Luteolin induces apoptosis by up-regulating miR-34a in human gastric cancer cells[J]. Technol Cancer Res Treat,2014 (2) : 11-13. |
| [11] | Yu G, Li H, Wang J, et al. miRNA-34a suppresses cell proliferation and metastasis by targeting CD44 in human renal carcinoma cells[J]. J Urol,2014, 192 (4) : 1229-37. DOI: 10.1016/j.juro.2014.05.094. |
| [12] | Ng HY, Wan TS, So CC, et al. Epigenetic inactivation of DAPK1, p14ARF, mir-34a and -34b/c in acute promyelocytic leukaemia[J]. J Clin Pathol,2014, 67 (7) : 626-31. DOI: 10.1136/jclinpath-2014-202276. |
| [13] | Xie KP, Liu JB, Chen JP, et al. Methylation-associated silencing of microRNA-34b in hepatocellular carcinoma cancer[J]. Gene,2014, 543 (1) : 101-7. DOI: 10.1016/j.gene.2014.03.059. |
| [14] | Rokavec M, Oner MG, Li H, et al. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis[J]. J Clin Invest,2014, 124 (4) : 1853-67. DOI: 10.1172/JCI73531. |
| [15] | Ostling P, Leivonen SK, Aakula A, et al. Systematic analysis of MicroRNAs targeting the androgen receptor in prostate cancer cells[J]. Cancer Res,2011, 71 (5) : 1956-67. DOI: 10.1158/0008-5472.CAN-10-2421. |
| [16] | Yamamura S, Saini S, Majid S, et al. MicroRNA-34a modulates c-Myc transcriptional complexes to suppress malignancy in human prostate cancer cells[J]. PLoS One,2012, 7 (1) : e29722. DOI: 10.1371/journal.pone.0029722. |
| [17] | Li H, Yu G, Shi RL, et al. Cisplatin-induced epigenetic activation of miR-34a sensitizes bladder cancer cells to chemotherapy[J]. Mol Cancer,2014, 13 (6) : 8. |
| [18] | Zhou R, Yuan P, Wang Y, et al. Evidence for selective microRNAs and their effectors as common long-term targets for the actions of mood stabilizers[J]. Neuropsychopharmacology,2009, 34 (6) : 1395-405. DOI: 10.1038/npp.2008.131. |
| [19] | Wang X, Wang HK, Mccoy JP, et al. Oncogenic HPV infection interrupts the expression of tumor-suppressive miR-34a through viral oncoprotein E6[J]. RNA,2009, 15 (4) : 637-47. DOI: 10.1261/rna.1442309. |
| [20] | Tryndyak VP, Ross SA, Beland FA, et al. Down-regulation of the microRNAs miR-34a, miR-127, and miR-200b in rat liver during hepatocarcinogenesis induced by a methyl-deficient diet[J]. Mol Carcinog,2009, 48 (6) : 479-87. DOI: 10.1002/mc.v48:6. |
| [21] | Hu QL, Jiang QY, Jin X, et al. Cationic microRNA-delivering nanovectors with bifunctional peptides for efficient treatment of PANC-1 xenograft model[J]. Biomaterials,2013, 34 (9) : 2265-76. DOI: 10.1016/j.biomaterials.2012.12.016. |
| [22] | Ma L, Li N, He X, et al. miR-449b and miR-34c on inducing down-regulation of cell cycle-related proteins and cycle arrests in SKOV3-ipl cell, an ovarian cancer cell line[J]. Beijing Da Xue Xue Bao,2011, 43 (1) : 129-33. |
| [23] | Chan KS, Espinosa I, Chao M, et al. Identification, molecular characterization, clinical prognosis, and therapeutic targeting of human bladder tumor-initiating cells[J]. Proc Natl Acad Sci USA,2009, 106 (33) : 14016-21. DOI: 10.1073/pnas.0906549106. |
| [24] | Kasper S. Identification, characterization, and biological relevance of prostate cancer stem cells from clinical specimens[J]. Urol Oncol,2009, 27 (3) : 301-3. DOI: 10.1016/j.urolonc.2008.12.012. |
| [25] | Heidt DG, Li C, Mollenberg N, et al. Identification of pancreatic cancer stem cells[J]. Cancer Res,2006, 130 (2) : 194-5. |
| [26] | Golshani R, Lopez L, Estrella V, et al. Hyaluronic acid synthase-1 expression regulates bladder cancer growth, invasion, and angiogenesis through CD44[J]. Cancer Res,2008, 68 (2) : 483-91. DOI: 10.1158/0008-5472.CAN-07-2140. |
 2015, Vol. 35
2015, Vol. 35
