神经胶质瘤简称胶质瘤,是发生于神经外胚层的肿瘤。胶质瘤以男性较多见,特别在多形性胶质母细胞瘤、髓母细胞瘤,男性明显多于女性。胶质瘤大多缓慢发病,自出现症状至就诊时间一般为数周至数月,少数可达数年。胶质瘤系浸润性生长物,它和正常脑组织没有明显界限,难以完全切除,对放疗化疗不甚敏感,非常容易复发,生长在大脑等重要部位的良、恶性肿瘤,手术难以切除或根本不能手术。化学药物等因血脑屏障等因素的影响,疗效也不理想,因此脑胶质瘤至今仍是全身肿瘤中预后最差的肿瘤之一。
胶质瘤发病原因复杂,主要可能与遗传、电离辐射和化学致癌物等有关系。而这些因素的改变驱动了胶质瘤发病相关的表达改变,异常导致癌基因的激活以及抑癌基因的失活[1-3],因而促进了胶质瘤发病。
ZNF217是Krupple样转录因子,属于锌指蛋白家族成员。该基因过表达已经展示在多个肿瘤中,包括乳腺癌、卵巢癌、大肠癌以及恶性胶质瘤中,重要的促进了这些肿瘤的发病过程。然而,该基因在胶质瘤的作用及机制目前研究很少,特别是迁移和侵袭方面更是没有报导。本研究通过慢病毒介导的shRNA靶向抑制ZNF217进行了这些方面的研究。
1 材料和方法 1.1 材料 1.1.1 细胞和试剂胶质瘤细胞U251保存于南方医科大学肿瘤研究所,培养于含10%胎牛血清的RPMI 1640培养液中,在37 ℃,5% CO2环境下培养。磷酸化的PI3K/AKT、E-Cadherin和、N-Cadherin购买购自美国Cell Signaling Technology(CST)公司,C-MYC和内参GAPDH兔抗人多克隆抗体购自Santa-Cruz公司。
1.2 方法 1.2.1 shRNA-ZNF217慢病毒包装以及干扰效率检测由于选用的载体为pLVTMH慢病毒表达载体系统,RNAi设计采用了Invitrogen公司提供的在线网站设计。我们根据Invitrogen公司在线RNAi设计系统,设计了ZNF217的shRNA:
sense:5'CGCGTCCCCGCCTGTGTCATATCAACACTTTCTCTTGAAAAGT GTTGATATGACACAGGTTTTTGGAAAT3';
antisense:5'CGATTTCCAAAAAGCCTGTGTCATATCAACACT TTTCAAGAGAAAGTGTTGATATGACACAGGCGGGGA3'
序列引物为上海生物工程公司合成。将双链寡核苷酸进行退火形成双链,在与经内切酶ClaⅠ和MluⅠ双酶切后的pLVTHM载体进行重组。产物最后进行测序鉴定。进一步,shRNA-ZNF217与辅助质粒psPAX2和pMD2.G共转染293FT细胞,72 h收集病毒,感染胶质瘤U251细胞。空载病毒感染的质瘤U251细胞作为对照。扩大培养的2种细胞在经流式细胞仪富集,ZNF217干扰效率被Western blot检测
1.2.2 体外迁移实验Transwell小室细胞运动实验。本实验所用Transwell小室购自美国Corning公司,小室内的膜材料为聚碳酸酯(polycarbonate, PC),小室孔径为8.0 μm。将生长状态良好的培养细胞调整到浓度为1×106/mL。加100 μL细胞悬液于内室,然后加500 μL含10%新生牛血清的完全培养基于下室,37 ℃培养15 h。取出小室,用棉签轻轻擦掉未穿过膜的细胞,甲醇固定15 min,弃甲醇后空气干燥,用Giemsa应用染液染色5 min,用蒸馏水轻轻地冲洗数次,空气中风干。显微镜下随机选取5个高倍视野计数穿过膜的细胞数。重复3次。
1.2.3 体外侵袭实验实验用的Boyden小室购自Chemicon,该小室是利用ECMatrixTM,即利用EHS(Engelbreth Holm-Swarm)小鼠肿瘤组织成分重新构建的人工基底膜,评价肿瘤细胞的侵袭能力,小室孔径为8.0 μm。在内室中加300 μL无血清培养基,置于培养箱中孵育1~2 h,使ECMatrix层亲水。细胞经胰酶消化后制成单细胞悬液,调整细胞浓度为1×106/mL。加200 μL细胞悬液于内室,然后加500 μL完全培养基于下室,37℃培养18 h。取出小室,用棉签轻轻擦掉未穿过膜的细胞,然后将小室浸入甲醇固定15 min,弃甲醇后空气干燥,用Giemsa应用染液染色5 min,蒸馏水轻轻地冲洗数次,空气风干。显微镜下随机选取5个高倍视野计数穿过ECMatrix膜的细胞数。重复3次。
1.2.4 细胞增殖分析于96孔板中每孔接种对数期1×103个细胞,体积为200 μL,每组设3个复孔,同时设空白对照。在分别培养1、2、3、4、5、6和7 d后每孔加入5 mg/mL的MTT 20 μL后37 ℃培养4 h。弃去培养基,发现有紫蓝色结晶物出现后加入150 μL DMSO。室温避光摇床振荡10 min,使结晶物充分溶解。以空白孔为对照,用酶标仪490 nm波长测定各孔吸光度值(A值)。重复3次,绘制生长曲线。
1.2.5 细胞周期检测胶质瘤shZNF217和其对照PLVTMH U251细胞各自接种到6孔培养板。当细胞培养48~72 h之间时收集细胞,加预冷70%乙醇固定过夜,用PI染色,流式细胞仪进行检测。
1.2.6 蛋白因子表达检测Western blot检测细胞生成以及EMT相关蛋白因子表达变化。分别收集5×106稳定整合shRNA-ZNF217慢病毒表达载体和阴性空载体的细胞。PBS漂洗细胞,在4 ℃下3000 r/min离心10 min,收集细胞,加入裂解液120 μL,冰上裂解30 min,100 ℃煮沸变性10 min,冰上复性5 min,超声粉碎30 s,12 000×g离心30 min,吸上清。BSA分析试剂测定蛋白质浓度。30 μg总蛋白质在10% SDS聚丙烯酰胺凝胶电泳分离后,转移至NC膜。将一抗抗体与膜孵育1 h后,将二抗(1:50)与膜孵育1 h;ECL试剂盒进行化学发光检测。抗体使用浓度均为1: 500。
1.3 统计学处理SPSS 13.0统计分析,P < 0.05表示有统计学意义。数据用均数±标准差表示,配对t检验用于细胞体外游走、侵袭以及增殖分析。
2 结果 2.1 ZNF217在胶质瘤中表达明显抑制扩大培养的shRNA-ZNF217和空载细胞在经流式细胞仪富集后,其有效感染率都达到了90%以上。实时荧光定量PCR检测发现,ZNF217 mRNA在干扰组下降到只有对照组的25.7%。进一步,western blot检测发现,ZNF217在shZNF217细胞中表达明显下降,其有效抑制率为69.23%(图 1)。

|
图 1 Western blot检测U251细胞中ZNF217基因干扰前后蛋白表达情况 Figure 1 ZNF217 protein expression detected by Western blotting in U251 cells with ZNF217 knockdown. |
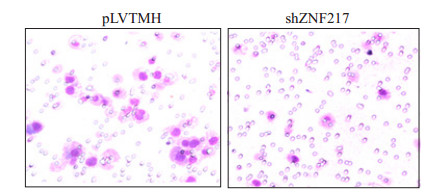
首先,我们检测了ZNF217对胶质瘤细胞迁移能力的影响。与对照pLVTMH细胞相比,在抑制ZNF217表达后,胶质瘤U251细胞迁移能力明显减低具有明显的统计学意义(P < 0.001,图 2)。
|
图 2 抑制ZNF217表达后胶质瘤细胞迁移能力明显减低 Figure 2 ZNF217 knockdown reduces the migration ability of glioma cells. |
进一步,我们利用boyden小室检测了ZNF217基因对胶质瘤细胞侵袭能力的影响。与对照pLVTMH细胞相比,在抑制ZNF217表达后,胶质瘤U251细胞侵袭能力明显下降,具有明显的统计学意义(3 < 0.001,图 3)。

|
图 3 抑制ZNF217表达后胶质瘤细胞侵袭能力明显抑制 Figure 3 ZNF217 knockdown suppressed invasion of glioma cells. |
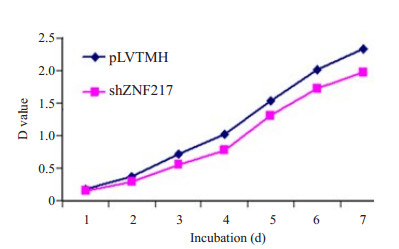
与对照pLVTMH细胞相比,在抑制ZNF217表达后,胶质瘤U251细胞生长能力从第2天开始起一直到检测的第7天就明显降低,并具有明显的统计学意义(P < 0.05,图 4)。
|
图 4 抑制ZNF217表达后胶质瘤细胞生长能力明显抑制 Figure 4 ZNF217 knockdown suppresses glioma cell growth. |
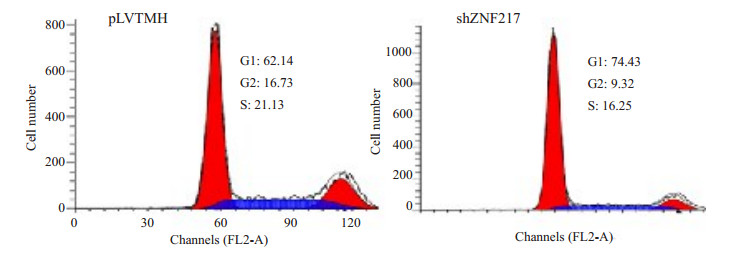
流式细胞仪检测分析细胞发现,在稳定抑制ZNF217表达后,细胞周期主要阻滞在G1期,且S和G2期DNA含量都明显降低(图 5)。
|
图 5 稳定抑制ZNF217表达抑制胶质瘤细胞周期转化 Figure 5 Stable suppression of ZNF217 inhibits the transition of cell cycle. |
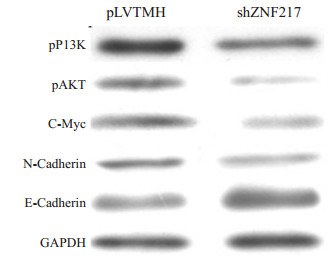
利用慢病毒介导的shRNA抑制ZNF217表达后,胶质瘤细胞中磷酸化的PI3K/AKT活性明显降低。此外,该信号通路下游基因C-Myc和N-Cadherin表达也明显下调,而E-Cadherin表达则显著升高(图 6)。
|
图 6 Western blot检测ZNF217基因抑制后相关基因表达 Figure 6 Western blotting for detecting the related gene expressions in glioma cells with ZNF217 knockdown. |
锌指结构是由若干保守的氨基酸残基同锌离子结合,形成相对独立的“指”状四面体结构,这一结构最早由Miller于1985年在非洲爪蟾转录因子TFⅢA中发现[10]。此后,人们陆续发现了大量含有锌指结构的蛋白质,统称为锌指蛋白。锌指蛋白在真核生物中广泛表达,参与细胞的分化、增殖和凋亡等多种重要生命过程。具有转录因子活性的锌指蛋白是锌指蛋白家族中最庞大的成员。ZNF217基因定位于人染色体20q13.2,表达产物为ZNF217蛋白,属于锌指蛋白家族成员之一[11],其主要在细胞核内表达,发挥转录因子作用。
近年来,越来越多的研究显示,ZNF217在肿瘤中高表达,其中包括了乳腺癌[4-5]、卵巢癌[6-7]、大肠癌[8]和胶质瘤[9],且过表达的ZNF217促进了乳腺癌疾病临床进展和可怜的预后。以上这些研究表明,ZNF217在肿瘤中可能发挥了重要的重要。在机制研究方面,对于ZNF217来说非常的少,目前仅有几篇论文报道。Vendrell等发现,过表达的ZNF217可以调控TGF-beta1信号通路驱动乳腺癌细胞发生EMT转换,从而促使乳腺癌细胞的侵袭和转移。此外,ZNF217在乳腺癌中能与ErbB3启动子结合,促进PI3K/AKT表达[12]。而在胶质瘤中,过表达的ZNF217能通过激活缺氧诱导因子表达,从而维持胶质瘤细胞干性[9]。
归因于ZNF217在胶质瘤发病过程中的重要性,在这次研究中,我们主要利用慢病毒介导的shRNA探讨了ZNF217对胶质瘤细胞迁移、侵袭以及生长的分子机制。我们发现,在稳定抑制ZNF217表达后,胶质瘤细胞的迁移、侵袭以及生长能力都明显减低,且细胞周期明显阻滞在G1期,而S和G2期细胞DNA含量明显降低。以上这些结果表明ZNF217在胶质瘤中发挥了癌基因的作用。这表明ZNF217在胶质瘤中发挥了癌基因的作用。进一步,我们分析了ZNF217促进肿瘤迁移、侵袭以及生长的分子机制。E-Cadherin和N-Cadherin分别为上皮和间质细胞的标志物。E-Cadherin表达下调以及N-Cadherin表达上调表明细胞可能发生了EMT转化[13],因而促进了肿瘤细胞的迁移和侵袭。C-Myc是一个经典的癌基因[14],主要促进细胞周期有G1向S期转化,因而促进细胞的生长。在本次研究中,我们发现,在抑制ZNF217表达后,C-Myc和N-Cadherin表达下调,E-Cadherin表达下调,这表明ZNF217主要通过调节这几个关键基因表达促进了胶质瘤发病过程。
PI3K/AKT是经典的癌性信号通路[15],其激活主要促进了肿瘤细胞中C-Myc以及EMT相关基因表达和失活。我们的结果显示,在抑制ZNF217表达后,该信号通路表达明显失活,这表明ZNF217在胶质瘤中主要激活PI3K/AKT而导致细胞生长、迁移和侵袭。
因此,抑制ZNF217表达能显著抑制PI3K/AKT信号通路,继而失活癌基因C-Myc以及调控EMT相关基因改变,因而抑制胶质瘤细胞迁移、生长和侵袭。我们的研究表明,ZNF217在胶质瘤中发挥了癌基因作用,促进了该疾病的发病过程。
| [1] | Zhang H, Nie WC, Zhang X, et al. NEDD4-1 regulates migration and invasion of glioma cells through CNrasGEF ubiquitination in vitro[J]. PLoS One,2013, 8 (12) : e82789. DOI: 10.1371/journal.pone.0082789. |
| [2] | Han S, Xia J, Qin X, et al. Phosphorylated SATB1 is associated with the progression and prognosis of glioma[J]. Cell Death Dis,2013, 4 : e901. DOI: 10.1038/cddis.2013.433. |
| [3] | Xiaoping L, Zhibin Y, Wenjuan L, et al. CPEB1, a histone-modified hypomethylated gene, is regulated by miR-101 and involved in cell senescence in glioma[J]. Cell Death Dis,2013, 4 : e675. DOI: 10.1038/cddis.2013.197. |
| [4] | Vendrell JA, Thollet A, Nguyen NT, et al. ZNF217 is a marker of poor prognosis in breast cancer that drives Epithelial-Mesenchymal transition and invasion[J]. Cancer Res,2012, 72 (14) : 3593-606. DOI: 10.1158/0008-5472.CAN-11-3095. |
| [5] | Littlepage LE, Adler AS, Kouros-Mehr HA, et al. The transcription factor ZNF217 is a prognostic biomarker and therapeutic target during breast cancer progression[J]. Cancer Discov,2012, 2 (7) : 638-51. DOI: 10.1158/2159-8290.CD-12-0093. |
| [6] | 孙桂芹, 钟梅, 丁彦青, 等. ZNF217基因在卵巢癌中的表达及意义[J]. 南方医科大学学报,2009, 29 (4) : 685-8. |
| [7] | 黎静, 钟梅, 宋兰林, 等. ZNF217肿瘤基因在卵巢浆液性囊腺癌20号染色体的表达及其临床意义[J]. 南方医科大学学报,2006, 26 (6) : 824-5. |
| [8] | Rooney PH, Boonsong A, Mcfadyen MC, et al. The candidate oncogene ZNF217 is frequently amplified in colon cancer[J]. J Pathol,2004, 204 (3) : 282-8. DOI: 10.1002/(ISSN)1096-9896. |
| [9] | Mao XG, Yan M, Xue XY, et al. Overexpression of ZNF217 in glioblastoma contributes to the maintenance of glioma stem cells regulated by hypoxia-inducible factors[J]. Lab Investig,2011, 91 (7) : 1068-78. DOI: 10.1038/labinvest.2011.56. |
| [10] | Miller J, Mclachlan AD, Klug A. Repetitive Zinc2binding domains in the protein transcription factor ⅢA from Xenopus oocytes[J]. EMBO J,1985, 4 (6) : 1609-14. |
| [11] | Collins C, Rommens JM, Kowbel D, et al. Positional cloning of ZNF217 and NABC1: genes amplified at 20q13[J]. Proc Natl Acad Sci U S A,1998, 95 (15) : 8703-8. DOI: 10.1073/pnas.95.15.8703. |
| [12] | Krig SR, Miller JK, Frietze S, et al. ZNF217, a candidate breast cancer oncogene amplified at 20q13, regulates expression of the ErbB3 receptor tyrosine kinase in breast cancer cells[J]. Oncogene,2010, 29 (40) : 5500-10. DOI: 10.1038/onc.2010.289. |
| [13] | Chen Y, Xiao Y, Ge W, et al. miR-200b inhibits TGF-β1-induced epithelial-mesenchymal transition and promotes growth of intestinal epithelial cells[J]. 2013: e541. |
| [14] | Li HJ, Che XM, Zhao W, et al. Diet-induced obesity promotes murine gastric cancer growth through a nampt/sirt1/c-myc positive feedback loop[J]. Oncol Rep,2013, 30 (5) : 2153-60. |
| [15] | Chang L, Graham PH, Hao J, et al. Acquisition of epithelialmesenchymal transition and cancer stem cell phenotypes is associated with activation of the PI3K/Akt/mTOR pathway in prostate cancer radioresistance[J]. Cell Death Dis,2013, 4 : e875. DOI: 10.1038/cddis.2013.407. |
 2015, Vol. 35
2015, Vol. 35
