2. 福建医科大学附属第二医院内分泌科,福建 泉州 362000
2. Department of Endocrinology, Second Hospital Affiliated to Fujian Medical University, Quanzhou 362000, China
色素上皮衍生因子(PEDF)是一种具有多种生物学效应的脂肪因子,目前被认为与糖尿病、代谢综合征、肥胖症、多囊卵巢综合征及冠心病密切相关[1-2]。由于存在共同的发病机制和危险因素,2型糖尿病往往和非酒精性脂肪肝病(NAFLD)并存。国外文献表明伴有NAFLD可导致2型糖尿病患者血糖更难控制,并可加速如冠心病和慢性肾脏疾病等糖尿病重要慢性并发症的发展和恶化[3]。而2型糖尿病患者PEDF启动子区基因多态性与NAFLD的相关性研究目前国内外研究尚少。本研究通过福建地区2型糖尿病患者血清PEDF水平及PEDF启动子区-358位点G→A多态性,旨在从PEDF角度探讨2型糖尿病与NAFLD间的关系。
1 资料与方法 1.1 研究对象选择2012年9月~2014年8月在福建医科大学附属第二医院(泉州医学高等专科学校教学医院)内分泌科住院的2型糖尿病汉族患者452人。所有入选的2型糖尿病患者均符合1999年WHO糖尿病的诊断标准,而NAFLD则依据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2010年修订的非酒精性脂肪肝病诊疗指南[4]进行诊断,由专门的超声科主治医师对患者行肝脏彩超进行影像学诊断。排除标准:(1)1型糖尿病或其他特殊类型糖尿病;(2)妊娠或哺乳期妇女;(3)合并严重感染或近期有创伤、手术(6个月内);(4)严重心、脑、肝、肾功能损害及影响糖代谢的其他内分泌疾病;(5)酮症酸中毒及其他糖尿病急性并发症;(6)有长期饮酒史或饮酒折含乙醇量男性每周≥140 g,女性每周≥70 g;(7)病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;(8)长期口服噻唑烷二酮类药物;(9)近期口服调脂药物。根据有无合并NAFLD将2型糖尿病患者分为DM1组(合并NAFLD的T2DM)282人,男性166人,女性116人,年龄(56.76±12.28)岁;DM2组(不合并NAFLD的T2DM)170人,男性90人,女性80人,年龄(55.18±11.89)岁。两组间性别、年龄差异无统计学意义(P>0.05)。
1.2 方法 1.2.1 临床资料由专人对受试者检测身高(H)、体质量(W)、腰围(WC)、臀围(HC)、血压(BP),计算体重指数(BMI)、腰臀比(WHR);酶法全自动生化仪检测甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿酸(UA)、空腹血糖(FPG);采用化学发光法测定空腹胰岛素(FINS);采用高压液相色谱法检测糖化血红蛋白(HbA1c);由影像学医师采用彩色多普勒超声仪5.0 MHz探头测定颈动脉内膜中层厚度(CIMT);体重指数=体质量(kg)/身高2(m2),腰臀比=腰围/臀围,稳态模型胰岛素抵抗指数(HOMA-IR)=空腹血糖×空腹胰岛素/22.5。
1.2.2 血清色素上皮衍生因子测定以PEDF酶联免疫吸附测定试剂盒(美国Cloud-Clone公司生产,批内CV < 10%,批间CV < 12%)运用双抗体夹心ELISA法定量测定人血清标本中PEDF水平;将PEDF抗体包被于微孔板中,制成固相载体,向微孔中分别加入标准品或标本,其中的PEDF与连接于固相载体上的抗体结合,然后加入生物素化的PEDF抗体,将未结合的生物素化抗体洗净后,加入HRP标记的亲和素,再次彻底洗涤后加入四甲基联苯胺(TMB)底物显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的PEDF呈正相关。用酶标仪在450nm波长下测定吸光度,计算样品浓度。
1.2.3 色素上皮衍生因子基因多态性提取全血DNA进行PCR扩增。从Genbank中查取人色素上皮衍生因子基因序列,用Prime5软件进行在线引物设计,上游引物为5'-CTACAGGTGCGCGCCAAC-3',下游引物为5'-CTAAGGCGCACACATTTGCACA-3'。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸1 min,共37个循环;72 ℃延伸5 min。用限制性内切酶HincⅡ将PCR产物酶切,37 ℃水浴16 h消化。行2%琼脂糖凝胶电泳,采用凝胶成像分析仪分析,得出该SNP的基因分型结果:只于351 bp处出现条带为GG型(无变异纯合子),于280 bp和71 bp两处出现条带者为AA型(变异纯合子),于351 bp、280 bp和71 bp三处出现条带者为GA型(杂合子)(图 1)。
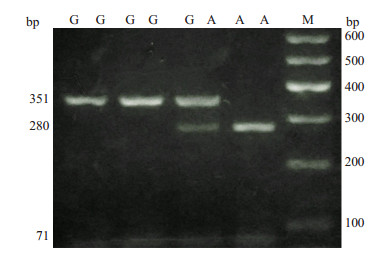
|
图 1 色素上皮衍生因子基因启动子区SNP-358G→A基因型电泳结果 Figure 1 Electrophoresis showing the genotypes found at SNP-358G→A in the promoter region of pigment epithelium-derived factor gene. |
应用SPSS17.0软件进行统计学分析。计量资料用均数±标准差表示,计量资料组间比较采用两样本t检验,不符合正态分布性的资料则用秩和检验。计数资料组间比较用χ2检验。二分类非条件Logistic回归分析对T2DM患者发生NAFLD的影响因素进行分析。以Hardy-Weinberg平衡检验确定研究样本的群体代表性,各组基因型和等位基因的分布频率用χ2检验,相对风险度以比值比(Odds ratio, OR)和95% CI表示。P < 0.05为差异有统计学意义。
2 结果 2.1 DM1组和DM2组的临床资料比较DM1组BMI、WC、HC、WHR、DBP、AST、ALT、TG、TC、LDL-C、UA、HOMA-IR、HbA1c、CIMT均高于DM2组,而DM1组HDL-C低于DM2组,且差异有统计学意义(P < 0.05)。DM1组血清PEDF水平高于DM2组,差异有统计学意义(P < 0.05,表 1)。
| 表 1 DM1组与DM2组临床和生化数据比较 Table 1 Comparison of clinical and biochemical parameters between patients with non-alcoholic fatty liver disease (DM1 group) and those without (DM2 group) |
以NAFLD为因变量的二分类非条件Logistic回归分析,结果显示PEDF、BMI、WC、ALT、TG、TC、HDL-C、HbA1c作为独立影响因素影响T2DM患者NAFLD的发生(表 2)。
| 表 2 T2DM患者发生NAFLD的影响因素Logistic回归分析 Table 2 Logistic regression analysis of the risk factors of NAFLD in T2DM patients |
采用HWE软件进行Hardy-Weinberg吻合度检验,在DM1、DM2两组中色素上皮衍生因子基因SNP-358位点基因型个体数的观察值和期望值差异无统计学意义(P>0.05),表明该位点在本研究人群中的基因频率符合Hardy-Weinberg平衡,本研究群体具有群体代表性。
2.3.2 基因型和等位基因的分布频率色素上皮衍生因子基因启动子区SNP-358G→A的基因型(GG型、GA型和AA型)和等位基因(G/A)在DM1、DM2两组间的分布存在差异,有统计学意义(P < 0.05,表 3)。
| 表 3 DM1组与DM2组基因型和等位基因的分布频率 Table 3 Comparison of genotype and allele frequencies between DM1 and DM2 groups [n(%)] |
T2DM患者色素上皮衍生因子基因-358位点GA基因型比GG基因型更易出现NAFLD,风险差异有统计学意义(P < 0.05),前者为后者的2.032倍;-358位点GA+AA基因型比GG基因型更易出现NAFLD,风险差异有统计学意义(P < 0.05),前者为后者的2.068倍;但AA基因型和GA基因型相比及AA基因型和GG基因型相比,出现NAFLD的风险差异无统计学意义(P>0.05,表 4)。
| 表 4 T2DM患者中PEDF-358G→A位点SNP与NAFLD的风险分析 Table 4 SNP polymorphisms of PEDF-358G→A and the risk of NAFLD in T2DM |
NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤,被认为是代谢综合征在肝脏的表现[5]。本结果表明T2DM合并NAFLD组(DM1组)的体质量指数、腰围、臀围、腰臀比、胰岛素抵抗指数明显高于T2DM不合并NAFLD组(DM2组),说明肥胖特别是中心性肥胖的T2DM患者更容易合并NAFLD,且合并NAFLD的T2DM患者胰岛素抵抗更加明显。DM1组的糖化血红蛋白明显高于DM2组,说明合并NAFLD可导致T2DM患者血糖更难控制。CIMT是糖尿病患者缺血性脑卒中的独立危险因素,并且与冠心病密切相关;DM1组的CIMT值明显高于DM2组亦提示NAFLD可能使2型糖尿病患者发生冠心病和缺血性脑卒中等慢性并发症的风险性增加。DM1组的ALT、AST明显高于DM2组,提示ALT、AST是NAFLD引起的肝功能损害的主要标记。DM1组的TG、TC、LDL-C、UA、DBP明显高于DM2组,而DM1组的HDL-C明显低于DM2组,说明合并NAFLD的T2DM患者更易出现尿酸和血压的升高及脂代谢紊乱,而血脂谱的改变也与国外学者的研究结果[6]相一致。以NAFLD为因变量的二分类非条件Logistic回归分析结果显示T2DM患者NAFLD的发生过程中BMI、WC、ALT、TG、TC、HbA1c为独立危险因素,而HDL-C为独立保护性因素。
胰岛素抵抗是T2DM和NAFLD的发病机制的“共同土壤”。而多项研究表明,PEDF与胰岛素抵抗密切相关。Galhardo等[7]发现血清PEDF水平与代表胰岛素抵抗的黑棘皮症呈正相关;另外Yilmaz等[8]报道了经肝活检确诊NAFLD的患者血清PEDF水平明显升高,认为PEDF是肝脏脂肪变的新型生物学标志。本研究结果表明DM1组的血清PEDF水平明显高于DM2组,且以NAFLD为因变量的二分类非条件Logistic回归分析结果亦显示血清PEDF是T2DM患者发生NAFLD的独立影响因素。而血清PEDF水平的升高考虑为胰岛素抵抗的反馈表现,可改善胰岛素抵抗,对胰岛素敏感性起保护作用。Akin等[9]报道二甲双胍对新诊断的2型糖尿病患者治疗6个月后,血清PEDF水平明显提高,且治疗后的血清PEDF水平与糖化血红蛋白水平呈负相关。Yamagishi等[10]发现糖尿病或代谢综合征患者可引起体内糖基化终末产物(AGEs)的产生明显增多,AGEs则刺激肝脏和脂肪细胞表达和分泌过多的PEDF来反馈抑制AGEs所产生的有害作用,减少胰岛素抵抗;Yoshida等[11]发现PEDF可阻断AGEs的信号通路,阻碍肝脏中AGEs与AGEs受体相结合,从而抑制Ras相关产物C3肉毒素底物-1(Rac-1)活化及随后的c-Jun终端激酶(JNK)信号通路激活,减少胰岛素受体底物-l(IRS-1)的丝氨酸磷酸化,减轻肝脏胰岛素抵抗。此外,PEDF可通过NADPH氧化酶途径和线粒体系统抑制高糖诱导的活性氧簇的生成,改善氧化应激[12],在NAFLD的“第二次打击”过程中发挥保护作用;PEDF亦可通过抑制NADPH氧化酶阻断血管紧张素Ⅱ的信号传导[13],减少肝脏线粒体的氧化性损伤和损害线粒体脂肪酸的β氧化[14]。PEDF还可通过多种途径调节TNF-α、IL-6、IL-10、IL-18等炎性因子的表达,抑制与T2DM和NAFLD均密切相关的慢性低度炎症反应。
在接触类似危险因素的T2DM患者间,NAFLD发病率却差异较大,疾病发展也不尽相同,提示T2DM合并NAFLD的发生可能与遗传因素有关。PEDF由1个α/β核心丝氨酸、3个β-折叠和10个α-螺旋组成,含有418个氨基酸,其相对分子质量约为50 000 [15];DNA序列分析显示PEDF属于丝氨酸蛋白酶抑制剂基因家族。目前关于T2DM患者PEDF基因多态性的研究主要集中在其与糖尿病微血管并发症的相关性。Yamagishi等[16]发现,PEDF基因外显子区Met72Thr(rs1136287)SNP与年龄相关的黄斑退行性变有关,而与糖尿病微血管并发症无关;Iizuka等[17]研究发现PEDF启动子区rs1294385SNP与糖尿病视网膜病变有关。而关于T2DM患者PEDF启动子区SNP位点与NAFLD的相关性目前国内外研究尚少,本研究选取PEDF基因启动子区SNP -358G→A(rs1294385),探索其与T2DM患者NAFLD发生发展的关系,并发现两者存在相关性。PEDF -358位点基因型检测结果显示:DM1组和DM2组均存在GG、GA、AA三种基因型,其中AA基因型频率较低;基因型分布显示DM1组与DM2组相比差异有统计学意义,且DM1组的A等位基因频率高于DM2组。T2DM患者色素上皮衍生因子启动子区基因-358位点GA基因型发生NAFLD的风险性增高,是GG基因型的2.032倍;A等位基因携带者(GA+AA基因型)比GG基因型更易出现NAFLD,风险性前者为后者的2.068倍;这说明携带A等位基因使T2DM患者发生NAFLD的风险性提高。而AA基因型与GG基因型相比,出现NAFLD的风险差异无统计学意义,考虑可能与AA基因型的例数较少有关。Chung等[18]研究表明在PEDF基因敲除的小鼠肝脏,甘油三酯的含量增加,出现明显的肝细胞脂肪变性,而给予重组PEDF治疗后,脂肪甘油三酯水解酶(ATGL)活性增强,甘油三酯的含量减少,肝脏的脂肪变性明显减轻。我们推测PEDF基因单核苷酸的变异可能使发生肥胖及中心性肥胖的风险性升高,使脂肪在腹部皮下及内脏蓄积,造成或加重胰岛素抵抗高胰岛素血症,降低脂酰CoA合成酶、肉碱脂酰转移酶I的表达,减少线粒体及过氧化氢酶体对长链脂肪酸的β-氧化,增加甘油三酯的含量,出现肝细胞脂肪变性。
总之,通过本研究提示血清PEDF是T2DM患者NAFLD的发生发展的独立影响因素,血清PEDF水平的升高考虑为胰岛素抵抗的反馈表现。T2DM患者PEDF基因启动子区-358位点(rs1294385)多态性与NAFLD的发生发展相关,携带A等位基因可能增加T2DM患者发生NAFLD的易感性,但PEDF基因通过哪些机制影响PEDF功能尚有待进一步研究。
| [1] | Cheng Q, Xia W, Yang S, et al. Association of serum pigment epithelium-derived factor with high-sensitivity C-reactive protein in women with polycystic ovary syndrome[J]. J Endocrinol Invest,2013, 36 (8) : 632-5. DOI: 10.1007/BF03346755. |
| [2] | Choi KM, Hwang SY, Hong HC, et al. C1q/TNF-related protein-3 (CTRP-3) and pigment epithelium-derived factor (PEDF) concentrations in patients with type 2 diabetes and metabolic syndrome[J]. Diabetes,2012, 61 (11) : 2932-6. DOI: 10.2337/db12-0217. |
| [3] | Targher G, Byrne CD. Clinical review: nonalcoholic fatty liver disease: a novel cardiometabolic risk factor for type 2 diabetes and its complications[J]. J Clin Endocrinol Metab,2013, 98 (2) : 483-95. DOI: 10.1210/jc.2012-3093. |
| [4] | 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中华肝脏病杂志,2010, 18 (3) : 163-6. |
| [5] | Wang Y, Li YY, Nie YQ, et al. Association between metabolic syndrome and the development of non-alcoholic fatty liver disease[J]. Exp Ther Med,2013, 6 (1) : 77-84. |
| [6] | Trojak A, Waluś-Miarka M, Wo?niakiewicz E, et al. Nonalcoholic fatty liver disease is associated with low HDL cholesterol and coronary angioplasty in patients with type 2 diabetes[J]. Med Sci Monit,2013, 19 (12) : 1167-72. |
| [7] | Galhardo J, Hunt LP, Shield JP. Serum levels of pigment epithelium-derived factor (PEDF) are positively associated with acanthosis nigricans in obese adolescents[J]. Diabet Med,2012, 29 (7) : e117-20. DOI: 10.1111/j.1464-5491.2012.03592.x. |
| [8] | Yilmaz Y, Eren F, Ayyildiz T, et al. Serum pigment epitheliumderived factor levels are increased in patients with biopsy-proven nonalcoholic fatty liver disease and independently associated with liver steatosis[J]. Clin Chim Acta,2011, 412 (23/24) : 2296-9. |
| [9] | Akın S, Aksoy DY, Cınar N, et al. Pigment epithelium-derived factor increases in type 2 diabetes after treatment with metformin[J]. Clin Endocrinol (Oxf),2012, 77 (6) : 852-6. DOI: 10.1111/j.1365-2265.2012.04341.x. |
| [10] | Yamagishi S, Matsui T, Adachi H, et al. Positive association of circulating levels of advanced glycation end products (AGEs) with pigment epithelium-derived factor (PEDF) in a general population[J]. Pharmacol Res,2010, 61 (2) : 103-7. DOI: 10.1016/j.phrs.2009.07.003. |
| [11] | Yoshida T, Yamagishi S, Nakamura K, et al. Pigment epitheliumderived factor (PEDF) ameliorates advanced glycation end product (AGE)-induced hepatic insulin resistance in vitro by suppressing Rac-1 activation[J]. Hormone and Metabolic Research,2008, 40 (9) : 620-5. DOI: 10.1055/s-0028-1083785. |
| [12] | Zheng Z, Chen H, Zhao H, et al. Inhibition of JAK2/STAT3-mediated VEGF upregulation under high glucose conditions by PEDF through a mitochondrial ROS pathway in vitro[J]. Invest Ophthalmol Vis Sci,2010, 51 (1) : 64-71. DOI: 10.1167/iovs.09-3511. |
| [13] | Yamagishi S, Nakamura K, Ueda S, et al. Pigment epitheliumderived factor (PEDF) blocks angiotensin Ⅱ signaling in endothelial cells via suppression of NADPH oxidase: a novel anti-oxidative mechanism of PEDF[J]. Cell Tissue Res,2005, 320 (3) : 437-45. DOI: 10.1007/s00441-005-1094-8. |
| [14] | Wei Y, Clark SE, Thyfault JP, et al. Oxidative stress-mediated mitochondrial dysfunction contributes to angiotensin Ⅱ-induced nonalcoholic fatty liver disease in transgenic Ren2 rats[J]. Am J Pathol,2009, 174 (4) : 1329-37. DOI: 10.2353/ajpath.2009.080697. |
| [15] | Kawaguchi T, Yamagishi SI, Sata M. Structure-function relationships of PEDF[J]. Curr Mol Med,2010, 10 (3) : 302-11. DOI: 10.2174/156652410791065255. |
| [16] | Yamagishi S, Nakamura K, Inoue H, et al. Met72Thr polymorphism of pigment epithelium-derived factor gene and susceptibility to agerelated macular degeneration[J]. Med Hypotheses,2005, 64 (6) : 1202-4. DOI: 10.1016/j.mehy.2005.01.017. |
| [17] | Iizuka H, Awata T, Osaki M, et al. Promoter polymorphisms of the pigment epithelium-derived factor gene are associated with diabetic retinopathy[J]. Biochem Biophys Res Commun,2007, 361 (2) : 421-6. DOI: 10.1016/j.bbrc.2007.07.025. |
| [18] | Chung C, Doll JA, Gattu AK, et al. Anti-angiogenic pigment epithelium-derived factor regulates hepatocyte triglyceride content through adipose triglyceride lipase (ATGL)[J]. J Hepatol,2008, 48 (3) : 471-8. DOI: 10.1016/j.jhep.2007.10.012. |
 2015, Vol. 35
2015, Vol. 35
