恶性肿瘤恶性多形性神经胶质细胞瘤(GBM)是最常见的脑部原发性肿瘤,发病率占颅内肿瘤的35%~60%,因其多成侵袭性生长手术难以完全切除,复发率极高平均生存仅为8~12月,是一种严重危害人类健康的癌症[1]。以往研究发现胶质瘤生长过程中存在明显的缺氧现象,癌组织中存在的缺氧是肿瘤预后不良的指标,也可能是导致肿瘤细胞增殖、迁移及血管生成的因素[2-3]。前期研究证实缺氧诱导胶质瘤细胞中鞘氨醇激酶1(sphingosine kinase 1, SphK1)表达升高,影响胶质瘤细胞侵袭性生长[4]。SphK1作为蛋白激酶可调节一种脂质分子鞘氨醇-1-磷酸(sphingosine -1-phosphate, S1P)的生成,S1P调控胞内钙离子的平衡进而影响肿瘤细胞的增殖与迁移也有报道[5-6]。但目前为止缺氧微环境下胶质瘤细胞侵袭性生长的机制不明。本研究将在缺氧微环境下探讨SphK1对胞内钙稳态的影响,进一步探讨缺氧微环境下胶质瘤细胞增殖的分子机制,可有助于深入了解缺氧微环境下细胞信号转导机制。
1 材料和方法 1.1 材料DMEM、Lipofectamine 2000、Trizol、胎牛血清及胰酶均购自Life technology;fluo-3-AM及CCK-8购自dojindo;SphK抑制剂SKI、钙通道激动剂OAG及氯化钴(CoCl2)购自Sigma Aldrich;SphK1、GADPH多克隆抗体购自Cell Signaling Technology;RT试剂盒及Real-time PCR试剂盒购自Takara。
1.2 细胞培养胶质瘤细胞株U87MG培养于CO2培养箱,条件:21% O2,5% CO2;细胞接种24 h后细胞后,更换新鲜培养基,进行缺氧处理(5% CO2,3% O2,92% N2)或150 μmol/L CoCl2。使用三气培养箱(Forma Scientific)制作缺氧环境,最短可在10 min内达到3% O2。新鲜培养基于缺氧环境(5% CO2,3% O2,92% N2)预先孵育至少16~24 h,以制备低氧培养基。
1.3 细胞转染转染步骤简述如下:接种细胞,24 h后达到20%~30%汇合度进行转染。使用lipofectamine 2000将干扰片段siRNA等量转染入胶质瘤细胞。转染72 h后检测mRNA和蛋白水平表达,并进行后续实验。3个针对SphK1编码区不同位点的化学合成的siRNAs由GenePharma公司合成,SphK1 SiRNA-1 CCUAGA GAGUGAGAAGUAUTT,GCGUCAUGCAUCUGU UCUATT;SphK1 SiRNA-2 GCGUCAUGCAUCUGU UCUATT,UAGAACAGAUGCAUGACGCTT。
1.4 CCK-8检测细胞增殖情况细胞计数后,接种于培养板中,施加处理因素;每100 μL培养基中加入10 μL CCK-8于37 ℃孵育4 h;以450 nm检测波长在酶标仪上读取吸光度(A)值,记录结果。按公式:相对细胞数(%)=[(As-Ab)-Ac/(Ac-Ab)]×100%(其中,As为实验孔,Ac为对照孔,Ab为空白孔。)
1.5 荧光定量PCRTrizol提取总RNA,使用RT试剂盒及Real-time PCR试剂盒进行反转录及PCR扩增。引物由Oligo6.0设计,上海英骏生物技术有限公司合成。SphK1上游引物CTGGCAGCTTCCTTAACCAT,下游引物TGTGC AGAGACAGCAGGTTCA;β-actin上游引物ATTGG CAATGAGCGGTTCC,下游引物GGTAGTTTCGTG GATGCCACA;使用Livak and Schmittgen等改良的方法,进行基于内部参照β-actin的定量分析,公式如下:
| $ \begin{array}{l} {\rm{F}}\left({{\rm{Fold}}} \right)={2^{ - \Delta \Delta {\rm{CT}}}}, \Delta \Delta {\rm{CT}}={\left({{{\rm{C}}_{{\rm{T}}{\rm{.Target}}}} - {{\rm{C}}_{{\rm{T}}{\rm{.Actin}}}}} \right)_{{\rm{treated}}}} - \\ {\left({{{\rm{C}}_{{\rm{T}}{\rm{.Target}}}} - {{\rm{C}}_{{\rm{T}}{\rm{.Actin}}}}} \right)_{{\rm{control}}}} \end{array} $ |
提取细胞总蛋白,进行蛋白定量后与上样缓冲液混合;SDS-PAGE电泳后,将蛋白转移至PVDF膜上。封闭后,使用SphK1多克隆抗体(1:1000)、GAPDH多克隆抗体(1:2000),4 ℃孵育过夜;并使用相应HRP标记二抗孵育,ECL化学发光试剂盒检测相应蛋白表达。
1.7 细胞周期检测收集约1×106细胞,PBS漂洗两遍,以预冷的70%乙醇固定,4 ℃过夜。细胞以1000 r/min离心3 min,彻底去除乙醇,将细胞重悬于PBS中,再以1000 r/min离心3 min,弃上清。细胞重悬于100 μL RNA酶溶液中,37 ℃孵育30 min,再以1000 r/min离心3 min,弃上清。用200 μL碘化丙啶染液重悬细胞,室温孵育30 min,流式细胞仪检测。
1.8 Ca2+离子浓度动态变化测定将细胞接种于专用的激光共聚焦培养皿,尽量使细胞分散,以利于单细胞水平监测钙浓度。细胞首先在培养箱内与10 μmol/L的fluo-4AM避光37 ℃孵育30 min,孵育完毕后用HEPEs液漂洗3次。最后,加入含钙的HEPEs液体。通过激光共聚焦显微镜连续监测胞内钙浓度变化
1.9 统计学分析实验数据以均数±标准差表示,数据经SPSS 17.0软件包处理。多组样本均数比较,使用单因素方差分析和LSD多重比较法。P < 0.05则认为存在显著性差异。
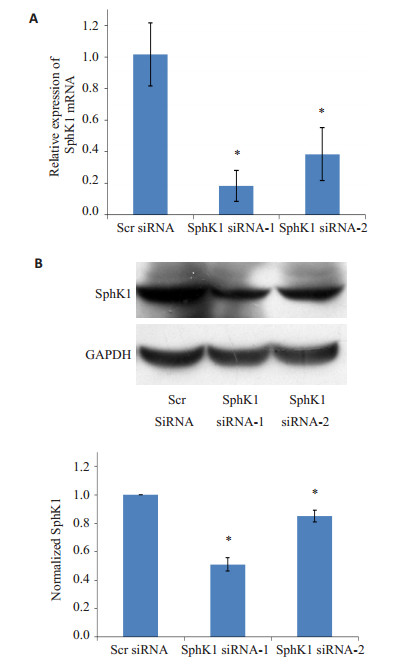
2 结果 2.1 RNA干扰下调SphK1在U87MG细胞中的表达分别使用两个的针对SphK1不同编码区位置的siRNAs转染细胞。转染后72 h,Real-time RT-PCR显示,相对于阴性对照siRNA组,两个SphK1特异性的siRNAs:SphK1 siRNA-1和SphK1 siRNA-2分别使SphK1 mRNA减少到18.2%和38.3%(P < 0.05,图 1A)。转染后72 h,两个siRNAs分别使SphK1蛋白减少到对照组的51.0%和85.2%(P < 0.05,图 1B)。
|
图 1 RNA干扰下调SphK1在U87MG胶质瘤细胞中的表达 Figure 1 SphK1 knockdown in U87MG cells by the siRNA constructs. A: SphK1 mRNA expression detected by real-time RT-PCR; B: SphK1 protein expression detected by Western blotting (B). *P < 0.05 vs Scr siRNA (negative control). |
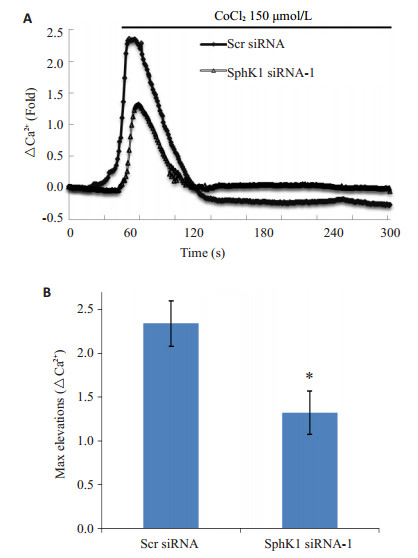
U87MG胶质瘤细胞下调SphK1表达后,钙荧光探针Fluo-4AM标记细胞内钙,加入化学缺氧模拟物CoCl2通过激光共聚焦显微镜连续监测胞内钙浓度变化,结果显示SphK1特异性干扰显著抑制细胞钙内流(图 2)。
|
图 2 SphK1表达下调对缺氧诱导的胞内钙浓度变化的影响 Figure 2 Calcium influx induced by hypoxia was attenuated by downregulation of SphK1. A: Cytoplasmic Ca2+ was assessed in Fluo-4/AM-loaded U87MG cells; B: Bar chart showing the maximal elevation of the curve in Fluo-4/AM imaging. *P < 0.05 vs Scr siRNA. |
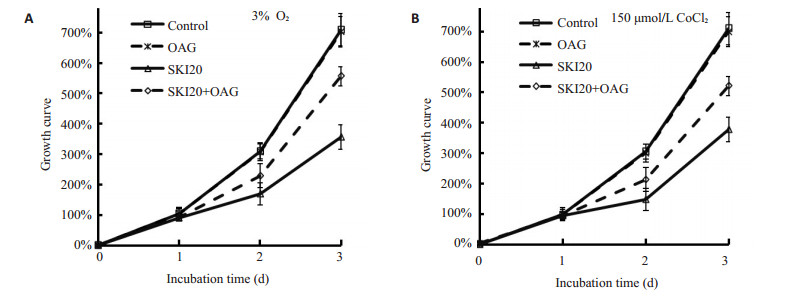
将胶质瘤细胞U87MG分为四组对照组、OAG处理组(100 μmol/L)、SphK抑制剂SKI处理组(20 μmol/L)及OAG、SKI共处理组,细胞置于3% O2物理缺氧或150 μmol/L CoCl2化学模拟缺氧条件下继续培养。结果显示:在3% O2条件下培养对照组48、72 h细胞相对增长分别为309.0%、709.9%,OAG处理组48、72 h细胞相对增长分别为307.7%、702.4%,SKI处理组48、72 h细胞相对增长分别为169.0%、355.7%,OAG、SKI共处理组48、72 h细胞相对增长分别为228.7%、586.5%;150 μmol/L CoCl2化学模拟缺氧条件下对照组48、72 h细胞相对增长分别为305.3%、709.8%,OAG处理组48、72 h相对细胞数分别为300.5%、699.7,SKI处理组48、72 h细胞相对增长分别为148.1%、377.6%,OAG、SKI共处理组48、72 h细胞相对增长分别为213.6%、521.3%。OAG对胶质瘤的细胞生长无明显影响,SKI明显抑制了缺氧条件下胶质瘤细胞的生长,而OAG则显著减弱了SKI的抑制效应(P < 0.05,图 3)。
|
图 3 缺氧条件下OAG减弱SKI对胶质瘤细胞生长的抑制作用 Figure 3 Effect of OAG on the growth of U87MG cells subjected to hypoxia induced by exposure to 3% oxygen (A) and 150 μmol/L cobalt chloride (B). *P < 0.05 vs control, ★P < 0.05 vs SKI. |
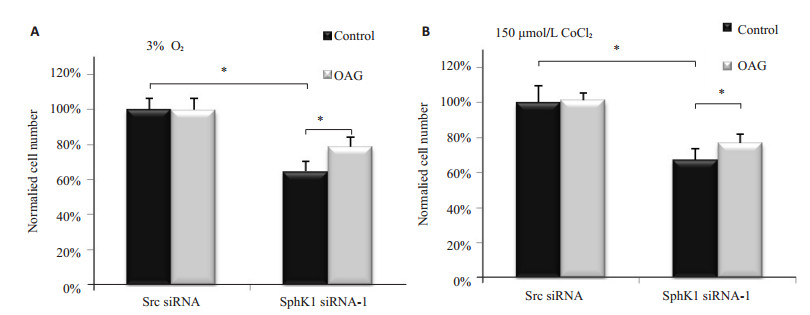
为进一步验证OAG在SphK1调控胶质瘤细胞生长中的影响,RNA干扰下调U87细胞中SphK1表达后,缺氧处理48 h,检测细胞生长情况。结果显示:在3% O2物理缺氧条件下与对照的细胞相比,SphK1 siRNA-1干扰组U87MG细胞生长明显受抑制(64.8% vs 100%),而OAG明显提高干扰处理组细胞活力(78.7% vs 64.8%);在150 μmol/L CoCl2化学模拟缺氧条件下,与对照的细胞相比,SphK1 siRNA-1干扰组U87MG细胞生长明显受抑制(67.4% vs 100%),而OAG明显提高干扰处理组细胞活力(76.9% vs 67.4%),且差异均有显著统计学(P < 0.05,图 4)。提示SphK1的表达下调显著抑制了U87MG细胞在缺氧条件下的生长,而OAG则显著减弱了该抑制效应。
|
图 4 缺氧条件下OAG对胶质瘤细胞生长的影响 Figure 4 Effect of OAG on the growth of transfected U87MG cells exposed to 3% oxygen (A) or 150 μmol/L cobalt chloride (B). *P < 0.05. |
以流式细胞术检测SphK1表达下调对细胞周期的影响,U87MG细胞转染干扰缺氧处理48 h收集细胞,以PI染色上机检测。如表 1所示:在3% O2物理缺氧及150 μmol/L CoCl2化学模拟缺氧条件下,阴性对照组相比,转染SphK1 siRNA-1的U87MG细胞处于G2/M期的细胞数均明显增加(27.3%vs 12.7%,24.7% vs 11.4%);而在转染SphK1 siRNA-1的U87MG细胞中,OAG处理组细胞处于G2/M期的细胞数均明显增加(20.3% vs 27.3%,19.8% vs 24.7%)。结果显示,缺氧条件下SphK1的表达下调显著引起U87MG胶质瘤细胞的周期阻滞于G2/M期,从而抑制细胞增殖;而OAG则显著减弱了SphK1的表达下调引起的周期阻滞。
| 表 1 缺氧条件下(3% O2)SphK1的表达下调对U87MG细胞的周期影响 Table 1 Effect of SphK1 downregulation on cell cycle of U87MG cells under hypoxia |
| 表 2 缺氧条件下(150 μmol/L CoCl2)SphK1的表达下调对U87MG细胞的周期影响 Table 2 Effect of SphK1 downregulation on cell cycle of U87MG cells under hypoxia |
SphKl在结肠癌、乳腺癌、胶质瘤等多种恶性肿瘤细胞中高表达,其高表达不仅能刺激细胞生长,而且可以导致细胞恶性转化,故SphKl本身也具有癌基因的特性[7]。临床资料也显示SphKl高表达的恶性肿瘤患者5年生存期较低表达的患者短暂,而且其高表达可以降低恶性肿瘤细胞对放疗及化疗的敏感性,进一步证实SphK1与肿瘤的发生及发展密切相关[8]。以往及本课题组前期研究发现在胶质瘤常见的病理条件缺氧可以诱导胶质瘤细胞SphKl的表达增高活性增强,SphK1的高表达可促进胶质瘤的增殖,与恶性胶质瘤患者的预后具有密切相关[4, 9]。但缺氧微环境下SphK1如何调控胶质瘤细胞增殖机制不明。
特异性敲除SphKl基因,能够促发一系列肿瘤细胞系发生凋亡,并伴随着鞘磷脂的衍生物水平的显著改变,SphKl发挥癌基因特性与各种肿瘤密切相关的进程中,其调节细胞膜鞘磷脂的衍生物的动态平衡功能为其关键调控因素[10]。作为蛋白激酶SphKl可催化鞘氨醇使其磷酸化生成S1P,目前的研究认为S1P发挥生物学功能主要通过两种方式,一种为细胞外第一信使,以自分泌或旁分泌的方式释放到细胞外,与细胞膜上的受体结合,进而激活下游的信号通路[11-12];另一种为细胞内第二信使,直接在细胞内发挥生物学效应,可影响胞内钙离子的稳态[5, 13-14],但其作用机制不清。本课题研究在缺氧微环境下SphKl对细胞内钙信号的调节,发现在胶质瘤细胞中特异性干扰SphKl的表达显著抑制缺氧诱导的钙离子内流,证实缺氧微环境下SphKl调控细胞内钙离子稳态。提示在缺氧微环境下SphKl生理功能发挥与其下游分子S1P调控的钙信号密切相关。
钙离子作为一种信号分子早为人们所熟知,可以激活下游细胞信号通路,与基因表达及细胞的趋化、迁移、增殖及凋亡等均有密切相关,调控细胞的多种重要的细胞生物学功能,几乎参与所有病理生理进程,在肿瘤的发生发展中也发挥着关键作用[15-16]。以往的研究也发现缺氧微环境可以诱导钙内流,影响细胞内钙离子稳态进而调控细胞的多种重要的细胞生物学功能[17-18]。本课题研究探讨钙离子是否在缺氧微环境条件下SphK1促进胶质瘤增殖的进程中发挥作用,结果显示缺氧微环境下钙通道激活剂OAG可以显著减弱SphK1表达下调活性抑制引起的胶质瘤细胞增殖抑制,并且显著减弱了SphK1的表达下调引起G2/M期的周期阻滞。提示钙信号可能介导缺氧微环境下SphK1对胶质瘤细胞增殖的调控。
综上所述,缺氧微环境下SphKl调控细胞内钙离子稳态,参与胶质瘤细胞增殖的调控,有助于进一步认识缺氧微环境下胶质瘤细胞增殖的信号调控机制。但SphK1如何调节钙信号?钙信号激活之后最终如何影响细胞增殖?这些问题有待于进一步研究。
| [1] | Omuro A, DeAngelis LM. Glioblastoma and other malignant gliomas: a clinical review[J]. JAMA,2013, 310 (17) : 1842-50. DOI: 10.1001/jama.2013.280319. |
| [2] | Amberger-Murphy V. Hypoxia helps glioma to fight therapy[J]. Curr Cancer Drug Targets,2009, 9 (3) : 381-90. DOI: 10.2174/156800909788166637. |
| [3] | Park JJ, Hwang SJ, Park JH, et al. Chlorogenic acid inhibits hypoxia-induced angiogenesis via down-regulation of the HIF-1alpha/AKT pathway[J].Cell Oncol (Dordr), 2015 Jan 6.[Epub ahead of print]. |
| [4] | Anelli V, Gault CR, Cheng AB, et al. Sphingosine kinase 1 is up-regulated during hypoxia in U87MG glioma cells. Role of hypoxia-inducible factors 1 and 2[J]. J Biol Chem,2008, 283 (6) : 3365-75. DOI: 10.1074/jbc.M708241200. |
| [5] | Hinkovska-Galcheva V, Vanway SM, Shanley TP, et al. The role of sphingosine-1-phosphate and ceramide-1-phosphate in Calcium homeostasis[J]. Curr Opin Investig Drugs,2008, 9 (11) : 1192-205. |
| [6] | Kim ES, Cha Y, Ham M, et al. Inflammatory lipid sphingosine-1-phosphate upregulates C-reactive protein via C/EBPβ and potentiates breast cancer progression[J]. Oncogene,2014, 33 (27) : 3583-93. DOI: 10.1038/onc.2013.319. |
| [7] | Heffernan-Stroud LA, Obeid LM. Sphingosine kinase 1 in cancer[J]. Adv Cancer Res,2013, 117 : 201-35. DOI: 10.1016/B978-0-12-394274-6.00007-8. |
| [8] | Alshaker H, Sauer L, Monteil D, et al. Therapeutic potential of targeting SK1 in human cancers[J]. Adv Cancer Res,2013 : 143-200. |
| [9] | Zhang H, Li W, Sun S, et al. Inhibition of sphingosine kinase 1 suppresses proliferation of glioma cells under hypoxia by attenuating activity of extracellular signal-regulated kinase[J]. Cell Prolif,2012, 45 (2) : 167-75. DOI: 10.1111/cpr.2012.45.issue-2. |
| [10] | Kunkel GT, Maceyka M, Milstien S, et al. Targeting the sphingosine-1-phosphate axis in cancer, inflammation and beyond[J]. Nat Rev Drug Discov,2013, 12 (9) : 688-702. DOI: 10.1038/nrd4099. |
| [11] | Aarthi JJ, Darendeliler Ma, pushparaj PN. Dissecting the role of the S1P/S1PR axis in health and disease[J]. J Dent Res,2011, 90 (7) : 841-54. DOI: 10.1177/0022034510389178. |
| [12] | Huang YL, Chang CL, Tang CH, et al. Extrinsic sphingosine 1-phosphate activates S1P5 and induces autophagy through generating endoplasmic reticulum stress in human prostate cancer PC-3 cells[J]. Cell Signal,2014, 26 (3) : 611-8. DOI: 10.1016/j.cellsig.2013.11.024. |
| [13] | Li Q, Chen B, Zeng C, et al. Differential activation of receptors and signal pathways upon stimulation by different doses of sphingosine-1-phosphate in endothelial cells[J]. Exp Physiol,2014, 100 (1) : 95-107. |
| [14] | Kamiya T, Nagaoka T, Omae T, et al. Role of Ca2 +-dependent and Ca2 +-sensitive mechanisms in sphingosine 1-phosphate-induced constriction of isolated porcine retinal arterioles in vitro[J]. Exp Eye Res,2014 : 94-101. |
| [15] | Cichosz G, Czeczot H. Calcium-essential for everybody[J]. Pol Merkur Lekarski,2014, 36 (216) : 407-11. |
| [16] | Stewart TA, Yapa Kt, Monteith GR. Altered calcium signaling in cancer cells[J]. Biochim Biophys Acta, 2014 Aug 20. pii: S0005-2736(14)00298-3. |
| [17] | Yang K, Lu W, Jia J, et al. Noggin inhibits hypoxia-induced proliferation by targeting store-operated calcium entry and transient receptor potential cation channels[J]. Am J Physiol Cell Physiol,2015, 308 (11) : 869-78. DOI: 10.1152/ajpcell.00349.2014. |
| [18] | Tang C, To WK, Meng F, et al. A role for receptor-operated Ca2 + entry in human pulmonary artery smooth muscle cells in response to hypoxia[J]. Physiol Res,2010, 59 (6) : 909-18. |
 2015, Vol. 35
2015, Vol. 35