康斯特保护液(HTK液, Histidine-tryptophaneketoglutarate)是1975年德国Bretschneider等研制的一种仿细胞内液的晶体液,目前仍广泛用于心脏、肝、肾、肺等移植供体的保存,同时也可用作心脏手术中的停搏液[1]。而作为供体保存液,HTK液具有K离子浓度低(9 mmol/L),可避免长期高钾保存液对冠脉内皮的损伤,另外组氨酸缓冲系统能够有效防止细胞酸中毒[2]。但其设计为低压慢速大容量灌注,保护液用量大、费用高,灌注时间长,且渗透压略低,不适合长期保存[3-4]。
一氧化碳(CO)因其与血红蛋白极强的结合能力而被视为有毒气体,中国每年约120万人因CO中毒死亡,因CO的“毒性”作用,目前很少有患者接受其供体器官。但在国外不断有病例报道称使用因CO中毒而导致脑死亡患者的心脏作为供体成功进行了心脏移植[5]。因此将CO用在你器官保存方面逐渐开始受到关注。
而在干燥环境中进行器官保存早在1960即有学者进行了相关研究,但保存效果均不理想[6-8]。Naoyuki等[9]自1998年以来对大鼠离体心脏高压干燥保存方法进行了系列研究,并取得了最长96 h保存复苏的成果[10],证实CO高压干燥保存确实能够有效延长供心保存时间。但其实验仅停留在现象观察,即仅观察大鼠心脏在保存后复跳率的情况,未进一步研究其作用机制及大动物的心脏保存。本实验在日本学者研究基础上,以新西兰兔作为研究对象,进一步观察CO高压干燥环境对离体兔心的保存效果,比较此种保存方法与传统HTK低温浸泡保存对兔心上期保存效果的影响,探讨CO高压干燥保存对延长供心保存时间的作用及可能的机制。
1 材料与方法 1.1 实验动物与分组健康成年新西兰兔85只,体质量为2.0~2.5 kg,购自广州南方医大实验动物科技发展有限公司。根据保存方式随机分为3组,空白对照组(n=5),CO高压干燥保存组(实验组,n=40)和HTK浸泡组(对照组,n=40),各保存组的兔心再根据保存时间分别分为2、4、6、8、10、14、18和24 h组,每时间点各5只。
1.2 主要试剂和药物HTK心肌保存液(Dr.Franz Koehler Chemie GmbH,德国克勒化学制药),3%戊巴比妥钠,肝素(12 500 u/2 mL),Krebs-Henseleit缓冲液(K-H液,自配,配方:去离子水500 mL,NaCl 3.455 g,NaHCO3 1.049 g,KCl 0.176g,KH2PO4 0.080 g,Glu 2.979 g,CaCl2·2H2O 0.184 g,MgSO4 0.071 g),高糖K-H液(即Glu浓度为普通K-H缓冲液的3倍),10%甲醛固定液,2.5%戊二醛固定液,Anti-LDH(Santa Cruz公司),Anti-MB(sigma公司),Anti-CK-MB(abcam公司),Anti-AST(uscnk公司)。
1.3 实验方法成年新西兰兔称质量,经耳缘静脉注射3%戊巴比妥钠(2 mg/kg)麻醉,并注射肝素(125 U/kg)。正中开胸迅速取出心脏,并置于4 ℃冷K-H缓冲液中停跳、漂洗,用手指轻轻挤压心脏,使心腔内残余血液排除,修剪心脏周围组织,游离出升主动脉。将修剪好的心脏挂于Langendorff灌注装置上,心脏处于(37±1)℃恒温器中,主动脉根部灌注37 ℃、持续通氧(95% O2+5% CO2)、pH为7.4的K-H液,灌注压力维持在(80±5)cmH2O。离体心脏复跳后剪开肺动脉根部使冠脉回流液充分引流,随后剪开左心耳,将带球囊的动脉管经左心房插入左心室内,连接压力传感器,并向球囊内缓慢注入蒸馏水,使左心室舒张末压力维持在10 mmHg左右。在心尖部及右心耳处放置心外膜电极,连接Powerlab生物信号采集处理系统。持续灌注10 min后测血流动力学指标。停止K-H液灌注,改用4 ℃ HTK液6 mL经主动脉逆灌,使心脏停跳。
1.3.1 HTK浸泡保存组用4 ℃ HTK保存液再次灌注心脏(灌注压80 cmH2O),将心脏置于4 ℃ HTK保存液中浸泡,分别保存2,4,6,8,10,14,18和24 h。
1.3.2 CO高压干燥保存组用4 ℃高糖K-H缓冲液灌注心脏(灌注压80 cmH2O),将心脏悬挂于特制高压气体罐中加压,总体压力缓慢提升至4000 hPa(PaO2:PaCO=4:1)[11],置于4 ℃环境中分别保存2、4、6、8、10、14、18和24 h(图 1)。
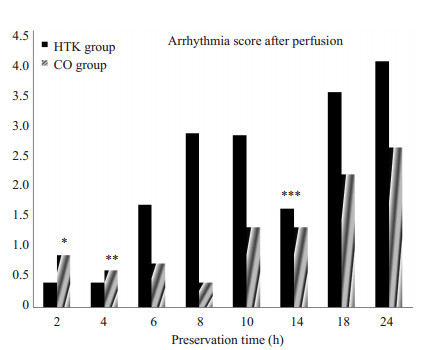
|
图 1 空白对照组、HTK和CO组心律失常评分 Figure 1 Comparison of arrhythmia scores at different time points between HTK and CO groups. Five rabbits in each group at each time point. Significant differences were found between the two group at all the time points (P < 0.05) but 2, 4 and 14 h (*P=0.081, **P=0.739, ***P=0.395, respectively). |
不需保存,经过第1次灌注后直接取左室面心肌组织送检。
经各时间点保存后,取出心脏,置于Landendorff装置下灌注30 min。
心脏灌注5 min后开始记录记录左心室收缩末压(left ventricular systolic pressure, LVSP)、左心室舒张末压(left ventricular diastolic pressure, LVDP)及心电图。
心律失常分析根据Lambeth规则[12]进行分析,评分标准参考Curtis [13]和Ravingerova [13]等方法,标准如下:正常为0分,早搏为1分,二联律/齐射为2分,室速为3分,非持续性室颤为4分,持续性室颤为5分。
离体兔心持续灌注30 min后用4 ℃冷HTK液灌停心脏,在取左室面1 g心肌组织,检测心肌中心功酶及肌钙蛋白变化。为了解离体兔心长期保存后心肌超微结果变化,在HTK浸泡组及CO干燥保存组分别保存24 h后的心肌组织中取1 mm3左室面心肌组织,用2.5%戊二醛固定包埋,切片,在透射电子显微镜下观察心肌超微结构。
1.4 统计学方法统计学处理采用SPSS统计学软件,数据以均数±标准差表示。各组间计量资料采用单因素方差分析、析因分析进行比较。心律失常评分采用非参数秩和检验(Kruskal-wallis H)进行分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组动物实验情况3个实验组实验动物在体质量上无明显差异,而CO干燥组与HTK浸泡保存组在取心时间上无明显差异(表 1)。
| 表 1 各组动物实验过程情况 Table 1 Characteristics of the animals (Mean±SD) |
再灌注5 min后离体兔心心律趋于稳定,心律评分结果如下:2组兔心评分值均随保存时间的延长呈上升趋势,其中2、4和14 h时间点下差异无统计学意义(分别为P=0.081,P=0.739,P=0.395),而其余各时间点内两实验组之间存在明显差异(P值均 < 0.05,图 1)。
2.3 心肌收缩力情况3个实验组保存前左室收缩压波动在102~106 mmHg,无明显上升及下降趋势,3组间差异无统计学意义(P>0.05)(图 2A)。保存前舒张压波动在10~11.5 mmHg,同样无明显上升及下降趋势,3组间差异也无统计学意义(P>0.05,图 2B)。即3组兔心在保存前情况无明显差异。
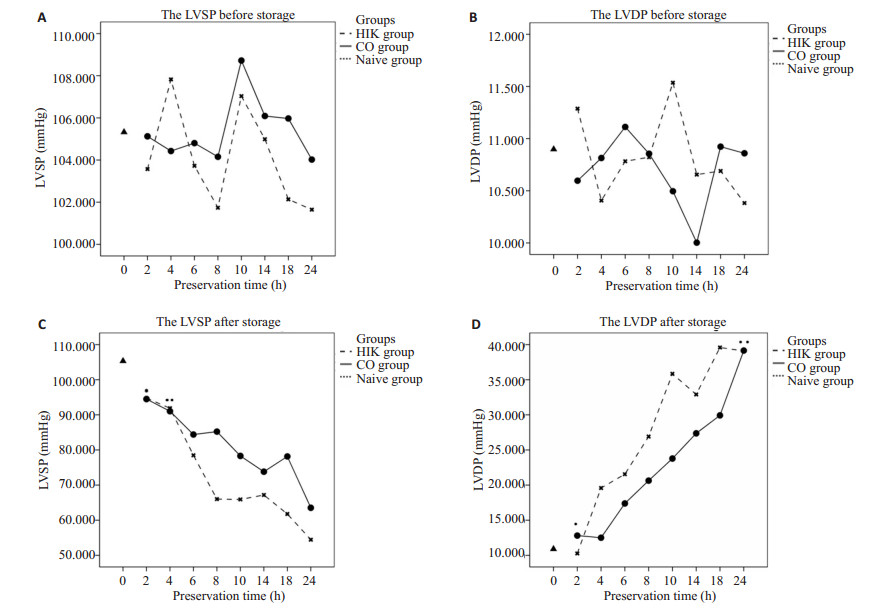
|
图 2 保存前后心肌舒缩功能随时间变化情况 Figure 2 Comparison of cardiac systolic (A) and diastolic (B) function at different time points among the 3 groups. A and B Show LVSP and LVDP before storage, respectively. P>0.05 2-24 h vs 0 h for both CO and HTK groups. P>0.05 between CO and HTK groups at each time point. C: LVSP after storage. *P=0.628 and **P=0.310 CO vs HTK at 2 and 4 h, respectively. P < 0.05 at the remaining time points between the two groups. D: LVDP after storage. *P=0.093 and **P=0.499 CO vsHTK at 2 and 24 h, respectively. P < 0.05 at the remaining time points between the two groups. |
而经过不同保存方式及保存时间后,CO干燥组与HTK浸泡组之间存在明显差异。经过不同保存方式保存后,2组兔心左室收缩压均随保存时间的延长呈下降趋势,而HTK浸泡组收缩压下降趋势更为明显。在2 h及4 h时间点,两组兔心收缩压无明显差异(P=0.628,P=0.310),而其余各时间点内CO干燥组兔心左室收缩压均明显高于HTK浸泡组(P < 0.05,图 3C)。两组兔心左室舒张压随保存时间的延长呈上升趋势,而HTK浸泡组兔心舒张压上升趋势略高于CO干燥组兔心。其中在2 h及24 h时间点,两组兔心舒张压无明显差异(P=0.093,P=0.499),而其余各时间点上HTK浸泡组舒张压均高于CO干燥组(P < 0.05,图 3D)。
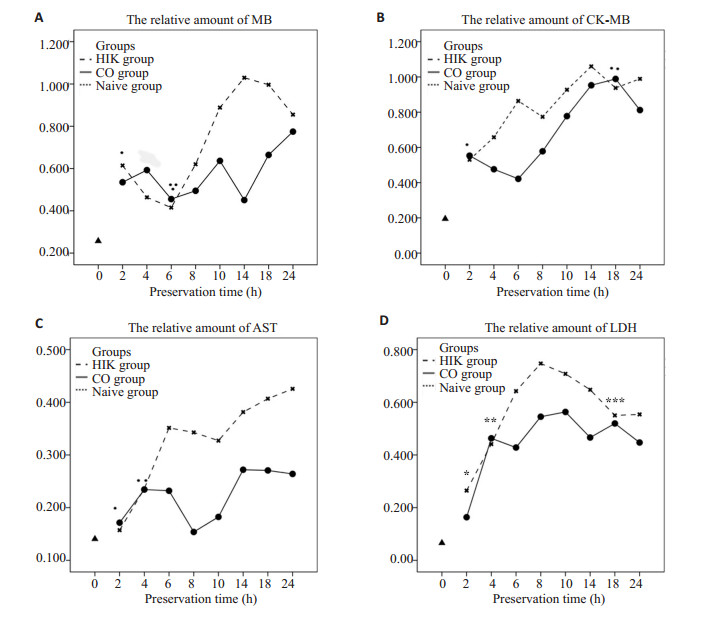
|
图 3 保存后心功酶改变情况 Figure 3 Comparison of myocardial enzymes at various time points among groups. A: CK level, *P=0.850 and **P=0.796 CO vs HTK at 2 and 6 h, respectively. P < 0.05 at the remaining time points between the two groups.B: CK-MB level, *P=0.468 and **P=0.322 CO vs HTK at 2 and 18 h, respectively. P < 0.05 at the remaining time points between two groups. C: AST level, *P=0.273 and **P=0.351 CO vs HTK at 2 and 4 h, respectively. P < 0.05 at the remaining time points between two groups. D: LDH level, *P=0.065, **P=0.977 and ***P=0.329 CO vs HTK at 2, 4 and 18 h, respectively. P < 0.05 at the remaining time points between two groups. |
肌酸激酶(CK)检测结果:Naïve组CK蛋白表达较低,而经过两组不同保存方式保存2 h后CK蛋白表达明显升高,但两组间差异无统计学意义(P=0.850>0.05),随后两组MB表达逐渐降低,至6h点,两组均降至最低值,且无明显差异(P=0.796>0.05)。之后,两组CK表达随保存时间的延长逐渐升高,且HTK浸泡组表达明显高于CO干燥组(8~24 h各点均有P < 0.05,图 4A)。

|
图 4 保存24 h后两组心肌超微结构改变 Figure 4 Ultrastructural changes in the myocardium in the two groups after a 24-hour preservation (Original magnification: × 20 000). A: Heart tissue preserved in HTK showing disruption of the myofibrils (white arrowhead) and mitochondrial swelling (black arrowhead); B: Heart tissue preserved in CO showing intact myofibrils (white arrowhead) and nearly normal mitochondria (black arrowhead). |
肌酸激酶同工酶(CK-MB)检测结果:空白对照组CK-MB蛋白表达较低,而经过两组不同保存方式保存2 h后CK-MB蛋白表达均明显升高,但两组间差异无统计学意义(P=0.468>0.05),随保存时间的延长,两组CK-MB表达均逐渐升高,且HTK组CK-MB蛋白表达升高更明显(4~14 h各点均有P < 0.05),至18 h左右,两组CK-MB蛋白表达到达最高值,且两组差异无统计学意义(P=0.322>0.05,图 4B)。
天门冬氨酸氨基转移酶(AST)检测结果:空白对照组AST蛋白表达稍低,而经过两组不同保存方式保存2 h后CK-MB蛋白表达略升高,而2组间差异无统计学意义(P=0.273>0.05),随保存时间的延长,2组AST表达均逐渐升高。自6 h开始,HTK组CK-MB蛋白表达升高更明显(6~24 h各点均有P < 0.05,图 4C)。
乳酸脱氢酶(LDH)检测结果:空白对照组LDH蛋白表达较低,而经过2组不同保存方式保存2 h后LDH蛋白表达均明显升高,且均随保存时间的延长逐渐升高。但在2、4 h时间点上2组差异无统计学意义(P=0.065,P=0.977>0.05),自6 h开始,HTK组LDH蛋白表达升高幅度明显高于CO组[6~24 h各点均有P < 0.05,除18 h外(P=0.329>0.05)](图 4D)。
2.5 心肌组织超微结构观察结果保存24 h后,2组心肌细胞超微结构均有改变。其中HTK保存组心肌细胞(图 5A)肌束溶解明显,肌原纤维排列紊乱、挛缩,Z线增宽。线粒体明显变形,部分线粒体溶解,内外膜难以区分,嵴部模糊不清;而CO干燥组心肌细胞肌束基本完整,肌原纤维清晰规整,Z、M线清楚(图 5B)。部分线粒体受损、变形,密度降低,有少量空泡形成,但内外膜基本完整,嵴尚存,排列较整齐。
3 讨论目前,心脏移植仍是治疗终末期心脏病最有效的方式。但是,受供心保护较差的影响,绝大多数终末期心脏病患者难以获得及时有效的治疗。离体心脏的主要保存方法有低温浸泡保存法、低温高压氧保存法、间断灌注保存法、持续灌注保存法及深低温保存法[15]。目前临床上普遍采用的单纯低温浸泡保存法,即将供心置于4 ℃保存液中浸泡保存。而此种保存方法有效保存时间为4~6 h[16],往往难以满足患者需要。
本实验中,我们运用全新的CO高压干燥环境进行离体心脏的保存,其检测和观察指标中:心律评分能客观反映心肌电生理的变化特性,LVSP、LVDP可反映心肌的收缩功能及其顺应性,而心功酶(CK,CK-MB,LDH,AST)和心肌超微结构能反映心肌细胞结构和功能的改变。本实验研究结果显示,各研究指标呈现相对一致的结论,即CO干燥组与HTK浸泡组在短期保存(2~4 h)效果无明显差别,而在中长期(6~24 h)保存效果上,CO干燥组在各项指标上均明显优于HTK浸泡组。
自由水作为细胞重要组成部分,是细胞进行正常生理活动必要的媒介。在细胞缺血缺氧状态下,细胞酸中毒导致细胞膜通透性改变,胞外自由水进入胞内,造成细胞水肿、破裂。而在高压干燥环境下,细胞内自由水析出,而细胞膜上结合水仍能得到保留,以此起到稳定细胞膜,防止细胞水肿、破裂的作用[17]。同时,细胞内自由水的减少,心肌细胞代谢活动因缺乏媒介而减慢,有氧及无氧呼吸减弱,减少ATP消耗,减少了细胞内氧自由基,同时也减轻细胞酸中毒。从本实验结果来看,CO干燥组在中长期保存后心功酶各项指标均优于同期HTK浸泡组,而且在保存24 h后心肌超微结构中,其心肌细胞肌束与线粒体的损伤较HTK浸泡组轻。
CO作为一种新的多功能信号分子,已受到广泛关注。它主要通过与血红素氧化酶-1(HO-1)结合而对心血管系统、神经系统、免疫系统的病理生理过程中起到重要的调节作用[18]。同时,CO可以通过对Bcl-2 mRNA和Bax mRNA表达的调节而发挥抗凋亡作用[19]。另外,CO能明显下调促炎因子TNF-a的表达来实验其抗炎作用[20]。内源性CO主要来源于血红素氧化酶(HO)对亚铁血红素的降解产生,具有维持细胞内环境稳定,抗血管平滑肌细胞增殖及抑制心脏排斥反应的生物学特性[21-22]。研究发现,外源性低浓度的CO(COHB浓度小于20%)在各种应激环境下可以弥补内源性CO的短缺,发挥抗炎、抗凋亡、抑制平滑肌细胞增生和改善缺血性肺损伤的生物学特性[23-24],这提示CO可以替代HO-1的功能而发挥器官和细胞的保护作用。本实验中正是利用外源性CO抗凋亡等特性,减轻离体兔心在保存过程中的损伤。而实验结果亦证实,在经过CO保存后的供体心肌舒缩功能明显高于HTK浸泡组,而且长时间保存后心肌细胞内结构损伤明显较轻。此外,实验中应用非吸入方式的外源性CO来保存供体器官,一方面不需担心供体因吸入CO引起的COHb过高而产生毒副作用;另一方面将离体器官暴露于CO保存液中,能使CO在不受血红蛋白的影响下与关键蛋白结合,充分发挥CO抗凋亡、保护心肌细胞,延长供体心脏保存时间的功能。
本实验表明,CO高压干燥保存确实具心肌保护作用,且中长期保存效果要明显优于目前传统的HTK低温浸泡保存方法。但是,CO高压干燥保存的潜在作用机制尚有待进一步研究,另外其保存过程相对复杂,存在一定危险。
| [1] | Michel SG, La Muraglia IG, Madariaga ML, et al. Preservation of donor hearts using hypothermic oxygenated perfusion[J]. Ann Transplant,2014, 19 : 409-16. DOI: 10.12659/AOT.890797. |
| [2] | Turk TR, Su S, Rauen U, et al. Reduction of chronic graft injury with a new HTK-based preservation solution in a murine heart transplantation model[J]. Cryobiology,2012, 64 (3) : 273-8. DOI: 10.1016/j.cryobiol.2012.02.011. |
| [3] | 黑飞龙.心脏移植供心保护方案及心脏保存液改良研究[D].北京协和医学院中国医学科学院北京协和医学院清华大学医学部中国医学科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10023-1013311962.htm |
| [4] | Southard JH, Belzer FO. Organ preservation[J]. Annu Rev Med,1995, 46 : 235-47. DOI: 10.1146/annurev.med.46.1.235. |
| [5] | Martin-Suarez S, Mikus E, Pilato E, et al. Cardiac transplantation from a Carbon monoxide intoxicated donor[J]. Transplant Proc,2008, 40 (5) : 1563-5. DOI: 10.1016/j.transproceed.2008.03.155. |
| [6] | Rizzo AM, Negroni M, Altiero TA, et al. Antioxidant defences in hydrated and desiccated states of the tardigrade Paramacrobiotus richtersi[J]. Comp Biochem Physiol B Biochem Mol Biol,2010, 156 (2) : 115-21. DOI: 10.1016/j.cbpb.2010.02.009. |
| [7] | Nakahara Y, Imanishi S, Mitsumasu K, et al. Cells from an anhydrobiotic chironomid survive almost complete desiccation[J]. Cryobiology,2010, 60 (2) : 138-46. DOI: 10.1016/j.cryobiol.2009.10.004. |
| [8] | Suszynski TM, Rizzari MD, Scott IW, et al. Persufflation (gaseous Oxygen perfusion) as a method of heart preservation[J]. J Cardiothorac Surg,2013, 8 : 105. DOI: 10.1186/1749-8090-8-105. |
| [9] | Hatayama N, Naito M, Hirai S, et al. Preservation by desiccation of isolated rat hearts for 48 hours using Carbon monoxide (PCO=4 000 hPa) and Oxygen (PO (2)=3 000 hPa)[J]. Cell Transplant,2012, 21 (2/ 3) : 609-15. |
| [10] | Hatayama N, Yoshida Y, Seki K. A study on the perfusion preservation, resuscitation, and transplantation of a rat heart isolated for 96 hours[J]. Cell Transplant,2009, 18 (5/6) : 529-34. |
| [11] | Yoshida Y, Hatayama N, Seki K. Study on the preservation with CO (PCO=200-2 000 hPa), resuscitation, and heterotopic transplantation of an isolated rat heart[J]. Cell Transplant,2009, 18 (5) : 535-40. |
| [12] | Walker MJ, Curtis MJ, Hearse DJ, et al. The lambeth conventions: guidelines for the study of arrhythmias in ischaemia infarction, and reperfusion[J]. Cardiovasc Res,1988, 22 (7) : 447-55. DOI: 10.1093/cvr/22.7.447. |
| [13] | Curtis MJ, Walker MJ. Quantification of arrhythmias using scoring systems: an examination of seven scores in an in vivo model of regional myocardial ischaemia[J]. Cardiovasc Res,1988, 22 (9) : 656-65. DOI: 10.1093/cvr/22.9.656. |
| [14] | Ravingerova T, Tribulova N, Slezak J, et al. Brief, intermediate and prolonged ischemia in the isolated crystalloid perfused rat heart: relationship between susceptibility to arrhythmias and degree of ultrastructural injury[J]. J Mol Cell Cardiol,1995, 27 (9) : 1937-51. DOI: 10.1016/0022-2828(95)90016-0. |
| [15] | 肖泽周, 张钟, 朱平, 等. 心脏移植术后的长期免疫抑制治疗[J]. 广东医学,2013, 34 (19) : 3030-2. |
| [16] | Jahania MS, Sanchez JA, Narayan P, et al. Heart preservation for transplantation: principles and strategies[J]. Ann Thorac Surg,1999, 68 (5) : 1983-7. DOI: 10.1016/S0003-4975(99)01028-0. |
| [17] | Gaubin-Blanquet Y, Pianezzi B, Massue J P. [Influence of various physical factors on the developmental capacities of the ovum of Artemia salina[J]. C R Seances Soc Biol Fil,1976, 170 (6) : 1305-10. |
| [18] | Kaizu T, Nakao A, Tsung A, et al. Carbon monoxide inhalation ameliorates cold ischemia/reperfusion injury after rat liver transplantation[J]. Surgery,2005, 138 (2) : 229-35. DOI: 10.1016/j.surg.2005.06.015. |
| [19] | Mishra S, Fujita T, Lama VN, et al. Carbon monoxide rescues ischemic lungs by interrupting MAPK-driven expression of early growth response 1 gene and its downstream target genes[J]. Proc Natl Acad Sci USA,2006, 103 (13) : 5191-6. DOI: 10.1073/pnas.0600241103. |
| [20] | Lopez-Neblina F, Toledo AH, Toledo-Pereyra LH. Molecular biology of apoptosis in ischemia and reperfusion[J]. J Invest Surg,2005, 18 (6) : 335-50. DOI: 10.1080/08941930500328862. |
| [21] | Sammut IA, Foresti R, Clark JE, et al. Carbon monoxide is a major contributor to the regulation of vascular tone in aortas expressing high levels of haeme oxygenase-1[J]. Br J Pharmacol,1998, 125 (7) : 1437-44. DOI: 10.1038/sj.bjp.0702212. |
| [22] | Wang R, Wang ZZ, Wu LY. Carbon monoxide-induced vasorelaxation and the underlying mechanisms[J]. Br J Pharmacol,1997, 121 (5) : 927-34. DOI: 10.1038/sj.bjp.0701222. |
| [23] | Akamatsu Y, Haga M, Tyagi S, et al. Heme oxygenase-1-derived Carbon monoxide protects hearts from transplant-associated ischemia reperfusion injury[J]. FASEB J,2004, 18 (2) : 771. |
 2015, Vol. 35
2015, Vol. 35
