2. 暨南大学附属第一医院广东省水电医院,广东 广州 511300 ;
3. 南方医科大学南方医院,广东 广州 510515
2. First Affiliated Hospital of Jinan University Guangdong Hydropower Hospital, Guangzhou 511300, China ;
3. Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
紫杉醇具有广谱抗肿瘤活性,目前临床应用的主要是以聚氧乙烯蓖麻油和乙醇(1:1,w/w)作为溶剂的紫杉醇注射剂[1-2],而聚氧乙烯蓖麻油(cremophor EL)容易引起聚氯乙烯(PVC)输液袋和管材等的泄露[3]以及急性过敏反应[4],使紫杉醇的临床应用受到限制。因此,紫杉醇口服制剂,成为近年来研究的热点。由于紫杉醇在水中的溶解性差以及P-gp对它的外排作用[5],因此,采用口服可增加紫杉醇吸收的P-糖蛋白(P-gp)抑制剂,仍是研究的热点之一[6]。目前,经典的P-gp抑制剂,例如维拉帕米、奎尼丁、环孢菌素A等,都具有非常显著的药理学活性和严重的毒副作用,并且给药剂量较大才能发挥P-gp抑制作用,因此应用受到限制。
紫杉醇合用20(s)-人参皂苷和水飞蓟素,可以提高其口服生物利用度[7-8]。我们在甘草与反药配伍对P-糖蛋白影响的相关研究中发现,京大戟对P-gp和癌细胞DNA合成有抑制作用[9-10]。因此,本研究观察合用京大戟提取物对紫杉醇经不同肠段透过性的差异和对口服生物利用度的影响,期望为开发京大戟作为P-gp的抑制剂和提高紫杉醇的口服吸收获得更多的实验证据。
1 材料和方法 1.1 试剂紫杉醇对照品(中国药品生物制品检定所,100382-200301);多烯紫杉醇对照品(Sigma-Aldrich,1425738V);乙腈为一级色谱纯(德国Merck公司,批号304013);甲醇为一级色谱纯(德国Merck公司,批号304013);水为超纯水,甲醇和超纯水超声脱气,封好备用;其他化学试剂均为分析纯。
京大戟购自广东广弘药材有限公司,经南方医科大学中西医结合学院张宏伟副教授鉴定为京大戟(Euphorbia pekinensis Rupr.)。
1.2 实验方法 1.2.1 紫杉醇体外透过液的HPLC检测方法检测器为紫外检测器(SPD-20A),色谱柱AgilentC18(250 mm×4.6 mm,5 μm),进样量为20 μL。流动相:甲醇-水(65:35),流速:0.8 mL/min,分析时间:10 min,检测波长:227 nm。
1.3 对照品和供试液的配制 1.3.1 紫杉醇对照品溶液的配制精密称取紫杉醇对照品10 mg,用甲醇溶解定容至100 mL,得到100 μg/mL的紫杉醇对照品储备液。用Hepe-Tris依次稀释储备液,得到浓度分别为1000、750、500、250、100、10 ng/mL的对照品溶液系列。
1.3.2 Hepes-Tris缓冲液的配制(现配现用)按文献[11]的方法配置。
1.3.3 紫杉醇供试液的配制精密称取紫杉醇50 mg,用乙醇溶解稀释至10 mL,得到5 mg/mL储备液,精密量取1mL储备液,用Hepes-Tris缓冲液稀释至500 ng/mL,即得供试液。
1.4 紫杉醇的HPLC方法学 1.4.1 线性考察分别取“1.3.1”项下的系列对照品溶液各20 μL进样分析,测得紫杉醇的线性范围是10~1000 ng/mL,标准曲线回归方程为Y=aX+b,a=52.696,b=31.609,R2=0.9996。典型的HPLC图谱如图 1所示,Hepes-Tris缓冲液对紫杉醇的测定没有干扰。
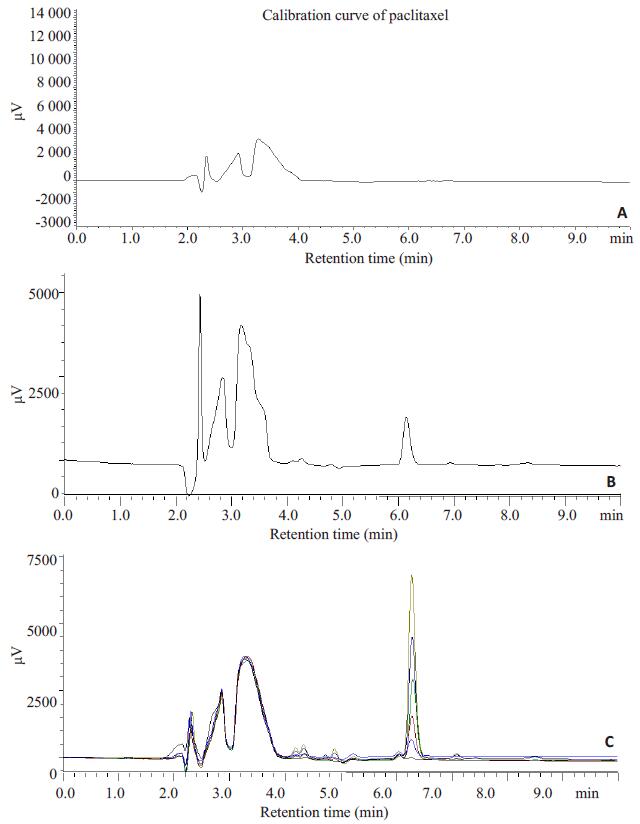
|
图 1 紫杉醇典型色谱图 Figure 1 HPLC graphs of paclitaxel in different conditions. A: Blank; B: Sample; C: Standard. |
取“1.3.1”项下浓度分别为1000,500,10 ng/mL的紫杉醇对照品溶液,各进样5次,进样量20 μL,按方法中的色谱条件测定,统计峰面积,计算相对标准偏差RSD=1.5%;高,中,低3个浓度日内、日间RSD均小于3%(n=5),精密度良好。
1.4.3 重现性实验取紫杉醇供试液5份,按方法中的色谱条件测定,统计峰面积,计算RSD=1.33%(n=5)。
1.4.4 回收率实验取紫杉醇供试液6份,以其含量的50%,100%,150%,分别精密加入紫杉醇对照品溶液1 mL,每个含量2份,再分别精密加入Hepes-Tris缓冲液,按含量测定方法测定,计算紫杉醇的回收率,结果平均回收率为102.45%,RSD=1.73%。
1.5 体外Ussing chamber方法 1.5.1 药液配制Hepes-Tris缓冲液的配制(现配现用):见“1.3.2”。紫杉醇供试液的配制:见“1.3.3”。
中药供试品制备:京大戟称质量后加入15倍量的纯化水,浸泡90 min后煎煮,以煮沸后60 min作为提取时间,煮好药液冷却后用布氏漏斗过滤,虑液用蒸发皿浓缩至每1 mL药液含1 g原生药,即得京大戟提取物。
1.5.2 动物模型制备SD雄性大鼠,随机分成生理盐水空白对照组、维拉帕米阳性对照组(15 mg/kg)和京大戟提取物组(1 g/mL,20 mL/kg)进行灌胃给药造模,2次/d,连续7 d。灌胃给药观察各组大鼠一般情况,记录大鼠每天体质量变化。造模结束后,根据实验要求,各模型组均按下表进行随机分组,实验样本量如下表 1所示。
| 表 1 每模型组实验样本量 Table 1 The sample size in each group |
SD大鼠禁食16~18 h,3%戊巴比妥钠(ip,32mg/kg)麻醉,延腹中线将腹部切开2.5 cm左右,将小肠顶部的5 cm去除,接着的10 cm小肠作为空肠,最后的10 cm作为回肠。大肠的最初2 cm去除,接着的6 cm作为结肠。分别用生理盐水轻缓冲洗干净,置入冰浴的Hepes-Tris缓冲液中通混合气体(95% O2:5% CO2)培养。剪取空肠3~4 cm,于冰浴板上迅速剥离浆膜侧的浆膜层,将肠黏膜固定于扩散池上,回肠及结肠的操作方法与空肠相同,扩散室的有效面积为1.78 cm2。将紫杉醇供试液和Hepes-Tris缓冲液预热至37.5 ℃,通入混合气体(95% O2:5% CO2),37.5 ℃恒温,吸收方向试验时(M-S),在黏膜侧加入紫杉醇供试液7 mL(50 μg/mL),浆膜侧加入7 mL Hepes-Tris缓冲液;分泌方向试验时(S-M),浆膜侧加入7 mL紫杉醇供试液,黏膜侧加入7 mL Hepes-Tris缓冲液。分别于15、30、45、60、75、90和120 min在紫杉醇供试液接受侧取样0.5 mL,同时补充等体积同温度的Hepes-Tris缓冲液。
1.5.4 结果的处理将“1.5.3”项下每个样品HPLC检测得到的紫杉醇含量,用下列公式计算透过结果:
(1)累计透过量(Qtn):
其中0.5和7表示取样体积和加入药液量,分别为0.5 mL和7 mL;Ctn表示给定时间点接收室药物浓度;
(2)累计透过率:Qtn/D×100%,其中D为给药剂量;
(3)表观渗透系数(Papp):Papp=(dQ/dt)×(1/AC0),其中dQ/dt表示稳态时时间-累计透过量线性回归所得的斜率,A为有效渗透面积1.78 cm2,C0为加入药液侧初始药物浓度。
1.5.5 统计学分析实验结果采用SPSS 19.0软件进行统计。计量资料统计结果用均数±标准差表示。对不同区段的M-S和S-M方向Papp分别进行析因设计的方差分析,对不同区段的M-S和S-M方向的累计透过量用重复测量方差分析。方差分析具有显著性差异时,方差齐时采用SNK法,不齐时用Dunnet T3法进行不同区段间的多重比较检测检验。以P < 0.05认为差异有统计学意义。
1.6 紫杉醇血药浓度的LC-MS/MS的检测方法 1.6.1 色谱条件色谱柱为Agilent SB-C18(3.5 μm,2.1 mm×150 mm);流动相为甲醇-0.1%甲酸水(95:5,v: v);流速为0.3 mL/min;柱温:30 ℃。
1.6.2 质谱条件采用安捷伦MassHunter Optimizer软件,自动优化得到MRM模式下,离子源为电喷雾离子源(ESI源);Vcap毛细管电压4000 V;干燥气温度350 ℃;雾化气压力30 psi;干燥气流速10 L/min。
1.6.3 质谱分析在Q1全扫描模式下,紫杉醇和多烯紫杉醇(内标)的碰撞能量(CE)都为22 eV;裂解电压分别为250 eV和210 eV。紫杉醇母核质荷比为(m/z)876.3,最大离子碎片m/z=308。多烯紫杉醇母核质荷比为(m/z)830.3,最大离子碎片m/z=549.1,扫描时间1.5 min。
1.7 血浆标准品的制备精密量取大鼠空白血浆100 μL,分别精密加入1.1、2.2、55、220、550、1100 ng/mL的紫杉醇对照品溶液(制备方法同“1.3.1”)各100 μL,并加入相同体积的100 ng/mL的多烯紫杉醇内标溶液,保存于4 ℃环境中。使用前室温放置复温,加入2 mL乙酸乙酯-二氯甲烷-乙腈(4:1:1),涡旋2 min后15 000 r/min离心20 min,取上清液2 mL用氮气挥干,残渣加入0.1 mL流动相复溶,0.45 μm微孔滤膜过滤后,用高效液相质谱检测。
1.8 紫杉醇LC-MS/MS方法学考察[12] 1.8.1 标准曲线的制备和线性范围以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,求得紫杉醇的直线回归方程为y=0.0059x+0.0181,r2=0.9975(n=6),根据标准曲线,方法线性范围在0.55~550 ng/mL。此方法的最低定量限为0.55 ng/mL(S/N>10),此浓度适合于口服紫杉醇时,大鼠血浆浓度较低的检测分析。
1.8.2 提取回收率精密量取大鼠空白血浆100 μL,按“1.7”项下的方法分别制备血浆浓度为1.1、110、550 ng/mL的低、中、高3个浓度的紫杉醇QC样品。
紫杉醇在3个质控浓度检测下的提取回收率为79.32%,77.54%及78.64%。而内标的回收率为70.19%。上述结果表明,紫杉醇及内标的回收率前后一致性良好并且没有浓度依赖性。
1.9 精密度和准确度取“1.8.2”项中的3个浓度紫杉醇QC样品各5份,验证方法的精密度和准确度。日内精密度分别为2.68%,3.05%,2.13%,日间精密度分别为:6.54%,4.72%,3.15%,RSD < 15%。准确度范围为2.13%到6.54%。从这些数据可知,此方法学达到了准确度及精密度的标准。
1.9.1 稳定性试验中考察了含有紫杉醇血液样本的室温稳定性,样本的处理液稳定性,以及反复冻融稳定性。结果显示在上述考察条件下,3个浓度无显著变化,RSD < 10%,符合稳定性要求。
1.9.2 介质效应考察根据文献报道[13]的方法,进行介质效应考察。3个浓度的介质效应分别为101.13%、98.79%、98.27%。内标的介质效应按相同方法进行考察,100 ng/mL浓度时为98.56%。
1.10 体内in vivo方法 1.10.1 实验动物的准备同“1.5.2”项。
SD大鼠禁食16~18 h,3%戊巴比妥钠(ip,32 mg/kg)麻醉。口服给药组按体质量灌胃紫杉醇(聚乙烯蓖麻油:无水乙醇=1:1,v/v,1 mg/mL,20 mg/kg)。分别于给药后20、40、60、80、120、180、240、360、480、600、720 min于颈静脉取血置肝素抗凝离心管中,8000 r/min离心5 min后取上清液于冰箱中保存。注射给药组于尾静脉注射紫杉醇(6 mg/kg),分别于注射后1、5、10、15、30、60、90、120、240、360、480、600、720 min于颈静脉取血,血样处理方法同口服给药组。
1.10.2 血液样品的处理取“1.10.1”项中上清液室温放置复温,分别精密量取100 μL于离心管中,各加入100 μL内标溶液,2 mL乙酸乙酯-二氯甲烷-乙腈(4:1:1),涡旋2 min后15 000 r/min离心20 min,取上清液2 mL用氮气挥干,残渣加入0.1 mL流动相复溶,0.45 μm微孔滤膜过滤后,用高效液相质谱检测。
1.10.3 数据处理将所测得数据用Excel软件进行处理,根据标准曲线得到各个时间点的药物浓度,用Winnonlin软件计算最高血浆浓度Cmax、达到最高浓度时间Tmax、曲线下面积AUC0-720min等血药浓度参数。根据下列公式计算绝对生物利用度(AB,%)和相对生物利用度(RB,%)。
(1)AB(%)=(AUCp.o./AUCi.v.)×(Di.v./Dp.o.)×100
其中:AUCp.o.和AUCi.v.为口服给药和注射给药后的曲线下面积AUC,Di.v.和Dp.o.为注射和口服的给药剂量;
(2)RB(%)=AUCt/AUCr×100
其中:AUCt和AUCr分别为京大戟提取物组t和阳性对照组r曲线下面积AUC。
1.10.4 统计分析采用SPSS 19.0统计软件进行统计分析,实验结果用平均值±标准差表示,紫杉醇浓度与峰面积的关系用线性回归(Linear Regression)分析。各组紫杉醇吸收后Cmax、Tmax、AUC0-720min的平均值比较采用单向方差分析(One-Way ANOVA),P < 0.05时认为有统计学差异。
2 结果 2.1 京大戟提取物对紫杉醇经肠道转运的Papp的影响紫杉醇经肠道黏膜透过的累计渗透系数如图 2所示,分别表示大鼠灌胃生理盐水组,维拉帕米组,京大戟提取物组后,紫杉醇经大鼠空肠、回肠、结肠吸收方向转运(从肠粘膜侧到浆膜侧,M-S)和分泌方向转运(从浆膜侧到粘膜侧,S-M)。经空肠肠粘膜透过时,M-S组及S-M组表观渗透系数Papp(×10-6,cm/s)分别与空白组(1.70±0.42和4.82±0.94)相比,均具有显著性差异(P < 0.05);经回肠肠粘膜透过时,分别与空白组(1.99±0.55和5.81±0.19)相比,均具有显著性差异(P < 0.05);经结肠肠粘膜透过时,分别与空白组(1.73±0.35和2.66±0.47)相比,吸收方向(M-S)具有显著性差异(P < 0.05),分泌方向(S-M)不具有显著性差异(P=0.060)。根据析因设计资料的方差分析,不同区段间有显著性差异(F=53.326,P=0.000)。
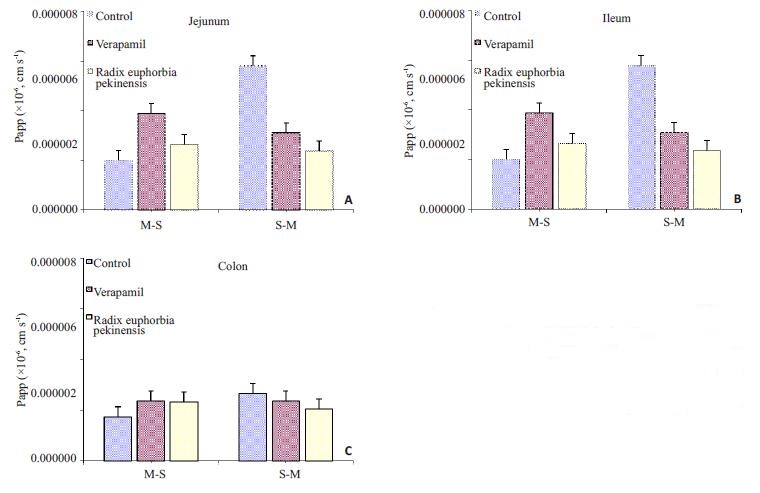
|
图 2 合用京大戟提取物对紫杉醇经肠粘膜转运的Papp的影响 Figure 2 Effect of combination with Radix Euphorbiae Pekinensis extract on the Papp of paclitaxel in the intestinal Membranes (Mean±SD, n=5). A: jejunum; B: ileum; C: colon. Keys: M-S: Absorptive Transport; S-M: Secretory Transport. |
结合多重比较结果,京大戟组与空白对照组和维拉帕米组比,紫杉醇经空肠、回肠段Papp存在显著性差异(P=0.000),而空肠、回肠段组间Papp无显著性差异(P=0.142)。结肠与空肠、回肠段组间存在显著性差异(P=0.000)。
2.2 体内In vivo药动学结果实验结果见表 2和图 3以及图 4。口服给药后,合用京大戟提取物组的绝对生物利用度(AB%)平均为7.63%,是空白组的2.7倍,维拉帕米组的1.8倍。其中相对生物利用度(RB%)平均值最高的是京大戟组,为271.75%。紫杉醇口服剂量相同时,合用京大戟提取物和维拉帕米时,比空白组口服紫杉醇,最大血药浓度(Cmax)和药-时曲线下面积(AUC)均明显增加,是空白组的1至3倍,其中京大戟提取物组的作用最为显著。因此,我们认为通过合用京大戟提取物可以显著提高紫杉醇的口服生物利用度,并且能达到或超过维拉帕米的作用效果,紫杉醇口服制剂和P-gp抑制剂合用,可以把京大戟提取物作为一个选择性的药物。
| 表 2 紫杉醇在不同组在体给药后的药动学参数 Table 2 Pharmacokinetic parameters of paclitaxel after in vivo administration in different groups |
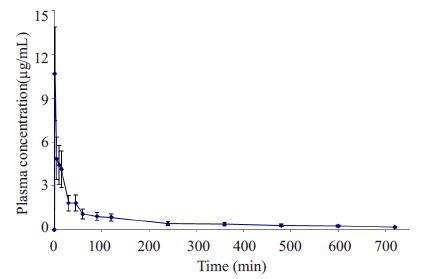
|
图 3 紫杉醇按6 mg/kg静脉注射给药后的药时曲线,每个值均用均数±标准差表示 Figure 3 Mean plasma concentration-time profiles of paclitaxel following Ⅳ intravenous paclitaxel at a dose of 6 mg/kg (Mean±SD). |
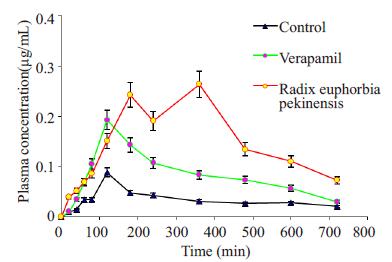
|
图 4 紫杉醇按20 mg/kg口服给药后的药时曲线,每个值均用平均数±标准差表示 Figure 4 Mean plasma concentration-time profiles of paclitaxel following oral administration of paclitaxel at a dose of 20 mg/kg in different groups (Mean±SD). |
存在于肠上皮细胞刷状缘膜中的P-gp能将药物从浆膜侧泵回至粘膜侧而进入肠腔排出,即如文中所述的分泌方向,从而降低药物的吸收,血药浓度降低,这是受P-gp调控的药物生物利用度降低的主要原因之一[14-15]。P-gp在肿瘤细胞中的表达,通过主动排出各种肿瘤化疗药物而产生MDR表型[16-17],最终引起肿瘤细胞耐药性。
到目前为止,国内外探讨肠粘膜P-gp的表达与中药配伍合理性之间的研究较少,文献仅报道了日本学者曾做过小柴胡汤对P-gp表达影响的研究[18],因此探讨中药改变P-gp表达具有一定的学术意义。
由于京大戟自身具有抑制P-gp的作用,并对多种肿瘤有效,希望能够制成耐药性肿瘤抑制剂,并通过合用改善紫杉醇的生物利用度。这为P-gp抑制剂的研究及提高紫杉醇口服生物利用度提供了更多的设想和方向。
应用Ussing Chamber模型获得药物的Papp与人口服吸收分数之间存在良好相关性[19],近年在国外应用较多,特别为肠段的分段定位研究提供有效研究手段。体内的实验方法[20]选用In vivo方法,采用口服给药方式,把动物的伤害降至最低,可以避免实验手术时大鼠生理现象的改变以及大鼠的加速死亡,从而不影响正常的血样采集和数据的全面性。
本实验充分考虑到血样检测方法的灵敏度问题,分别建立HPLC和灵敏度更高的LC-MS/ MS方法,用于检测体外透过液中紫杉醇含量和体内血药浓度。高效液相质谱联用建立血浆中紫杉醇的检测方法,样品分析时间仅需2 min,方法线性范围和最低检测限均适合于体内口服紫杉醇时,血药浓度较低的检测分析。
本文研究结果表明,合用京大戟提取物能明显促进紫杉醇经肠粘膜透过,其作用主要表现在空肠和回肠段,对结肠的影响较小。初步分析,原因可能是京大戟提取物口服后,经过胃及小肠,大部分已经被吸收入血,而分布到结肠部位的药量较少,对P-gp的作用减弱。另外,紫杉醇的吸收透过除了受到P-gp的影响外,还存在着不同部位肠粘膜和肠壁厚度对其产生的影响作用。在In vivo结果中,发现京大戟组的药时曲线出现双峰,并且达峰时间延迟,其原因可能是京大戟提取物和紫杉醇发生了物理化学作用,例如络合作用和形成胶束,从而导致紫杉醇的吸收延迟,并导致双峰的出现。或者是京大戟提取物促使紫杉醇发生肝肠循环,经胆汁或部分经胆汁排入肠道后,在肠道中又重新被吸收,经门静脉返回肝脏,而出现达峰时间延迟和双峰。
体内外评价结果均表明,合用京大戟提取物后能显著增加紫杉醇的口服生物利用度。结果提示,采用中药提取物也能达到西药P-gp抑制剂相同的作用,因此本文为中西药结合的研究发展提供了一些有价值的数据。但是,如何进一步从提取物中分离出抑制P-gp的有效单体成分,仍然值得进一步研究。
致谢: 感谢南方医科大学药剂学博士生导师李国锋教授对本文研究的指导!| [1] | Horwitz SB. Mechanism of action of taxol, Trends Pharmacol[J]. Science,1992, 13 (4) : 134-6. |
| [2] | Singla AK, Garg A, Aggarwal D. Paclitaxel and its formulations[J]. Int J Pharm,2002, 235 (1/2) : 179-92. |
| [3] | Kloover JS, Den Bakker MA, Gelderblom H, et al. Fatal outcome of a hypersensitivity reaction to paclitaxel: a critical review of premedication regimens[J]. Br J Cancer,2004, 90 (2) : 304-5. DOI: 10.1038/sj.bjc.6601303. |
| [4] | Kim SC, Yoon HJ, Lee JW, et al. Investigation of the release behavior of DEHP from infusion sets by paclitaxel-loaded polymeric micelles[J]. Int J Pharm,2005, 293 (1/2) : 303-10. |
| [5] | Zhang W, Dutschman GE, Li X, et al. Quantitation of paclitaxel and its two major metabolites using a liquid chromatographyelectrospray ionization tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2011, 879 (22) : 2018-22. DOI: 10.1016/j.jchromb.2011.05.024. |
| [6] | Zabaleta V, Ponchel G, Salman H, et al. Oral administration of paclitaxel with pegylated poly (anhydride) nanoparticles: permeability and pharmacokinetic study[J]. Eur J Pharm Biopharm,2012, 81 (3) : 514-23. DOI: 10.1016/j.ejpb.2012.04.001. |
| [7] | Yang LQ, Wang B, Gan H, et al. Enhanced oral bioavailability and anti-tumour effect of paclitaxel by 20(s)-ginsenoside Rg3 in vivo[J]. Biopharm Drug Dispos,2012, 33 (8) : 425-36. DOI: 10.1002/bdd.v33.8. |
| [8] | Park JH, Park JH, Hur HJ, et al. Effects of silymarin and formulation on the oral bioavailability of paclitaxel in rats[J]. Eur J Pharm Sci,2012, 45 (3) : 296-301. DOI: 10.1016/j.ejps.2011.11.021. |
| [9] | 孙亚彬.甘草与反药配伍对P-糖蛋白影响的相关研究及配伍禁忌对口服药物肠道吸收机制的探讨[D].广州:南方医科大学, 2012:1-221. |
| [10] | 文成英, 黄爱贞, 陈素美, 等. 大戟注射液对KY821白血病细胞株的体外药物实验及DNA含量的检测[J]. 中医药信息,1999, 6 (4) : 48. |
| [11] | 孙亚彬, 李国锋, 唐中昆, 等. 甘草与甘遂的配伍对大鼠肠黏膜P-gp的影响[J]. 药学学报,2010, 45 (4) : 510-6. |
| [12] | 彭丽, 孔艺, 刘思佳, 等. 液质联用快速检测血浆中紫杉醇含量[J]. 中国医院药学杂志,2013, 33 (20) : 1682-5. |
| [13] | Matuszewski BK, Constanzer ML, Chavez-Eng CM. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem,2003, 75 (13) : 3019-30. DOI: 10.1021/ac020361s. |
| [14] | Zhou SF, Lim LY, Chowbay B. Herbal modulation of P-glycoprotein[J]. Drug Metab Rev,2004, 36 (1) : 57-104. DOI: 10.1081/DMR-120028427. |
| [15] | Shono Y, Nishihara H, Matsuda Y, et al. Modulation of intestinal P-glycoprotein function by cremophor EL and other surfactants by an in vitro diffusion chamber method using the isolated rat intestinal membranes[J]. J Pharm Sci,2004, 93 (4) : 877-85. DOI: 10.1002/jps.20017. |
| [16] | 张伟霞, 周宏灏. P-糖蛋白介导的药代动力学及其药物相互作用[J]. 中国临床药理学杂志,2004, 20 (2) : 139-43. |
| [17] | 贺云霞, 孙进, 程刚. 多药耐药性P-糖蛋白在药物肠道吸收中的作用[J]. 沈阳药科大学学报,2004, 21 (5) : 389-93. |
| [18] | Kamath AV, Yao M, Zhang Y, et al. Effect of fruit juices on the oral bioavailability of fexofenadine in rats[J]. J Pharm Sci,2005, 94 (2) : 233-9. DOI: 10.1002/jps.20231. |
| [19] | Lennernäs H. Animal data: the contributions of the Ussing Chamber and perfusion systems to predicting human oral drug delivery in vivo[J]. Adv Drug Deliv Rev,2007, 59 (11) : 1103-20. DOI: 10.1016/j.addr.2007.06.016. |
| [20] | Garrigue JS, Lambert G, Benita S, et al. Microencapsulation methods and industrial applications[M]. New York: CRC press, 2005 : 469 -70. |
 2015, Vol. 35
2015, Vol. 35
