糖尿病,是一种会诱发多种并发症的慢性疾病,目前全球累计约有1亿7000万患者[1],而这个数值到2030年预计会翻一倍[2]。糖尿病足溃疡(DFU)是糖尿病常见且严重的慢性并发症之一。随着对糖尿病足及皮肤病变的致病机理的深入研究,我们认识到糖尿病患者皮肤难以愈合除了可能与皮肤成纤维细胞的迁移、分化及细胞外基质有关外[1, 3-5],也与神经血管病变、感染、各种生长因子水平下降有关[6]。近年来,研究指出,细胞凋亡在糖尿病皮肤愈合过程中也有着重要作用[7]。研究表明,糖尿病足溃疡的发生发展与晚期糖基化终末产物(AGEs)密切相关。二甲双胍(Metformin)是2型糖尿病治疗的一线用药,目前研究指出二甲双胍可以抑制细胞凋亡的发生[8-9]。然而,糖尿病病理状态下引起皮肤细胞凋亡的原因及影响因素尚未明确,二甲双胍对糖尿病病理状态下细胞凋亡的作用的研究甚少。本研究主要观察了二甲双胍对AGEs诱导下原代皮肤成纤维细胞细胞凋亡的影响。
1 材料和方法 1.1 材料 1.1.1 细胞来源取自正常人的原代皮肤成纤维细胞(HDF)由中山大学附属第三医院皮肤科实验室馈赠,已经过分离培养及鉴定,实验对象为3~10代细胞。
1.1.2 主要试剂耗材Cell Counting Kit-8(CCK-8试剂盒)(碧云天生物);Antibody caspase-3,Antibody bax,Antibody bcl-2(Cell Signaling);Antibody β-actin(中杉金桥生物),抗兔、抗鼠荧光二抗(LI-COR Biosciences),牛血清白蛋白(BSA)、二甲双胍购于Sigma,DMEM培养基购于HyClone,胎牛血清、0.25%胰酶购于Gibco,0.22 μm PVDF膜购于Millipore。
1.1.3 AGEs的制备与鉴定称取0.192 g BSA,溶于40 mL 0.4 mol/L的磷酸盐缓冲液(Ph=7.2);称取3.16g D-葡萄糖,溶于20 mL蒸馏水;配制5000 U/mL青霉素溶液、17.8 mg/mL庆大霉素溶液备用。配制AGEs时,取BSA溶液20 mL,D-葡萄糖溶液6.36 mL,青霉素溶液480 μL,庆大霉素溶液204 μL混合,0.22 μm滤器过滤,置于37 ℃培养箱避光孵育90 d,4 ℃透析24 h以去除未结合的葡萄糖。以相同方法制备未加入D-葡萄糖的的非糖化BSA作为对照。采用荧光分光光度计鉴定,AGEs激发高峰位于360 nm,发射高峰位于430 nm,峰狭5 nm。AGEs平均荧光强度为88.69 U/mg,对照BSA荧光强度为12.04 U/mg。
1.2 方法 1.2.1 细胞培养原代皮肤成纤维细胞用含有15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基,常规置于37 ℃、5% CO2培养箱中培养,1~2 d换培养液,细胞生长至90%融合时传代。
1.2.2 CCK-8法检测细胞凋亡取对数生长期的原代皮肤成纤维细胞,以1×104/孔的密度接种于96孔板中,培养24 h后,刺激组分别加入不同浓度AGEs(100、200、300 μg/mL)及AGEs 300 μg/mL+二甲双胍(Met)1mmol/L,对照组分为BSA300 μg/mL对照组及空白对照组,加入200 μL 15%胎牛血清的DMEM培养基。每组设5个复孔。分别培养24、48、72 h后,每孔加入20 μL的CCK-8液体,放回细胞孵箱,孵育1 h,用酶联免疫检测仪在450 nm波长检测每孔吸光度值。实验重复3次。
1.2.3 Western Blot检测caspase-3、bax、bcl-2表达取对数生长期的原代皮肤成纤维细胞,以1×107/mL的密度接种,等待细胞贴壁后,对照组分为BSA 300 μg/mL对照组及空白对照组,刺激组分别加入不同浓度AGEs(100、200、300 μg/mL)及AGEs 300 μg/mL+二甲双胍1 mmol/L,培养72 h后,收集各组细胞,用裂解液提取总蛋白,用BCA法测量蛋白浓度定量蛋白。取20 μg蛋白,进行10% SDS-聚丙烯酰胺凝胶电泳分离,电泳时间约1~1.5 h,将已分离的蛋白转至聚偏二氟乙烯膜(PVDF膜),封闭缓冲液(TBS:0.02 mol/L tris-HCl,0.5 mol/L NaCl,含0.1% Tween-20,5%脱脂奶粉)室温下封闭1 h,TBS洗膜3~5次后,加入兔抗人抗体caspase-3(1 :1000),bax(1:1000),bcl-2(1:1000),小鼠抗人抗体β-actin(1:1000)4 ℃孵育24~48 h,置于荧光二抗(1: 15 000)室温孵育1 h,使用Odyssey双色红外荧光扫描成像系统获得图片,运用Quantity One图像分析软件测得条带灰度值,将各目的条带与内参条带比值后,比较各组间差异。
1.2.4 统计学分析所有数据均以均数±标准差表示,采用SPSS 13.0软件进行统计分析,多组间采用One-way ANOVA进行统计,两两比较使用LSD检验,P值小于0.05表示差异有统计学意义。
2 结果 2.1 AGEs可诱导HDF凋亡,二甲双胍可以抑制AGEs诱导的凋亡采用CCK-8法,经酶联免疫检测仪在450 nm波长检测细胞凋亡情况(图 1),发现空白对照组与BSA(300 μg/mL)对照组无统计学差异。然而,随着刺激物AGEs的浓度递增,在AGEs300 μg/mL刺激24 h、48 h均可见细胞凋亡增加(0.91±0.02 vs 1±0.03;0.91±0.01 vs 1±0.02,P < 0.05),以72 h最为明显(0.72±0.02 vs 1±0.04,P < 0.05),在AGEs300 μg/mL刺激下,细胞数下降约28%。加入二甲双胍1 mmol/L后,24 h、48 h均可减弱AGEs300 μg/mL对其损伤(0.98±0.03 vs 0.91±0.02;0.98±0.01 vs 0.91±0.01,P < 0.05),细胞凋亡明显减少,以72 h效果更为明显(0.98±0.02 vs 0.72±0.02,P < 0.05)。由此我们推断,AGEs可诱导HDF发生凋亡,且呈浓度梯度性,二甲双胍则可保护HDF,减少细胞凋亡。
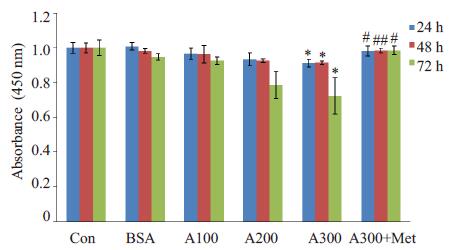
|
图 1 CCK-8法检测二甲双胍影响AGEs诱导HDF凋亡 Figure 1 Effects of metformin on human dermal fibroblast aopotosis induced by advanced glycation end-products (n=5). con: control; BSA: BSA (300 μg/mL); A100: AGEs (100 μg/mL; A200: AGEs (200 μg/mL); A300: AGEs (300 μg/mL); A300 + Met: AGEs (300 μg/mL) + Metformin (1 mmol/L). *P < 0.05 vs con, #P < 0.05 vs A300, ##P < 0.01 vs A300. |
Western blot结果显示(图 2A),空白对照组与BSA(300 μg/mL)对照组Caspase-3、Bax、Bcl-2无明显趋势,差异无统计学意义。加入AGEs100 μg/mL及AGEs 200 μg/mL刺激后,Caspase-3及Bax表达开始出现上升趋势,Bcl-2呈下降趋势,Bcl-2/Bax比例下降。加入AGEs 300 μg/mL刺激,Caspase-3及Bax蛋白表达明显上升(图 2B,2D),Bcl-2明显下降(图 2C),与对照组相比,差异有统计学意义(P < 0.05),Bcl-2/Bax比值明显下降(图 2E),差异有统计学意义(P < 0.01)。在AGEs 300 μg/mL刺激下,同时加入二甲双胍1 mmol/L,可见Caspase-3及Bax蛋白表达量较AGEs 300 μg/mL刺激组明显下降(图 2B,2D),然而Bcl-2蛋白表达量以及Bcl-2/Bax比溃疡创面愈合有重要意义。
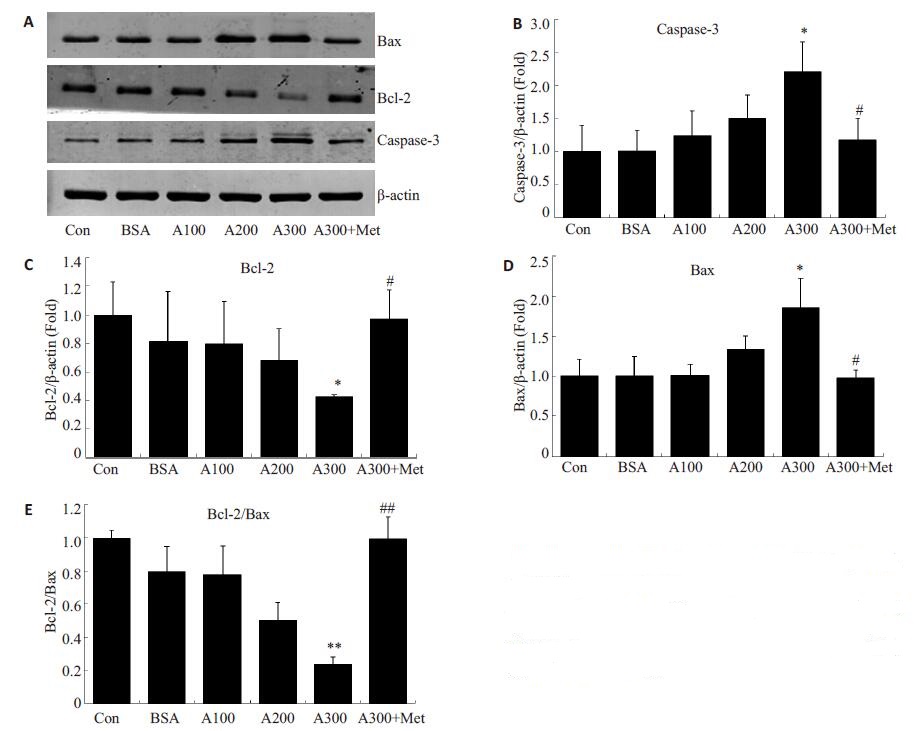
|
图 2 Western blot检测凋亡相关蛋白Caspase-3、Bax及Bcl-2表达 Figure 2 Expressions of caspase-3, Bax and Bcl-2 proteins in the fibroblasts treated for 72 h detected by Western blotting (n=3). *P < 0.05 vs con, **P < 0.01 vs con, #P < 0.05 vs A300, ##P < 0.01 vs A300. |
创面愈合过程中早期不恰当的细胞凋亡增加,使成纤维细胞减少,可能是糖尿病足创面难以愈合的原因之一[7]。动物实验指出,糖尿病大鼠创面愈合速度明显比对照组大鼠慢,糖尿病组创面部位细胞凋亡明显增加,而对照组创面部位细胞凋亡现象则明显较少[11]。然而,以往的研究多集中于活体动物实验,对愈合中有重要作用的各种细胞研究甚少,本实验利用取自于正常人的原例则上升(图 2C,E),差异均具有统计学意义(P < 0.05)。
3 讨论糖尿病足溃疡是糖尿病的常见并发症之一,发病率较高,对患者危害大,是糖尿病致死致残的重要原因之一。在创面愈合过程中,炎症细胞的清除和创面肉芽组织转变为瘢痕组织时各种细胞成分的减少主要是遵循细胞凋亡途径,表明细胞凋亡机制可能在创面愈合过程中发挥作用。糖尿病足创面难愈,既可能与细胞增殖减慢有关,也可能与细胞凋亡增加有关[10]。成纤维细胞在创面愈合过程中起关键作用,是合成分泌胶原及纤维连接蛋白的主要细胞,本实验对成纤维细胞的凋亡作初步探讨,了解糖尿病足溃疡难愈的机制,对促进糖尿病足溃疡创面愈合有重要意义。
创面愈合过程中早期不恰当的细胞凋亡增加,使成纤维细胞减少,可能是糖尿病足创面难以愈合的原因之一[7]。动物实验指出,糖尿病大鼠创面愈合速度明显比对照组大鼠慢,糖尿病组创面部位细胞凋亡明显增加,而对照组创面部位细胞凋亡现象则明显较少[11]。然而,以往的研究多集中于活体动物实验,对愈合中有重要作用的各种细胞研究甚少,本实验利用取自于正常人的原代皮肤成纤维细胞,探讨细胞水平上凋亡的发生及其相关凋亡蛋白的变化,同时,观察二甲双胍对原代皮肤成纤维细胞凋亡的影响,首次说明了二甲双胍可调控成纤维细胞凋亡现象及凋亡相关蛋白的表达,为糖尿病足溃疡的治疗提供了新的诊疗思路。
AGEs是还原糖与蛋白质、游离氨基酸之间经过一系列复杂的非酶促反应形成的产物。AGEs在不同组织中的聚集,在糖尿病慢性并发症的发生发展中起着重要作用。近年研究指出,增加糖尿病小鼠的AGEs摄入,会导致糖尿病小鼠创面愈合减慢[12],另外,阻断了晚期糖基化终末产物受体(RAGEs)能够促进糖尿病小鼠创面愈合[13]。陈莉等人的研究指出,加入AGEs培养48 h的皮肤成纤维细胞细胞突起短且小,同时增值功能受损,而对照组细胞形态正常[14]。牛轶雯等[15]的研究同样指出,在AGEs干预4 d后,成纤维细胞突起段而小,对照组细胞形态正常,胞体可见多个长突起。CCK-8法的实验原理是水溶性四唑盐-WST-8,细胞增殖越快越多,颜色越深,OD值越高,反之,细胞凋亡越多,颜色越浅,OD值越小[16]。本实验使用CCK-8法结果显示,随着AGEs的浓度提高及培养时间延长,成纤维细胞凋亡增加,以300 μg/mL浓度最为明显。在培养72 h后,300 μg/mL AGEs刺激组细胞数较对照组,下降了约28%。本实验证明了AGEs可诱导成纤维细胞的凋亡,与文献报道一致[10]。AGEs可诱导细胞凋亡,且与作用时间及含量相关[17],本实验在同样的刺激时间下,100 μg/mLAGEs刺激作用不明显,而300 μg/mL刺激作用明显,可能与刺激浓度有关。研究已发现成纤维细胞膜上存在多种AGEs结合蛋白,如RAGE、P60、P90等[18],AGEs与其结合后可诱导细胞凋亡[14],AGEs与RAGE结合后,可激活NF-κb,增强氧化应激反应,可引起细胞持久损伤[17],因此,AGEs促进了成纤维细胞凋亡,有可能是通过其表面的AGEs受体来实现的。本实验利用不同时间点及不同浓度的AGEs作为刺激物,进一步说明了血糖控制欠佳、AGEs的局部沉积量大及糖尿病病程长可能是糖尿病足溃疡愈合不良的重要因素。
细胞凋亡受到细胞内凋亡调节蛋白的调控,而凋亡蛋白又分为促凋亡蛋白和抗凋亡蛋白两大类。Bcl-2家族在细胞凋亡中起关键作用[19],研究表明,Bcl-2和Bax蛋白水平的高低与凋亡直接相关:Bax增高,促进细胞凋亡;Bcl-2升高,抑制细胞凋亡。因此,有研究推断,Bcl-2与Bax的比值决定着细胞受凋亡刺激后的生存能力[20]。Caspase家族是细胞凋亡过程中发挥关键作用的一组半胱氨酸蛋白酶,而其中的Caspase-3在凋亡级联反应中是最为关键的凋亡蛋白酶。本实验通过Western blot检测显示,随着AGEs刺激浓度增加,Caspase-3、Bax蛋白表达也呈递增趋势,而Bcl-2蛋白表达下降,Bcl-2/Bax比值下降,提示成纤维细胞凋亡增加。Bcl-2通过阻碍细胞色素C的释放,从而阻断了caspase蛋白酶的激活,抑制了细胞凋亡。Bax作为Bcl-2家族重要的促凋亡蛋白,可作为线粒体膜上离子通道的重要组成部分,使细胞色素C可以进入线粒体,激活Caspase-9,从而进一步激活Caspase-3,促进细胞凋亡。Caspase-3激活后,可降解DNA损伤修复酶,同时激活核酸内切酶,促进细胞凋亡[21]。本实验证实了AGEs在低浓度刺激时(100 μg/mL),细胞表达的Caspase-3、Bax及Bcl-2蛋白并无明显变化,在高浓度刺激时(300 μg/mL),Caspase-3、Bax蛋白表达明显升高,Bcl-2蛋白表达降低,与CCK-8检测所得结论一致。此结果说明了AGEs诱导成纤维细胞凋亡可能与Caspase-3、Bax蛋白高表达、Bcl-2蛋白低表达有关。
二甲双胍是传统的一线口服降糖药,二甲双胍不仅可以调节血糖,而且对心血管有一定的保护作用[22],同时还能降低糖尿病引起的临床不良事件[23-24]。研究证实二甲双胍在各种组织中发挥抗氧化特性,减少糖尿病及其并发症发展中AGEs的形成。此外,二甲双胍可明显抑制AGEs诱导的成骨细胞的氧化应激反应及细胞凋亡[9]。在原代心肌细胞的凋亡实验中,二甲双胍可明显抑制Caspase-3的表达[8]。在300 μg/mLAGEs刺激下,加入1 mmol/L二甲双胍,发现Caspase-3、Bax蛋白表达水平明显下降,而Bcl-2及Bcl-2/Bax比值则明显上升。二甲双胍可以减少AGEs引起的原代皮肤成纤维细胞凋亡,可能与调控Caspase-3、Bax及Bcl-2有关,通过调节促凋亡蛋白及抗凋亡蛋白,调控Bcl-2/Bax比值,抑制了AGEs诱导的细胞凋亡。研究指出,二甲双胍可通过激活AMPK通路,抑制NF-κb的激活[25],抑制前列腺素的生成及活性氧族的生成减轻多种因素有诱导细胞损伤[26-27]。Russell等[28]研究指出,AMPK被抑制的转基因小鼠,在心肌缺血再灌注损伤后,与野生对照组小鼠相比,caspase-3表达增加,心肌细胞凋亡增加。有研究发现AICAR激活AMPK可抑制caspase-3的活性,减少高糖诱导的细胞凋亡[29]。另有研究指出,AICAR激活AMPK可抑制脂肪酸诱导的星形胶质细胞凋亡[30]。Hickson-Bick等[31]人研究在软脂酸介导的心肌凋亡过程中,AMPK的活化有效抑制了凋亡的增加。此外,二甲双胍可通过激活AMPK抑制RAGE,减少ROS生成,减弱AGEs诱导的肾小管细胞损伤[32]。二甲双胍还可以抑制多种因素诱导的细胞损伤及凋亡[33-34]。通过本实验,推测二甲双胍有可能是通过激活AMPK,抑制NF-κb的激活及活性氧族的生成,减少了凋亡基因的表达,从而减少了成纤维细胞的凋亡,但具体机制仍需进一步实验证实。二甲双胍对皮肤成纤维细胞有一定保护作用,糖尿病足溃疡患者服用二甲双胍,不仅仅起控制血糖、保护心血管功能,而且可能对糖尿病足溃疡的治疗起关键作用。
综上所述,AGEs可以诱导原代皮肤成纤维细胞凋亡,而二甲双胍可以起到抗凋亡作用,其机制可能通过通过激活AMPK,抑制NF-κb的激活及活性氧族的生成,上调Bcl-2,下调Caspase-3、Bax表达,升高Bcl-2/ Bax比值有关。长期的高血糖状态,促使皮肤局部非酶糖基化增加,引起了AGEs的堆积,导致皮肤细胞结构及功能的异常,是糖尿病创面难以愈合的重要原因之一,也是糖尿病足溃疡迁延不愈的重要因素。临床工作中,除了控制血糖平稳,还应消除或者阻断AGEs作用。探讨病理状态下皮肤成纤维细胞的凋亡情况,有助于进一步了解糖尿病创面愈合不良的病理机制,为临床治疗糖尿病足溃疡及糖尿病创面提供新的治疗思路与治疗方法。
| [1] | Brem H, Tomic-Canic M. Cellular and molecular basis of wound healing in diabetes[J]. J Clin Invest,2007, 117 (5) : 1219-22. DOI: 10.1172/JCI32169. |
| [2] | Rathmann W, Giani G. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27 (10): 2568-9; author reply 2569. |
| [3] | Maione AG, Brudno Y, Stojadinovic O, et al. Three-dimensional human tissue models that incorporate diabetic foot ulcer-derived fibroblasts mimic in vivo features of chronic wounds[J]. Tissue Eng Part C Methods,2015, 21 (5) : 499-508. DOI: 10.1089/ten.tec.2014.0414. |
| [4] | Walter MN, Wright KT, Fuller HR, et al. Mesenchymal stem cell-conditioned medium accelerates skin wound healing: an in vitro study of fibroblast and keratinocyte scratch assays[J]. Exp Cell Res,2010, 316 (7) : 1271-81. DOI: 10.1016/j.yexcr.2010.02.026. |
| [5] | Kim WS, Park BS, Sung JH, et al. Wound healing effect of adipose-derived stem cells: a critical role of secretory factors on human dermal fibroblasts[J]. J Dermatol Sci,2007, 48 (1) : 15-24. DOI: 10.1016/j.jdermsci.2007.05.018. |
| [6] | Frykberg RG. A summary of guidelines for managing the diabetic foot[J]. Adv SkinWound Care,2005, 18 (4) : 209-14. DOI: 10.1097/00129334-200505000-00010. |
| [7] | Bhan S, Mitra R, Arya AK, et al. A study on evaluation of apoptosis and expression of bcl-2-related marker in wound healing of streptozotocin-induced diabetic rats[J]. ISRN Dermatol,2013, 9 : 739054. |
| [8] | 王小芳, 张金盈, 赵晓燕, 等. 二甲双胍对原代心肌细胞凋亡的影响[J]. 临床心血管病杂志,2013 (4) : 306-8. |
| [9] | 甄东户, 刘丽娟, 成建国, 等. 二甲双胍对糖基化终末产物诱导的成骨细胞氧化应激和凋亡的影响[J]. 中国临床药理学与治疗学,2013, 18 (7) : 743-8. |
| [10] | 劳国娟, 任萌, 黄燕瑞, 等. 糖尿病足伤口皮肤细胞凋亡情况及AGEs对人皮肤成纤维细胞凋亡的影响[J]. 中国病理生理杂志,2014 (8) : 1351-6. |
| [11] | Darby IA, Bisucci T, Hewitson TD, et al. Apoptosis is increased in a model of diabetes-impaired wound healing in genetically diabetic mice[J]. Int J Biochem Cell Biol,1997, 29 (1) : 191-200. DOI: 10.1016/S1357-2725(96)00131-8. |
| [12] | Peppa M, Brem H, Ehrlich P, et al. Adverse effects of dietary glycotoxins on wound healing in genetically diabetic mice[J]. Diabetes,2003, 52 (11) : 2805-13. DOI: 10.2337/diabetes.52.11.2805. |
| [13] | Goova MT, Li J, Kislinger T, et al. Blockade of receptor for advanced glycation end-products restores effective wound healing in diabetic mice[J]. Am J Pathol,2001, 159 (2) : 513-25. DOI: 10.1016/S0002-9440(10)61723-3. |
| [14] | 陈莉, 肖正华, 陈定宇, 等. 晚期糖基化终末产物对成纤维细胞形态及增殖功能的影响[J]. 现代医院,2011, 11 (6) : 18-20. |
| [15] | 牛轶雯, 陆树良, 青春, 等. 糖基化细胞外基质对成纤维细胞生物学行为的影响[J]. 上海第二医科大学学报,2004, 24 (9) : 697-9, 741. |
| [16] | 陈冲, 焦宁, 徐瑞荣, 等. 台盼蓝拒染法、MTT法、CCK-8法在研究As2O3细胞毒性作用中的意义[J]. 中国医药导报,2013, 10 (12) : 24-6. |
| [17] | 林炜栋, 陆树良, 青春, 等. 晚期糖基化终末产物对人血管内皮细胞增殖及凋亡的影响[J]. 感染、炎症、修复,2002, 3 (4) : 215-9, 封二. |
| [18] | 林炜栋, 陈向芳, 青春, 等. 糖尿病难愈创面与晚期糖基化终末产物的关系[J]. 感染、炎症、修复,2002, 3 (3) : 188-90. |
| [19] | Babu PP, Suzuki G, Ono Y, et al. Attenuation of ischemia and/or reperfusion injury during myocardial infarction using mild hypothermia in rats:an immunohistochemical study of Bcl-2, Bax, Bak and TUNEL[J]. Pathol Int,2004, 54 (12) : 896-903. DOI: 10.1111/pin.2004.54.issue-12. |
| [20] | Xie Z, Koyama T, Suzuki J, et al. Coronary reperfusion following ischemia: different expression of bcl-2 and bax proteins, and cardiomyocyte apoptosis[J]. Jpn Heart J,2001, 42 (6) : 759-70. DOI: 10.1536/jhj.42.759. |
| [21] | 王爱珍, 张振宇, 张元明, 等. 地塞米松对脑缺氧缺血新生大鼠细胞凋亡抑制蛋白1 mRNA及Caspase-3活性的影响[J]. 实用儿科临床杂志,2007, 22 (12) : 923-4, 935. |
| [22] | 方丽娟, 刘乃丰. 二甲双胍的心血管保护作用[J]. 中国临床药理学与治疗学,2011, 16 (2) : 232-6. |
| [23] | 任婷婷, 郭晓蕙, 徐国恒. 二甲双胍改善脂质代谢及胰岛素敏感性的机制[J]. 临床药物治疗杂志,2007, 5 (4) : 11-3, 10. |
| [24] | 邓宏明, 肖常青, 夏宁, 等. 二甲双胍治疗2型糖尿病人对血压影响的研究[J]. 高血压杂志,2002, 10 (3) : 197-9. |
| [25] | 鲁谦, 白鹏, 周荣, 等. 二甲双胍对人脐静脉内皮细胞缺氧/复氧损伤的保护作用[J]. 中国动脉硬化杂志,2014, 22 (3) : 247-51. |
| [26] | Matsumoto T, Noguchi E, Ishida K, et al. Metformin normalizes endothelial function by suppressing vasoconstrictor prostanoids in mesenteric arteries from OLETF rats, a model of type 2 diabetes[J]. Am J Physiol Heart Circ Physiol,2008, 295 (3) : H1165-76. DOI: 10.1152/ajpheart.00486.2008. |
| [27] | 刘智辉, 于青, 袁伟杰, 等. AGE与RAGE相互作用通过活性氧引起足细胞凋亡[J]. 中国中西医结合肾病杂志,2008, 9 (10) : 864-6, 插2. |
| [28] | Russell RR, Li J, Coven DL, et al. AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction, apoptosis, and injury[J]. J Clin Invest,2004, 114 (4) : 495-503. DOI: 10.1172/JCI19297. |
| [29] | Ido Y, Carling D, Ruderman N. Hyperglycemia-induced apoptosis in human umbilical vein endothelial cells: inhibition by the AMP-activated protein kinase activation[J]. Diabetes,2002, 51 (1) : 159-67. DOI: 10.2337/diabetes.51.1.159. |
| [30] | Blázquez C, Geelen MJ, Velasco G, et al. The AMP-activated protein kinase prevents ceramide synthesis de novo and apoptosis in astrocytes[J]. FEBS Lett,2001, 489 (2/3) : 149-53. |
| [31] | Hickson-Bick DL, Buja LM, Mcmillin JB. Palmitate-mediated alterations in the fatty acid metabolism of rat neonatal cardiac myocytes[J]. J Mol Cell Cardiol,2000, 32 (3) : 511-9. DOI: 10.1006/jmcc.1999.1098. |
| [32] | Ishibashi Y, Matsui T, Takeuchi M, et al. Metformin inhibits advanced glycation end products (AGEs)-induced renal tubular cell injury by suppressing reactive Oxygen species Generation via reducing receptor for AGEs (RAGE) expression[J]. Horm Metab Res,2012, 44 (12) : 891-5. DOI: 10.1055/s-00000025. |
| [33] | Ishibashi Y, Matsui T, Takeuchi M, et al. Beneficial effects of metformin and irbesartan on advanced glycation end products (AGEs)-RAGE-induced proximal tubular cell injury[J]. Pharmacol Res,2012, 65 (3) : 297-302. DOI: 10.1016/j.phrs.2011.11.001. |
| [34] | Ota K, Nakamura J, Li W, et al. Metformin prevents methylglyoxalinduced apoptosis of mouse Schwann cells[J]. Biochem Biophys Res Commun,2007, 357 (1) : 270-5. DOI: 10.1016/j.bbrc.2007.03.140. |
 2015, Vol. 35
2015, Vol. 35
