2. 安徽中医药大学研究生部,安徽 合肥 230038 ;
3. 安徽中医药大学药学院,安徽 合肥 230038
2. Graduate School, Anhui University of Chinese Medicine, Hefei 230038, China ;
3. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230038, China
肿瘤细胞与正常细胞在能量代谢方式上存在显著的差异,即使在供氧充足的条件下,肿瘤细胞仍以糖酵解作为能量代谢的主要方式,通过大量摄取葡萄糖产生乳酸以供能[1]。由于糖酵解产生的ATP比通过氧化磷酸化产生的ATP少得多,因此,维持高水平的糖酵解活性对于肿瘤细胞的存活和生长至关重要。利用肿瘤细胞能量代谢的这一特点而进行的肿瘤早期诊断、靶向治疗目前是抑制肿瘤细胞糖酵解的有效治疗方式[2-3]。氯尼达明是一种新型的抗肿瘤药,通过抑制糖酵解和肿瘤细胞呼吸链来干扰肿瘤细胞的能量代谢过程而发挥其抗肿瘤活性。临床研究表明氯尼达明在非小细胞肺癌(NSCLC)、乳腺癌、前列腺癌治疗中均有抗癌活性[4]。近年来对氯尼达明的研究大多集中在该药的合成工艺上,鲜有对其抗肿瘤作用机制的深入探讨[5]。由于肿瘤细胞增长迅速代谢旺盛,对能量需求增加,实体瘤中的肿瘤细胞,尤其是位于休眠区的肿瘤细胞,处于氧和葡萄糖相对缺乏的状态。肿瘤细胞氧和葡萄糖的相对缺乏,以及因葡萄糖酵解增加所致的ph降低将导致肿瘤细胞的内质网应激[6]。以往研究发现实体瘤组织中普遍存在内质网应激,它的存在可以降低肿瘤细胞对化疗药物的敏感性,进而参与肿瘤耐药[7]。本研究以乳腺癌为研究对象,把内质网应激作为突破点,通过氯尼达明抑制糖酵解,阻断肿瘤细胞能量供应后,观察内质网应激状态的改变及凋亡抑制蛋白家族cIAP1等分子的变化,为进一步探索氯尼达明抗肿瘤的机制提供研究基础,并为后续深入探讨以肿瘤细胞能量代谢为靶点的药物研发提供思路[8]。
1 材料与方法 1.1 材料 1.1.1 细胞MCF-7细胞购于美国ATCC公司,常规条件下培养。
1.1.2 试剂DMEM培养基、胰蛋白酶、小牛血清:美国Gibco公司;ATP检测试剂盒、氯尼达明:美国sigma公司;二甲基亚砜(DMSO):美国Amresco公司。兔抗人GRP78抗体,cIAP抗体,鼠抗人b-actin:美国Santa Cruz公司;caspase-3抗体:美国abcam公司。
1.2 方法 1.2.1 细胞培养将乳腺癌细胞MCF-7接种在含10%小牛血清的新鲜DMEM培养液(含100 U/mL青霉素,100 mg/L链霉素)中,放置于37 ℃、5% CO2的培养箱中。
1.2.2 MTT法检测细胞存活率96孔板接种处于对数生长期的MCF-7细胞,每孔6×103个细胞,100 mL培养液,培养18~24 h,弃去培养液,加入含药培养液100 mL。氯尼达明设置5个浓度梯度:50、100、150、200和250 mmol/L,并设空白和阴性对照组。每组设4个复孔。分别在加药24、48、72 h后,每孔加入MTT(5 g/L)15 mL,继续培养4 h后,吸弃上清液后每孔再加入150 mL DMSO,用微量震荡器震荡10 min使结晶物充分溶解,然后用酶标仪测定570 nm处每孔吸光度(A)值,计算出细胞存活率:细胞存活率(%)=实验组A值/对照组A值×100(%)。以上实验重复3次
1.2.3 集落形成实验将正处于对数生长期的乳腺癌细胞MCF-7接种于6孔板中,每孔接种1×104个细胞,2 mL培养液,待细胞贴壁后加药处理。培养5~7 d,观察细胞集落形成情况。多聚甲醛固定细胞后,结晶紫染色,轻轻洗涤并晾干。
1.2.4 PI/Annexin V双染检测细胞凋亡将处于对数生长期的乳腺癌细胞MCF-7接种于6孔板中,每孔1×105个细胞,2 mL培养液,待细胞贴壁后加药处理。收集细胞至10 mL离心管,2000 r·min-1离心5~10 min,弃上清。PBS洗涤两次,转移至5 mL离心管,2000 r·min-1离心5~10 min,弃上清。每管加入500 mL Binding Buffer悬浮细胞后,再加入5 mLAnnexin V-FITC混匀,室温,避光反应5~15 min,再加入5 mL PI,混匀。1 h内上机检测,以上实验重复3次。
1.2.5 ATP检测把处于对数生长期的乳腺癌细胞MCF-7接种在12孔板中,每孔接种2×105个细胞,1 mL培养液,培养18~24 h,等到细胞覆盖板底70%后继续加药处理。设置药物浓度为50、150和250 mmol/L 3组,另设阴性对照组。5 h后将细胞收集于离心管中,10 000 r/min离心5 min,弃上清,每管加入100 mL裂解液。待细胞充分裂解后,4 ℃,12 000 r/min离心10 min,将上清取出用于后续测定。接着取新96孔板,每孔加入100 mL ATP工作液(1:100),于室温下放置5 min。等本底性ATP消耗完毕后,避光下每孔加入30 mL BCA法蛋白定量后的样品,2 s后立即检测。
1.2.6 Western blot检测蛋白表达在6孔板中接种处于对数生长期的乳腺癌细胞MCF-7,每孔接种5×105个细胞,2 mL培养液,培养18~24 h,等细胞覆盖板底70%后加药处理。收集细胞,冰上裂解30 min,提取细胞总蛋白,BCA蛋白定量法测定各组蛋白浓度并定量至同一浓度水平,100 ℃煮沸5 min变性。每组取50 mg蛋白,SDS-PAGE凝胶电泳(70 V,30 min,90 V,90 min),转膜(50 mA 150 min)至PVDF膜;5%脱脂牛奶室温封闭2 h;PBS洗净,一抗室温孵育2 h;TPBS洗涤3次,二抗室温孵育2 h;TPBS洗涤3次,PBS洗涤1次;ECL发光试剂盒发光、显影。Bio-Rad凝胶成像系统获取图像。
1.2.7 统计学方法本实验数据以均数±标准差表示,数据的方差分析使用SPSS 13.0软件,并且用双侧Dunnett t检验做各组间比较,以P < 0.05为有统计学意义。
2 结果 2.1 氯尼达明对乳腺癌细胞MCF-7增殖的抑制作用实验使用不同浓度的氯尼达明来处理人乳腺癌细胞株MCF-7,然后通过MTT实验检测细胞存活率。如图所示,随着氯尼达明浓度的不断增加(50、100、150、200和250 mmol/L),MCF-7细胞24 h的细胞存活率显著降低。检测氯尼达明作用24、48、72 h后细胞的存活率,结果显示,随着时间的延长,氯尼达明对人乳腺癌细胞MCF-7增殖的抑制作用不断增强(图 1A)。集落形成实验结果显示,随着氯尼达明浓度的增加(25、50和100 mmol/L),MCF-7细胞的集落形成能力显著降低(图 1B)。由以上实验结果可以看出,氯尼达明对乳腺癌细胞MCF-7具有增殖抑制作用。
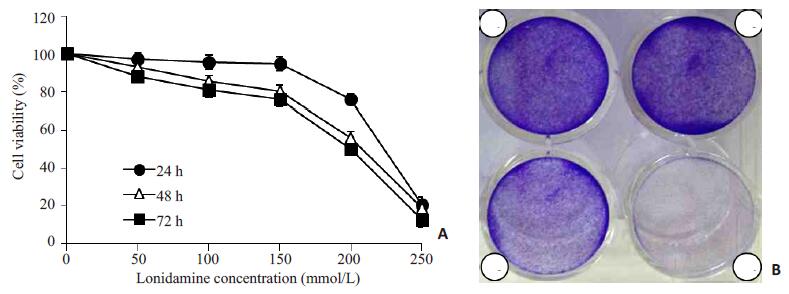
|
图 1 氯尼达明对乳腺癌细胞MCF-7增殖的抑制作用 Figure 1 Cell proliferation inhibition by lonidamine in breast cancer MCF-7 cells. A: MTT assay of MCF-7 cells treated with medium (Control) or indicated concentrations of lonidamine for 24, 48 or 72 h. Results are expressed as percentage of non-treated control cells. B: MCF-7 cells treated with medium (Control), 25, 50, and 100 mmol/L lonidamine for seven days (1, 2, 3, and 4, respectively). Cell viability was determined with crystal violet staining. |
实验中对不同浓度氯尼达明处理的细胞进行PI/ Annexin V染色,并通过流式细胞仪分析。如图所示,随着氯尼达明浓度的增加,细胞的凋亡率也呈增加趋势。与阴性对照组相比,250 mmol/L氯尼达明处理组细胞的凋亡率增加了49.1%(图 2)。结果表明,氯尼达明具有诱导乳腺癌细胞MCF-7产生凋亡的作用。
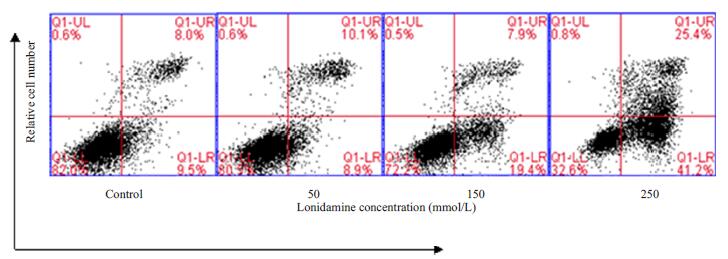
|
图 2 氯尼达明诱导乳腺癌细胞MCF-7凋亡的作用 Figure 2 Lonidamine-induced apoptosis in breast cancer MCF-7 cells. MCF-7 cells were treated with medium (Control) or 50, 150, and 250 mmol/L lonidamine for 24 h. The distribution of viable, apoptotic, and necrotic cells were determined using flow cytometry with PI/AnnexinV staining. |
为观察氯尼达明对MCF-7细胞内ATP水平的影响,实验使用50、150和250 mmol/L3种不同浓度的氯尼达明来处理乳腺癌细胞MCF-7 5 h。与对照组比较,药物处理组细胞内ATP的含量随着氯尼达明的浓度升高呈下降趋势,分别为80.67%, 62.78%和30.73%,差异具有统计学意义(P < 0.05,图 3)。实验结果表明,氯尼达明能够抑制MCF-7细胞内ATP的产生。
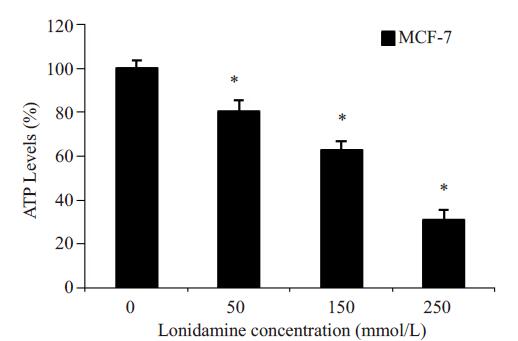
|
图 3 氯尼达明抑制MCF-7细胞内ATP产生作用 Figure 3 Lonidamine reduces ATP levels in MCF-7 cells. MCF-7 cells were treated with 0 (control) and 50, 150, and 250 mmol/ L lonidamine for 5 h. Intracellular ATP level was quantified using an ATP assay kit. *P < 0.05 vs control. |
为观察氯尼达明对MCF-7细胞GRP78蛋白表达的影响,实验中使用200 mmol/L氯尼达明处理MCF-7细胞不同时间,如图所示,随着药物作用时间的延长,GRP78蛋白的表达呈上升趋势(图 4)。
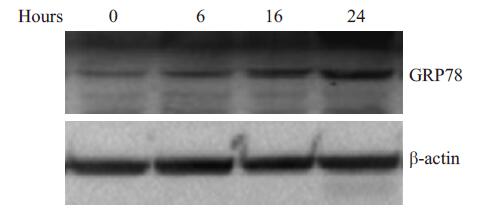
|
图 4 氯尼达明上调乳腺癌细胞MCF-7 GRP78蛋白的表达 Figure 4 Lonidamine up-regulates GRP78 expression in MCF-7 cells. MCF-7 cells treated with medium (Control) and 200 mmol/L lonidamine for 6, 16 and 24 h. Whole cell lysates were subjected to Western blot analysis to quantify GRP78 and β-actin. |
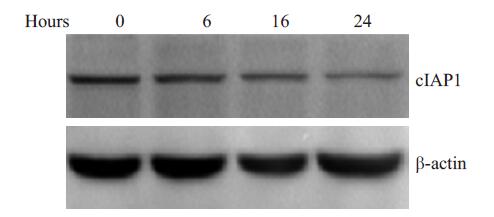
为观察氯尼达明对MCF-7细胞cIAP蛋白表达的影响,实验中使用200 mmol/L氯尼达明处理MCF-7细胞不同时间,如图所示,随着药物作用时间的延长,cIAP蛋白的表达呈下降趋势(图 5)。
|
图 5 氯尼达明下调乳腺癌细胞MCF-7 cIAP蛋白的表达 Figure 5 Lonidamine down-regulates cIAP1 expression in MCF-7 cells. MCF-7 cells treated with medium (Control) or 200 mmol/L lonidamine for 6, 16 and 24 h. Whole cell lysates were subjected to Western blot analysis to quantify cIAP1 and β-actin. |
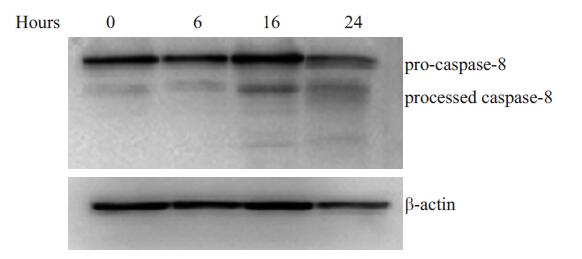
实验检测了在上述相同处理条件下,MCF-7细胞中caspase-8的表达情况。由图中可以看出,随着药物作用时间的延长,caspase-8的活性被明显激活(图 6)。
|
图 6 氯尼达明增强乳腺癌细胞MCF-7 caspase的激活作用 Figure 6 Effect of lonidamine on expression of caspase-8 in MCF-7 cells MCF-7 cells treated with medium (Control) or 200 mmol/L lonidamine for 6, 16 and 24 h. Whole cell lysates were subjected to Western blot analysis to quantify caspase-8 and β-actin. |
内质网是细胞调亡调节中的重要环节。当细胞遭到毒性药物、感染、缺氧等刺激时,内质网腔未折叠蛋白增多和细胞内钙离子超载,可以激活内质网应激。在应激早期阶段,对抗及修复由上述不良刺激造成的细胞损害,维持稳态,对细胞起保护作用;当这些不良刺激持续存在并超过细胞自身修复能力时,即激活下游的caspase,导致细胞调亡。深入研究内质网应激,对于完善细胞损伤保护机制和调亡理论具有重要意义,有助于进一步认识疾病发生发展的机制,为临床疾病预防和治疗提供新的理论依据。
近年来,氯尼达明通过抑制糖酵解以对抗肿瘤作用越来越受到关注。有研究报道,氯尼达明可抑制与线粒体结合的己糖激酶活性从而降低肿瘤细胞的的糖酵解,并对凋亡相关蛋白的表达产生影响。从本次研究的结果中可以看出,氯尼达明对乳腺癌细胞MCF-7具有增殖抑制作用,并诱导其凋亡,其机制可能与抑制胞内ATP的产生,上调GRP78,引起内质网应激反应有关[9]。与此同时,氯尼达明使MCF-7细胞中cIAP1表达下调,进而caspase激活增多,最终启动细胞凋亡程序。
GRP78是内质网(endoplasmic reticulum, ER)功能的中心调节者,它作为一种分子伴侣参与蛋白质的折叠和转运,在低糖、低氧、低Ca2+等应激状态下大量表达以维持内质网的稳定,保护细胞[10]。适度的未折叠蛋白反应(unfold protein response, UPR)对细胞具有保护作用,但过度的UPR最终将导致细胞凋亡。因此,触发肿瘤细胞产生过强的ER应激反应,促使UPR保护机制无法产生抗凋亡作用,最终实现肿瘤细胞的凋亡[11]。王新等发现,GRP78在乳腺癌组织中为高表达的因子,并且这种表达随着细胞的分化程度升高而降低,随着乳腺癌分期的延后而升高[12]。以往研究表明,GRP78可以作为肿瘤细胞特异的细胞毒药物的靶向分子,系统应用GRP78结合序列和促凋亡序列的嵌合肽可以抑制肿瘤的生长, 且不影响正常组织[13]本研究的结果也验证了这一点,随着氯尼达明作用时间的延长,细胞内ATP水平显著降低,促使乳腺癌细胞产生ER应激反应,GRP78表达上调,进而激活下游信号转导通路,共同促进MCF-7细胞的凋亡。
凋亡抑制剂(inhibitor of apoptosis, IAP)家族是一类高度保守的抗凋亡蛋白,目前已发现了至少8种人源的IAP分子,包括cIAP-1、cIAP-2、NIAP、XIAP、ILP-2、Survivin、Bruce及Livin,是近几年来生物医学方面研究比较活跃、比较透彻的一类蛋白[14]。它和Bc l-2家族蛋白是caspase两个不同水平的调控因子。Bc l-2家族蛋白控制caspase上游信号传导的部分,而I A P家族蛋白则直接结合并且抑制caspase,主要通过抑制caspase活性和参与调节核因子NF-κB的作用抑制细胞凋亡[15]。BIR结构域是cIAP1发生抑凋亡作用的重要功能区,通过此结构与相应caspase结合,抑制caspase的激活,从而阻断细胞凋亡进程[16]。除了少数细胞凋亡通路是非caspases依赖性的,绝大部分最终都汇合成一个可激活caspase的中心死亡信号, 正是caspase的激活才导致细胞死亡的最终事件[17]。近年来发现,某些IAP成员异常表达与肿瘤密切相关,成为肿瘤治疗的潜在靶点。本实验结果表明,氯尼达明下调了抑凋亡蛋白cIAP1的表达,剪切活化凋亡启动因子caspase-8,最终导致细胞凋亡。
本研究结果表明氯尼达明对乳腺癌的治疗具有一定的作用,但本实验仅选用了体外培养的人乳腺癌细胞株进行观察,进一步的体内外药效及机制有待于进一步深入的研究,而如何将糖酵解抑制剂与其他化疗药物及放疗联用也必将成为一个重要的研究方向。
| [1] | 严家文, 钟俊, 王国成, 等. 靶向肿瘤糖酵解途径用于肿瘤治疗的研究进展[J]. 中国新药杂志,2014, 23 (5) : 550-6. |
| [2] | 冯延, 徐瑜, 胡义德. 恶性肿瘤细胞能量代谢特点及研究进展[J]. 中华肺部疾病杂志,2013, 6 (3) : 270-4. |
| [3] | Scatena R, Bottoni P, Pontoglio AA, et al. Glycolytic enzyme inhibitors in cancer treatment[J]. Expert Opin Investig Drugs,2008, 17 (10) : 1533-45. DOI: 10.1517/13543784.17.10.1533. |
| [4] | 于晨, 孙秀华, 张阳, 等. 氯尼达明联合NP方案治疗30例晚期非小细胞肺癌[J]. 中国肿瘤临床,2010, 37 (13) : 763-6. |
| [5] | 刘娟, 冯国龙, 贺玉林. 抗肿瘤药氯尼达明的研究进展[J]. 生物技术世界,2013 (7) : 74. |
| [6] | 范威, 潘翠萍, 张懿敏, 等. 内质网应激对乳腺癌MCF-7细胞CCL5表达的影响[J]. 肿瘤防治研究,2012, 39 (4) : 385-8. |
| [7] | Uckun FS, Ozer Z. Inducing apoptosis in chemotherapy-resistant B-lineage acute lymphoblastic leukaemia cells by targeting HSPA5, a master regulator of theanti-apoptotic unfolded protein response signalling network[J]. Br J Haematol,, 153 (6) : 741-52. DOI: 10.1111/j.1365-2141.2011.08671.x. |
| [8] | 许晓巍, 孟祥军, 王椿. 糖酵解与肿瘤[J]. 国际肿瘤学杂志,2011, 38 (8) : 585-9. |
| [9] | 吴国豪. 肿瘤治疗新策略:针对肿瘤细胞代谢特征的靶向治疗[J]. 中国实用外科杂志,2009, 29 (1) : 23-5. |
| [10] | 宋乐乐, 马琳艳, 张旭东, 等. 衣霉素联合顺铂对人鼻咽癌细胞增殖和凋亡的影响[J]. 南方医科大学学报,2012, 32 (6) : 766-71. |
| [11] | 王琦, 韩凯, 李雪芽, 等. 内质网应激途径在鬼臼毒素纳米脂质载体诱导VK2/E6E7细胞凋亡的机制[J]. 南方医科大学学报,2014, 06 (6) : 832-6. |
| [12] | 王新, 范立君, 李壮, 等. GRP78、GRP94在乳腺癌中的表达及其意义[J]. 黑龙江医药科学,2014, 37 (6) : 89-91. |
| [13] | 赵慧红, 王兴武, 宋冬. 葡萄糖调节蛋白GRP78在肿瘤治疗和预后中的应用[J]. 中国卫生检验杂志,2010, 20 (5) : 1260-2. |
| [14] | 郎伟宁, 邓志华. survivin和livin与肿瘤细胞凋亡[J]. 国际肿瘤学杂志,2011, 38 (8) : 575-7. |
| [15] | Cossu, F. Designing Smac-mimetics as antagonists of XIAP, cIAP1, and cIAP2[J]. Biochem Biophys Res Commun,2009, 378 (2) : 162-7. DOI: 10.1016/j.bbrc.2008.10.139. |
| [16] | 程秀, 刘浩, 方琳, 等. 2-DG增强乳腺癌细胞对阿霉素化疗敏感性的作用[J]. 中国药理学通报,2010, 26 (10) : 1371-6. |
| [17] | 吴萍, 程艳伟, 张旭东, 等. 凋亡抑制蛋白在TRAIL诱导胃癌细胞凋亡中的作用[J]. 中国药理学通报,2013, 29 (6) : 850-3. |
 2015, Vol. 35
2015, Vol. 35
