近年来,由动脉粥样硬化所致的心血管疾病发生率和死亡率逐年上升,成为人类死亡的主要原因[1-3]。他汀类药物,即3-羟基-3甲基-戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是一类抗动脉粥样硬化药,具有良好的降血脂、改善内皮功能、抑制血栓形成等多种作用,在临床上广泛使用[4-6],主要给药方式是口服。其中普伐他汀是他汀家族中的水溶性药物,无需代谢转化就具有药理活性[7]。但普伐他汀口服生物利用度低,半衰期短,且对胃酸敏感,容易转化为活性仅为1/40的异构体,因此如果能改变普伐他汀的给药方式,则可以使其避开胃酸环境以及肝脏的首过效应,显著提高其生物利用度。
壳聚糖具有良好生相容性,广泛应用于生物医用材料[8]。本研究中,我们将壳聚糖作为载体,将普伐他汀钠包载于其中,并采用京尼平作为交联剂。京尼平是从栀子果实中提取的一种天然生物交联剂,与以往常用于交联壳聚糖的戊二醛、甲醛等交联剂比较,具有显著的生物安全性[9-11],其细胞毒性比戊二醛低1000倍,而交联能力更强,在体内的酶降解率亦较低[12-15]。本文考察了壳聚糖相对分子质量、油相水相体积比、反应温度、搅拌速度等因素对成球的影响,并对其体外释药行为进行表征,以期制得一种包载普伐他汀钠的长效缓释微球,这种长效释药微球,有望应用于经皮给药、长期皮下植入给药,还可应用于心血管组织工程修复材料。
1 材料和方法 1.1 仪器与试剂EVO18扫描电镜(德国Zeiss);Nicolet 6700红外光谱仪(美国Thermo Fisher科技有限公司);H1650R台式高速离心机(湖南湘仪实验室仪器开发有限公司);UV7504紫外光谱仪(上海兴茂科技有限公司),THZ-D台式恒温振荡器(广州市正一科技有限公司);MD 25 mm透析袋(截留相对分子质量8000~14 000,美国MYM生物科技有限公司)。
壳聚糖(脱乙酰度≥90%,阿拉丁试剂上海有限公司);京尼平(HPLC≥98%,日本和光纯药工业株式会社);普伐他汀钠(广东蓝宝制药有限公司);液体石蜡(分析纯,天津市大茂化学试剂厂);Span-80(化学纯,天津市大茂化学试剂厂);醋酸(化学纯,天津市大茂化学试剂厂)。其它试剂均为分析纯。
1.2 壳聚糖微球的制备方法在一定温度下,将135.2 mL含4 % Span-80的液体石蜡加入到500 mL三颈瓶中,搅拌混匀制成油相。将壳聚糖1.5 %醋酸溶液与药物水溶液混合,磁力搅拌使其完全溶解,作为水相逐滴滴加到油相中,电动搅拌1 h,形成W/O型乳液,随后将京尼平1.3 %乙醇溶液10 mL缓慢滴加到上述乳液中,交联固化一定的时间。高速离心弃去上层油相,分别用石油醚、异丙醇、丙酮离心洗涤3次,产物真空干燥12 h备用。
1.3 壳聚糖微球的表征 1.3.1 溶胀度的测定在室温下精密称取50 mg壳聚糖微球,将其浸没于pH分别为2、4、7、9、10的溶液中振荡16 h后离心收集,用滤纸吸干微球表面水分后用电子分析天平称量其质量。平行测定3次。微球的溶胀率Esw可根据下式计算:
| $ {E_{sw}}\left( \% \right) = \left[ {\left( {{W_{\rm{s}}} - {W_0}} \right)/{W_0}} \right] $ |
(Ws为溶胀后的质量,W0为溶胀前的质量)。
1.3.2 通过扫描电镜对微球的表面形态进行评价取适量微球粘附于粘有导电胶的铜板上,真空下喷金,用扫描电子显微镜(SEM)观察其表面形态。
1.3.3 包封率的测定精密称取微球样品20 mg于研钵中研细,置于锥形瓶中,加入50 mL蒸馏水,用细胞粉碎机充分打散,溶液过滤后取滤液稀释后于238 nm测其紫外吸光度,计算药物含量,平行测定3次。按下式计算包封率:
包封率=微球中包封的药量/投入的药量×100%
1.4 体外释放试验将载药壳聚糖微球50 mg放入透析袋中,浸没于200 mL的PBS(pH=7.4)溶液中,于37 ℃恒温摇床中缓慢释放(100 r/min)。定时取样,同时补充等量释放液。在238 nm处测定其吸光度,根据标准工作曲线测定释药量。
2 结果 2.1 壳聚糖相对分子质量的影响为了比较不同相对分子质量壳聚糖对成球的影响,分别采用低黏度( < 200 mPa.s),中黏度(200~400 mPa.s)以及高黏度( > 400 mPa.s)的壳聚糖为原料制备微球,SEM照片结果见图 1。从图中可以看出,低黏度的壳聚糖(图 1A)制备的微球粒径小,所制备的微球黏连在一起;高黏度的壳聚糖(图 1C)制备出的微球相对较脆,可观察到不少破碎的微球;而中等黏度壳聚糖(图 1B)可以得到球形较完整,分散相对均匀的微球。

|
图 1 壳聚糖相对分子质量对微球的影响 Figure 1 Influence of molecular weight of chitosan on microspheres. A: Low viscosity ( < 200 mPa.s); B: Moderate viscosity (200~400 mPa.s); C: High viscosity ( > 400 mPa.s)(40 ℃, 850 r/min, oil-water ratio 10:1). |
图 2所示为不同油相水相体积比制得的微球形貌,由图可知,当油水比为5:1时,微球有轻微粘连,球形规整度稍有欠缺,这是因为若油相较少,则形成的油相膜不能很好地将水相隔离,导致水相微球碰撞几率加大,加大粘连几率[16];油水比为10:1时球形较好,分散较为均一;继续升高油水比至15:1时,微球表面光滑,形态良好,但粒径大小不一,并且也有粘连现象,可能是因为油相比例过大,微球表面难以清洗所致。

|
图 2 油相与水相体积比对微球的影响 Figure 2 Effect of oil-water ratio on microspheres. A: 5:1; B: 10:1; C: 15:1 (medium viscosity chitosan, 40 ℃, 850 r/min). |
为了考察反应温度对成球的影响,分别在25、40、45 ℃制得壳聚糖微球,其SEM照片见图 3。从图 3A中可以看出,反应温度为25 ℃时,微球难以形成,基本观察不到微球,这是因为反应温度过低,分子间的有效碰撞大大减少,反应进行不完全;温度升高到45 ℃时(图 3C),形成的微球出现不少碎片,这可能是因为,反应温度偏高,使得交联剂部分变性,或者交联过度所致;反应温度为40 ℃时(图 3B),得到的球形较好,未见明显碎片。

|
图 3 反应温度对微球的影响 Figure 3 Effect of reaction temperature on microspheres. A: 25 ℃; B: 40 ℃; C: 45 ℃. |
在乳液交联法中,搅拌的作用是通过剪切力将反应体系分散成液滴。考察了搅拌速度分别为550、850、1250 r/min时得到的微球形貌,结果见图 4。可以看出,当搅拌速度较低时(图 4A),微球大小不均一,有粘连,这是因为过低的搅拌速度难以阻碍反应过程中形成的液滴碰撞;搅拌速度升高到850 r/min时,得到的微球分散性较好(图 4B);而搅拌速度增大到1250 r/min时(图 4C),球形不佳,并且产生粘连。

|
图 4 反应过程中搅拌速度对制备微球的影响 Figure 4 Effect of stirring speed on the microspheres. A: 550 r/min; B: 850 r/min; C: 1250 r/min. |
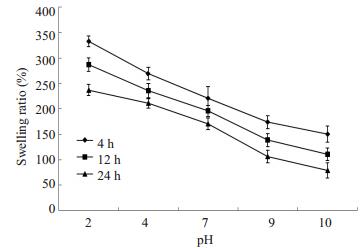
由于壳聚糖结构单元中分布着不少羟基、氨基,在水溶液中可与溶剂水分子形成分子间氢键而使分子链舒展、溶胀。我们分别考察了不同交联时间壳聚糖微球在酸性、中性和碱性溶液中的溶胀度情况(图 5)。从图中可以看出,随着溶液pH值的升高,壳聚糖微球的溶胀度逐渐减小。这是由于壳聚糖上的氨基在酸性溶液中质子化,正电荷间的静电排斥作用使得分子链更为舒展,大量的水分子可进入到壳聚糖微球的交联网络中;而在碱性溶液中,氨基发生了去质子化现象,大分子链间的排斥作用也就减弱,溶胀度减小[17]。此外,对比图中三条曲线可以看出,交联时间越长,微球溶胀度越小。这是由于微球的交联时间越长,交联网络越致密,溶剂分子进入网络中更困难,溶胀度也就越小。
|
图 5 不同pH值环境中不同交联时间壳聚糖微球的溶胀度 Figure 5 Swelling ratios of chitosan microspheres (cross-linked for different time) under different pH conditions. |
考察了不同交联时间壳聚糖微球的普伐他汀包封率,投药质量比为1:2(药物:壳聚糖)时,交联2、4、12、24 h,的微球包封率分别为28.6%,30.2%,43.8%,54.7%。可知,随着交联时间的延长,药物的包封率相应提高,这是由于交联时间延长可使反应更加完全,更多的药物被包裹于微球中,所以包封率提高。
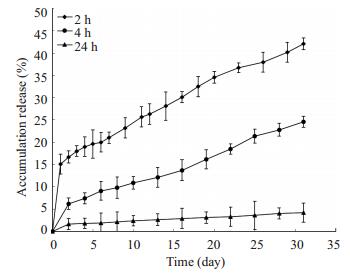
2.7 载药微球的体外释放3种不同载药壳聚糖微球在37 ℃下的累积释药量示于图 6,可以看到,在31 d时,药物的释放量为4%~42%,改变交联时间可以得到释药速度不同的微球,交联时间越长,药物释放速度越慢。其中交联2 h的壳聚糖微球存在一定的突释现象,9 h内的累计释药量达到14.1%,而其他交联时间制备的微球突释现象并不明显。因此,可以通过调节微球交联时间来调节其释药速度。
|
图 6 不同交联时间载药微球的体外累积释药量 Figure 6 In vitro drug release profile of chitosan microspheres cross-linked for different time. |
本研究针对心血管药物普伐他汀钠采用传统口服剂型对胃酸敏感、生物利用度低的问题,以栀子提取物京尼平为交联剂,通过壳聚糖与京尼平的亲核取代以及亲核进攻发生交联反应[18],得到包载普伐他汀的壳聚糖微球。交联后的壳聚糖微球由于形成交联网络,可以有效控制包载的普伐他汀长效缓慢释放。本文通过调控反应条件,得到了最佳反应条件:中等黏度的壳聚糖(200~400 mPa.s),油相水相比为10:1,反应温度为40 ℃,搅拌速度850 r/min。制得的壳聚糖微球在不同pH环境表现出不同溶胀度,pH值越高,溶胀度越小。
普伐他汀钠在壳聚糖微球中的包载一方面是通过普伐他汀钠结构中带负电的羧酸根离子与壳聚糖结构单元中带正电荷的氨基之间的静电吸引作用;另一方面,通过京尼平的交联,形成的交联网络可以较好地把普伐他汀钠物理截留在微球中,延缓其释放。从普伐他汀钠的体外释放曲线来看,药物的释放速度可以通过交联时间来进行调节,药物的释放可以持续到31 d以后。这种载有心血管药物普伐他汀钠的微球如果用于经皮给药、皮下植入给药,或者用于心血管植入材料,可望在较长时间内维持药物直接释放于心血管系统,显著提高普伐他汀钠的生物利用度。
| [1] | 潘修勇. 他汀类药在心血管疾病治疗中的临床应用[J]. 吉林医学,2014 (18) : 3970. |
| [2] | 曾宪锋. 羟甲基戊二酰辅酶A还原酶抑制剂的研究进展[J]. 临床合理用药杂志,2014, 7 (2) : 67. |
| [3] | Nahrendorf M, Swirski FK. Lifestyle effects on hematopoiesis and atherosclerosis[J]. Circ Res,2015, 116 (5) : 884-94. DOI: 10.1161/CIRCRESAHA.116.303550. |
| [4] | Koh KK, Sakuma I, Hayashi T, et al. Renin-angiotensin system inhibitor and statins combination therapeutics-what have we learnt[J]. Expert Opin Pharmacother,2015, 16 (7) : 949-53. DOI: 10.1517/14656566.2015.1019464. |
| [5] | Nochioka K, Sakata Y, Miyata S, et al. Prognostic impact of statin use in patients with heart failure and preserved ejection fraction[J]. Circ J,2015, 79 (3) : 574-82. DOI: 10.1253/circj.CJ-14-0865. |
| [6] | 张小平. 普伐他汀对冠心病患者血脂、血浆Chemerin水平、超敏C反应蛋白、血清脂联素的影响[J]. 中国医药导报,2014, 11 (15) : 72-4. |
| [7] | Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: an update[J]. Fundam Clin Pharmacol,2005, 19 (1) : 117-25. DOI: 10.1111/fcp.2005.19.issue-1. |
| [8] | Xia WS, Liu P, Zhang JL, et al. Biological activities of chitosan and chitooligosaccharides[J]. Food Hydrocoll,2011, 25 (2) : 170-9. DOI: 10.1016/j.foodhyd.2010.03.003. |
| [9] | Li M, Xu J, Li R, et al. Simple preparation of aminothioureamodified chitosan as corrosion inhibitor and heavy metal ion adsorbent[J]. J Colloid Interface Sci,2014, 417 (6) : 131-6. |
| [10] | Ciobanu BC, Cadinoiu AN, Popa MA, et al. Modulated release from liposomes entrapped in chitosan/gelatin hydrogels[J]. Mater Sci Eng C Mater Biol Appl,2014, 43 (2) : 383-91. |
| [11] | Liu Y, Lv Z, Zhang C, et al. Preparation and immunogenicity of silk fibroin/chitosan microspheres for DNA vaccine delivery against infectious bursal disease virus[J]. Sheng Wu Gong Cheng Xue Bao,2014, 30 (3) : 393-403. |
| [12] | Li YH, Cheng CY, Wang NK, et al. Characterization of the modified chitosan membrane cross-linked with genipin for the cultured corneal epithelial cells[J]. Colloids Surf B Biointerfaces,2015, 126 (14) : 237-44. |
| [13] | Xu J, Strandman S, Zhu JX, et al. Genipin-crosslinked catecholchitosan mucoadhesive hydrogels for buccal drug delivery[J]. Biomaterials,2015, 37 (24) : 395-404. |
| [14] | Khan A, Salmieri S, Fraschini C, et al. Genipin cross-linked nanocomposite films for the immobilization of antimicrobial agent[J]. ACS Appl Mater Interfaces,2014, 6 (17) : 15232-42. |
| [15] | Ye M, Zeng S, Gao W, et al. Preparation and characterization of genipin-crosslinked silk fibroin/chitosan controlled-release microspheres[J]. Nan Fang Yi Ke Da Xue Xue Bao,2014, 34 (6) : 875-9. |
| [16] | 王怀玉, 董利民, 王晨, 等. 乳化交联法制备壳聚糖球粘连原因分析[J]. 功能材料,2007, 38 (5) : 1923-5. |
| [17] | Khurma JR, Nand AV. Temperature and PH sensitive hydrogels composed of chitosan and poly (ethylene glycol)[J]. Polym Bull,2008, 59 (9) : 805-12. |
| [18] | Mi FL, Shyu SS, Peng CK. Characterization of ring-opening polymerization of genipin and pH-dependent cross-linking reactions between chitosan and genipin[J]. J Polym Sci A Polym Chem,2005, 43 (10) : 1985-2000. DOI: 10.1002/(ISSN)1099-0518. |
 2015, Vol. 35
2015, Vol. 35