2. 中山大学附属第三医院超声科,广东 广州 510630 ;
3. 中山大学化学与化学工程学院,广东 广州 510275
2. Department of Medical Ultrasound, Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 516030, China ;
3. School of Chemistry and Chemical Engineering, Sun Yat-sen University, Guangzhou 510275, China
基因治疗以其高度的靶向性及显著的治疗效果成为当今研究的热点。实现基因转染的载体和方法多样,但都有其相应的局限性[1]。其中超声靶向微泡破坏(UTMD)技术以安全、无创等优点,为基因靶向递送提供一种具有广阔应用前景的方法[2]。课题组在前期工作中以异质性组装法成功制备高效负载小干扰RNA(siRNA)的脂质微泡超声造影剂,并在低频超声辐照下获得良好的体外细胞转染效果[3-5]。本研究拟在前期工作的基础上,针对抗肿瘤凋亡关键基因SIRT2设计siRNA,制备载siRNA的脂质微泡超声造影剂。一方面通过UTMD技术,将siRNA靶向递送肿瘤部位,对恶性肿瘤进行基因治疗;另一方面通过超声造影(CEUS)技术,在治疗的同时对肿瘤进行疗效监测,实现以超声为基础的肿瘤基因治疗和疗效评估一体化。
1 材料与方法 1.1 材料与设备主要试剂:二棕榈酰磷脂酸(DPPA)、二硬脂酰磷脂酰乙醇胺(DSPE)、二棕榈酰磷脂酰胆碱(DPPC)采购于Avanti Polar Lipids公司(美国);全氟丙烷气体(C3F8)采购于天津核工业理化工程研究院;SIRT2 siRNA(siSIRT2)、红色荧光Cy3标记的阴性对照siRNA(Cy3-SCR)由苏州吉玛公司合成;Hoechst 333422(碧云天);凋亡染色试剂盒(TUNEL法,罗氏,德国)。
设备:粒度分析仪(90 Plus/BI-MAS Brookhaven,美国);超声波发生器(VCS 130 PB,Sonics and Materials Inc,美国);ZHWY-200B型恒温摇床(智城分析仪制造有限公司,上海);超声基因转染治疗仪(DCT-700,威尔德,深圳)。
1.2 携siRNA微泡(siRNA-NBs)制备参考实验室前期制备携siRNA-NBs的方法[3],以异质性组装法制备siRNA-NBs。DPPC、DSPE、DPPA为基本原料,以薄膜-水化、声震法制备表面带负电荷的纳米脂质气泡(NBs)。以两嵌段阳离子聚合物PEG-PLL(由中山大学化学与化学工程学院提供)与siRNA在水中自组装形成表面带正电的siRNA胶束。将NBs与siRNA胶束置于水中通过正负电荷作用组装成siRNA-NBs。
1.3 动物模型选取大鼠C6神经胶质瘤细胞用于模型的建立:用0.1 mL PBS将C6细胞(1×106)重悬后,接种于裸鼠(BALB/c裸鼠,雄性,4~6周,18~23 g)右侧背部皮下,待肿瘤直径达6 mm后用于后续实验。
1.4 siRNA瘤内分布实验为观察siRNA在肿瘤内分布情况,将Cy3标记的SCR负载于NBs;经尾静脉注射15 min后,进行超声辐照(US(+)组)或不进行辐照(US(-)组)2 h后,处死实验裸鼠并用生理盐水进行心脏灌注,去除血循环中的微泡。取肿瘤组织后行冰冻切片,并用Heochst 33342染核10 min,置于激光共聚焦显微镜下观察红色荧光的瘤内分布情况。
1.5 肿瘤治疗实验将荷瘤裸鼠随机分为4组(n=6):siSIRT2-NBs+超声辐照组(siSIRT2-NBs US(+)),siSIRT2-NBs组无超声辐照(siSIRT2-NBs US(-)),SCR-NBs+超声辐照组(SCR-NBs US(+)),PBS对照组。尾静脉注射siRNA-NBs后,用低频超声辐照2 min(根据预实验结果选择辐照条件:频率为1 MHz;最大声压2500 kPa;占空比为50%;时间2 min)。治疗每隔2 d进行1次,持续10 d,每天测量肿瘤大小,肿瘤体积按以下公式计算:V=0.5×a×b2,其中V为肿瘤体积(mm3);a为肿瘤长径(mm);b为肿瘤短径(mm)。治疗10 d后,处死实验裸鼠,取肿瘤组织行石蜡切片。分别对各组石蜡切片组织进行H & E染色、针对SIRT2基因的免疫组化染色及凋亡TUNEL染色。
1.6 超声造影(CEUS)检查在治疗1周后,对各组实验动物进行超声造影检查。尾静脉注射SCR-NBs(50 μL)后,录取动态视频图像,分析各组肿瘤组织的灌注情况。
1.7 统计学方法用SPSS 13.0软件包进行统计学分析,实验数据均以均数±标准差表示,多组之间比较用方差分析,两两比较用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 siRNA-NBs的脂质微泡的粒径和表面电位通过动态光散射法分别测得siRNA胶束和NBs及siRNA-NBs的粒径和表面电位(表 1)。siRNA胶束表面带正电,NBs表面带负电,NBs负载siRNA胶束后表面呈弱正电,且NBs负载siRNA胶束后粒径略增加约20~30 nm,提示NBs负载siRNA胶束后形成整体的复合物。
| 表 1 siRNA胶束、NBs和siRNA-NBs的粒径和表面电位 Table 1 Diameters and zeta potentials of siRNA micelles, NBs and siRNA-NBs (Mean±SD) |
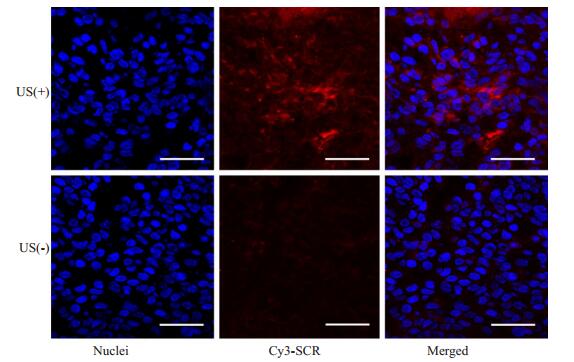
为观察siRNA-NBs在超声辐照后的siRNA瘤内递送能力,本研究用红色荧光染料Cy3标记SCR,并用激光共聚焦显微镜观察肿瘤冰冻切片的siRNA分布。结果如图 1所示,肿瘤细胞的细胞核呈蓝色荧光,Cy3标记的SCR呈红色荧光。US(+)组的肿瘤切片可见大量红色荧光,其分布集中于肿瘤细胞的胞浆,未见明显入核;而US(-)组的肿瘤组织只见少量红色荧光分布,且荧光强度明显低于US(+)组。结果提示siRNA-NBs在超声辐照下能有效地将siRNA递送到肿瘤组织内,其效能明显高于非超声辐照组。
|
图 1 激光共聚焦显微镜检测超声辐照US(+)组及非超声辐照US(-)组的siRNA递送效能 Figure 1 Efficiency of siRNA transfection in US (+) and US (-) groups detected by confocal laser scanning microscopy (Original magnification: × 600). Blue fluorescence: Nuclei stained with Hoechst 33342; Red fluorescence: Cy3-labeled SCR. Scale bar=20 μm. |
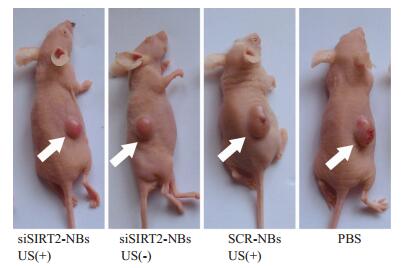
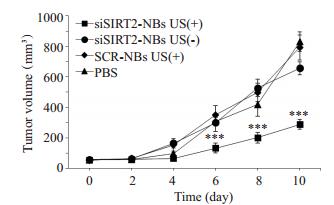
不同治疗组的肿瘤生长情况有明显区别:治疗10 d后,各组荷瘤鼠的肿瘤大小变化明显,siSIRT2-NBs US(+)组肿瘤体积明显小于其他组(图 2)。通过观察肿瘤生长曲线,提示siSIRT2-NBs US(+)组裸鼠的肿瘤生长速度明显低于无超声辐照的siSIRT2-NBs US(-)组、携阴性对照siRNA的SCR-NBs US(+)组及PBS组。从治疗后第4天开始,其肿瘤体积小于其他各组;而siSIRT2-NBs US(-)组、SCR-NBs US(+)组及PBS组的肿瘤生长速度无明显差异(图 3)。
|
图 2 siSIRT2-NBs联合低频超声辐照治疗10 d后的肿瘤抑制效果 Figure 2 Gross observation of tumor growth after 10 days of treatments with SIRT2-NBs under low-frequency US. The tumor volume in the siSIRT2-NBs US (+) group was much smaller than that in siSIRT2-NBs US (-) group, siSIRT2-NBs US (-) group and PBS group. White arrow indicate the xenograft tumors. |
|
图 3 实验动物的肿瘤生长曲线 Figure 3 Tumor growth curve after different treatments. ***P < 0.001 vs siSIRT2-NBs US (-), SCR-NBs US (+) and PBS groups. |
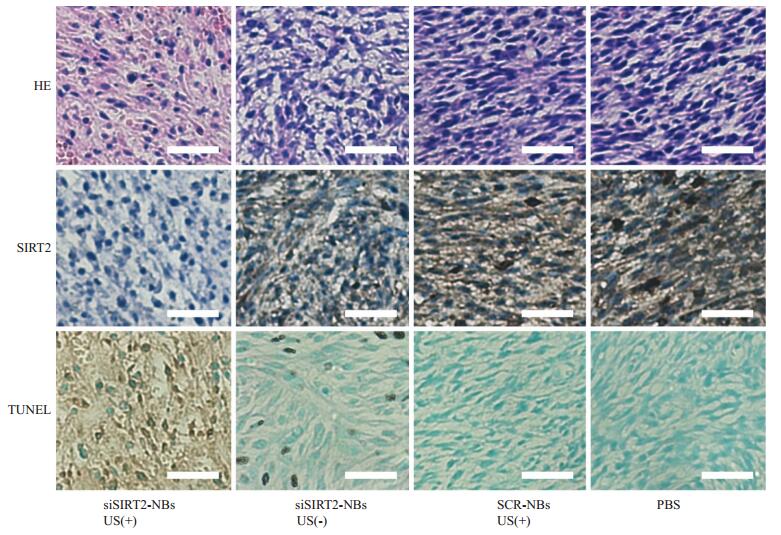
各组荷瘤裸鼠治疗10 d后处死,取肿瘤组织切片后行H & E染色、SIRT2免疫组化染色和TUNEL染色。H & E染色结果(图 4)提示siSIRT2-NBs US(+)组肿瘤组织的细胞核小、染色浅,核质比小;褐染色的SIRT2蛋白表达量少;可见多数细胞和染色质浓缩,破裂,肿瘤细胞凋亡明显。而siSIRT2-NBs US(-)组、SCR-NBs US(+)组及PBS组肿瘤细胞排列紊乱,核大深染,核质比大,异型性明显;褐色染色的SIRT2蛋白表达量大,肿瘤细胞凋亡不明显。
|
图 4 肿瘤组织病理学检测 Figure 4 HE staining, immunohistochemical staining and TUNEL assay of the tumor tissues in different growps (Original magnification: ×200). Scale bar=100 μm. |
实验动物在治疗第7天用SCR-NBs进行超声造影检查。结果(图 5)提示siSIRT2-NBs US(-)组、SCR-NBs US(+)组及PBS组静脉注射SCR-NBs后全瘤快速强化,增强均匀,个别体积较大肿瘤可见小片状无增强的坏死区。siSIRT2-NBs US(+)组肿瘤注射SCR-NBs强化较晚,肿瘤周边强化较明显,中心可见大片无增强区域;肿瘤增强程度明显较其他各组弱。
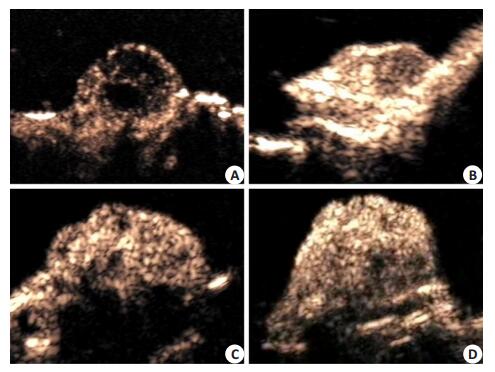
|
图 5 超声造影评价肿瘤治疗效果 Figure 5 Therapeutic effects evaluated by contrast-enhanced ultrasonography. A: siSIRT2-NBs US (+) group; B: siSIRT2-NBs US (-) group; C: SCR-NBs US (+) group; D: PBS group. |
恶性肿瘤是危害人类健康的重要疾病之一。随着肿瘤基础及临床研究中的不断深入,肿瘤的治疗效果有了一定的提高[6-7]。近年来,“精准医学”概念的提出,对恶性肿瘤个体化诊疗提出了新的要求[8]:在诊断方面,要求对恶性肿瘤进行早期、精确的分子水平影像学诊断,并对治疗过程中的病灶进行实时疗效评估,以便及时调整治疗方案;在治疗方面,要求对肿瘤打击更加精确,尽可能杀伤肿瘤的同时,最大程度地保护正常组织,改善预后、提高患者的生存质量。因此,临床上常规应用的肿瘤诊疗方式在新的要求下受到巨大的挑战。
基于上述要求,能同时对恶性肿瘤进行精准治疗及实时评估疗效的“诊疗试剂”将可能成为今后发展的方向。为同时实现肿瘤治疗与疗效评估,本研究在前期工作的基础上,利用异质性组装法在微泡表面负载针对抗肿瘤凋亡基因SIRT2的siRNA,制备成载SIRT2 siRNA的微泡超声造影剂。一方面利用UTMD技术实现siRNA的靶向递送和转染,另一方面在治疗同时用CEUS观察肿瘤血流灌注。故与常见的微泡超声造影剂相比,本课题研究的载siRNA微泡具有明显的多功能优势。
本实验中小干扰RNA所针对的基因SIRT2,在肿瘤细胞的代谢与衰老过程中起关键作用[9-11]。虽近期有学者质疑SIRT2在细胞坏死状凋亡中的重要性[12],但大量研究已证明其是肿瘤细胞能抗凋亡并持续存活的重要因素[13-15]。因此抑制SIRT2的表达可诱导肿瘤细胞的自然凋亡。
异质性组装法能明显降低阳离子siRNA胶束的表面电位。本研究中siRNA用两嵌段的阳离子聚合物包裹形成小粒径的正电荷siRNA胶束,表面电位较高(约+20 mV);当用负电荷微泡载siRNA胶束后,能有效屏蔽其表面电位,使最终载siRNA微泡的表面电位维持在弱正电水平(约+ 9 mV)。这种低表面电位的设计赋予载siRNA微泡多方面的好处:第一,由于可降解材料制备的纳米粒子所产生的细胞毒性主要来源于其表面正电荷[16],降低siRNA胶束的表面电位能有效降低其细胞毒性。第二,阳离子纳米粒子在血液循环中容易被网状-内皮系统的免疫细胞识别和捕获,低表面电位设计能有效延长其循环时间[17-18];第三,低表面电位能降低纳米粒子入胞效能。因此只有在超声辐照的条件下,载siRNA微泡才具有高效的转染能力,保证siRNA递送的高度靶向性。异质性组装法制备的载siRNA微泡在超声辐照下明显提高siRNA转染效能。在体实验结果表明在SIRT2 siRNA微泡在超声辐照下能将siRNA靶向递送到肿瘤部位,并有效沉默肿瘤抗凋亡的SIRT2基因,从而诱导肿瘤凋亡。推测其机制主要包括:第一,血管中的载siRNA微泡在低频超声辐照下,发生击破效应,进一步增加肿瘤血管内皮的通透性[19],有利于载siRNA微泡在肿瘤部位的聚集;第二,穿透肿瘤血管内皮的载siRNA微泡,在肿瘤细胞周围发生击破,细胞膜出现短暂的声孔,微泡所携带的siRNA胶束直接进入细胞,即“声孔效应” [20];第三,微泡被击破后,释放表面带正电荷的siRNA胶束。肿瘤细胞能通过胞吞作用摄取siRNA胶束,进一步提高siRNA的转染效能。
载siRNA微泡可实现对肿瘤治疗的实时疗效评估。由于本研究制备的载siRNA微泡是以脂质微泡为基础,故具有超声敏感性。在低机械指数的超声造影模式下,在体实验提示载siRNA微泡具有良好的超声显像效能。以载siRNA微泡为基础的CEUS具有实时、简便、可敏感地评价肿瘤微血流灌注等特点,而且可反复检查,有利于实现肿瘤治疗及疗效评估一体化,为恶性肿瘤治疗的疗效评估提供可靠的影像学依据。
综上所述,本研究利用异质性组装法制备能高效负载siRNA的脂质微泡超声造影剂,一方面在低频超声辐照下,能向肿瘤组织靶向递送siRNA沉默肿瘤抗凋亡基因;另一方面在低机械指数超声造影模式下,对疗效进行实时监测。该新型多功能超声造影剂的制备和应用为恶性肿瘤的基因治疗方式提供新的思路,并有利于实现治疗与疗效评估的一体化。
| [1] | 李鹏, 尚明美, 宋海峰. 非病毒基因递送技术研究进展[J]. 中国新药杂志,2008, 17 (10) : 809-14. |
| [2] | 陈智毅, 谢明星. 超声及超声造影剂介导基因转染和药物传输的研究进展[J]. 中华超声影像学杂志,2010, 19 (10) : 909-11. |
| [3] | 尹庭辉, 李景果, 郑荣琴, 等. 新型携siRNA微泡的制备及其体外转染Skov-3细胞能力的研究[J]. 中华超声影像学杂志,2013, 22 (10) : 901-4. |
| [4] | Liu Y, Miyoshi H, Nakamura M. Encapsulated ultrasound microbubbles: therapeutic application in drug/gene delivery[J]. J Control Release,2006, 114 (1) : 89-99. DOI: 10.1016/j.jconrel.2006.05.018. |
| [5] | Geis NA, Katus HA, Bekeredjian R. Microbubbles as a vehicle for gene and drug delivery: current clinical implications and future perspectives[J]. Curr Pharm Des,2012, 18 (15) : 2166-83. DOI: 10.2174/138161212800099946. |
| [6] | Dudley ME, Wunderlich JR, Robbins PF, et al. Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes[J]. Science,2002, 298 (5594) : 850-4. DOI: 10.1126/science.1076514. |
| [7] | Kirn D, Martuza RL, Zwiebel J. Replication-selective virotherapy for cancer: Biological principles, risk management and future directions[J]. Nat Med,2001, 7 (7) : 781-7. DOI: 10.1038/89901. |
| [8] | Mirnezami R, Nicholson J, Darzi A. Preparing for precision medicine[J]. N Engl J Med,2012, 366 (6) : 489-91. DOI: 10.1056/NEJMp1114866. |
| [9] | Dali-Youcef N, Lagouge M, Froelich S, et al. Sirtuins: the 'magnificent seven', function, metabolism and longevity[J]. Ann Med,2007, 39 (5) : 335-45. DOI: 10.1080/07853890701408194. |
| [10] | Houtkooper RH, Pirinen E, Auwerx J. Sirtuins as regulators of metabolism and healthspan[J]. Nat Rev Mol Cell Biol,2012, 13 (4) : 225-38. DOI: 10.1038/nrn3209. |
| [11] | Yu J, Auwerx J. The role of sirtuins in the control of metabolic homeostasis[J]. Ann N Y Acad Sci,2009, 1173 (Suppl 1) : E10-9. |
| [12] | Newton K, Hildebrand JM, Shen Z, et al. Is SIRT2 required for necroptosis[J]. Nature,2014, 506 (7489) : E4-6. DOI: 10.1038/nature13024. |
| [13] | He X, Nie H, Hong Y, et al. SIRT2 activity is required for the survival of C6 glioma cells[J]. Biochem Biophys Res Commun,2012, 417 (1) : 468-72. DOI: 10.1016/j.bbrc.2011.11.141. |
| [14] | Li Y, Matsumori H, Nakayama Y, et al. SIRT2 down-regulation in HeLa can induce p53 accumulation via p38 MAPK activationdependent p300 decrease, eventually leading to apoptosis[J]. Genes Cells,2011, 16 (1) : 34-45. DOI: 10.1111/j.1365-2443.2010.01460.x. |
| [15] | Nie H, Li Y, Wang C, et al. SIRT2 plays a key role in both cell cycle regulation and cell survival of BV2 microglia[J]. Int J Physiol Pathophysiol Pharmacol,2014, 6 (3) : 166-71. |
| [16] | Fröhlich E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles[J]. Int J Nanomedicine,2012, 7 : 5577-91. |
| [17] | Asati A, Santra S, Kaittanis C, et al. Surface-charge-dependent cell localization and cytotoxicity of Cerium oxide nanoparticles[J]. ACS Nano,2010, 4 (9) : 5321-31. DOI: 10.1021/nn100816s. |
| [18] | Yu B, Zhang Y, Zheng W, et al. Positive surface charge enhances selective cellular uptake and anticancer efficacy of Selenium nanoparticles[J]. Inorg Chem,2012, 51 (16) : 8956-63. DOI: 10.1021/ic301050v. |
| [19] | 汤庆, 徐辉雄, 吕明德, 等. 声学造影剂增强超声辐照对血管内皮细胞膜通透性作用的研究[J]. 中国超声医学杂志,2005, 21 (1) : 11-3. |
| [20] | 冯若. 超声空化与超声治疗[J]. 自然杂志,2003, 25 (6) : 311-4. |
 2015, Vol. 35
2015, Vol. 35