2. 南方医科大学 公共卫生与热带医学学院流行病学系,广东 广州 510515
2. Department of Epidemiology, School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China
肠道病毒71型(Enterovirus 71, EV71)是引起手足口病的主要病原体,可致神经系统疾病,包括无菌性脑膜炎、脑干脑炎、小脑脑炎、急性弛缓性瘫痪等[1, 2],导致患者终身瘫痪,甚至死亡,是继脊髓灰质炎病毒后最重要的嗜神经性肠道病毒。手足口病疫情暴发时,常有EV71感染引起手足口病重症和死亡的报道,对公共健康安全造成巨大的威胁[3-6]。虽然人们认识到EV71的致病性受多种因素影响,但在其致病机制方面还存在不少认识上的空白。EV71感染细胞后是在核内增殖还是在核外增殖?是首先导致细胞核损伤还是细胞质损伤?如果是损伤细胞质,那么其靶标是何种细胞器?机制又如何?这些问题的回答对于揭示EV71的致病机制有重要价值,有待明确。为此我们用从手足口病死亡病例标本中分离的EV71,通过接种Vero细胞,对上述问题进行了探讨。
1 材料与方法 1.1 细胞和病毒(1)Vero细胞:来自南方医科大学公共卫生与热带医学学院流行病学实验室;(2)EV71型病毒株:源自2008年一EV71感染手足口病死亡病例,序列号888/ GZ/CHN/2008 [4]。
1.2 病毒TCID50的测定消化Vero细胞,用DMEM完全培养基(含5%胎牛血清)调整细胞浓度为1×105个/mL,混匀后每孔0.1 mL,接种于96孔细胞培养板,置37 ℃、5% CO2培养箱中培养。待长满成单层后,每孔弃培养上清并用DMEM基础培养基将EV71病毒液10倍梯度依次稀释成10-1~10-10个浓度,每个稀释度设8孔,每孔接种0.1 mL,同时设不加病毒液的正常细胞作对照。37 ℃、5% CO2培养箱中孵育1 h,取出培养板并弃病毒液,加入维持液(含2%胎牛血清的DMEM培养基)0.1 mL继续在37 ℃、5%CO2培养箱中培养,每日在倒置显微镜下观察细胞病变(CPE),观察7~10 d,记录每个稀释度发生CPE的孔数。用Reed-Muench公式[7]计算病毒液的50%细胞感染剂量(median tissue culture infective dose, TCID50)。
| $ \begin{array}{l} {\rm{TCI}}{{\rm{D}}_{50}} = {\rm{CPE > 50\% 病毒稀释度 + }}\\ \frac{{CPE > 50\% 的百分数 - 50}}{{CPE > 50\% 的百分数 - CPE < 50\% 的百分数}} \times {\rm{IG}}10 \end{array} $ | (1) |
将1×105个/mL的Vero细胞接种于铺好玻片的六孔培养板中,置37 ℃、5% CO2培养箱中培养。待长满单层后,弃上清并将0.3 mL EV71病毒液接种于培养板中。培养箱中吸附1h后,弃病毒液并PBS液洗涤2遍,加维持液(含2%胎牛血清的DMEM培养基)3 mL继续在37 ℃、5% CO2培养箱中培养。对照组采用培养基代替病毒液。每日在倒置显微镜下观察CPE,当75%细胞出现病变时,弃维持液,PBS洗涤2遍;4%多聚甲醛固定30 min,PBS洗涤2遍。取出玻片,0.5% TritonX-100作用15 min以破膜,PBS洗涤后加正常山羊血清室温封闭30 min以抑制非特异反应。每张玻片滴加鼠源性EV71单克隆抗体(1:2000,Millipore公司,美国),室温孵育2h,另用PBS代替EV71抗体作对照。PBS洗涤后,加荧光标记山羊抗小鼠IgG(1:200,中杉金桥),暗盒中室温孵育1 h,PBS浸洗切片。滴加抗荧光淬灭封片剂(含DAPI),荧光显微镜下观察。
1.4 Vero细胞经EV71感染后的透射电镜观察接种Vero细胞于25 cm2培养瓶中,待细胞生长到培养瓶面积的80%,弃上清并加入0.5 mL EV71病毒液,于37 ℃、5% CO2培养箱吸附1h,PBS洗涤2遍以去除未吸附的病毒;加入1.5 mL维持液继续培养。当75%细胞出现病变时,用无菌刮子轻轻刮取细胞并用移液枪转移至1.5 mL的离心管中,1500 r/min,4 ℃离心10 min,弃上清,加预冷PBS温和洗涤1次,同上离心处理。弃上清并沿管壁缓慢加入预冷的2.5%的戊二醛0.5 mL,4 ℃固定2 h。常规电镜制样、超薄切片(50 nm)并透射电镜观察。
1.5 Vero细胞损伤的定量分析[8]在透射电镜100 000倍下,随机取10个视野,用Image-Pro Plus 6.0图像分析软件通过鼠标勾选每幅图像中的病毒颗粒及病毒增殖区(病毒颗粒聚集分布区域),测试病毒颗粒直径及病毒颗粒和病毒增殖区的面积;计数所有的线粒体及空泡化的线粒体并分别测试其面积[9]。有关计算公式如下:
(1)病毒颗粒面积密度(AAEV71)
| $ {{\rm{A}}_{{\rm{AEV71}}}} = \frac{{\sum\limits_{i = 1}^n {{A_{{\rm{EV71}}}}} }}{{\sum\limits_{i = 1}^n {{A_{PVi}}} }} $ | (2) |
式中,AEV71i表示被测胞质视野中第i个EV71病毒颗粒的面积,APVi表示被测胞质视野中第i个病毒增殖区的面积。
| $ {{\rm{A}}_{{\rm{EV71}}}} = \pi {{\rm{r}}^2} $ | (3) |
式中, AEV71表示胞质中EV71病毒颗粒的面积,r为病毒颗粒半径。
(2)空泡化线粒体面积密度(AAVM)
| $ {{\rm{A}}_{{\rm{AVM}}}} = \frac{{\sum\limits_{i = 1}^n {{A_{VMi}}} }}{{\sum\limits_{i = 1}^n {{A_{Mi}}} }} $ | (4) |
式中A VMi表示被测胞质视野中第i个空泡化线粒体的面积,AMi表示被测胞质视野中第i个线粒体(包括空泡化和非空泡化)的面积。
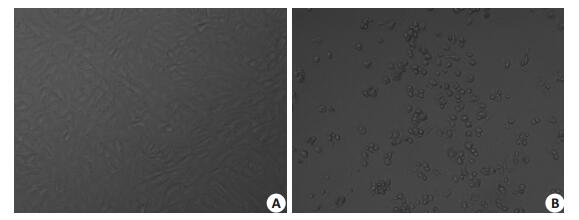
2 结果 2.1 TCID50检测结果用Reed-Muench公式计算该EV71临床分离株的TCID50,结果为10-5.81/0.1 mL,即将病毒悬液作105.81倍稀释后,每孔接种0.1 mL,可使50% Vero细胞孔发生病变。普通光学显微镜下观察,可见未接种EV71的Vero细胞呈梭形贴壁生长,胞质透明度好(图 1A)。EV71感染Vero细胞后,细胞变圆、皱缩,细胞间隙增大,随着感染时间的延长,病变细胞失去黏附性,脱落并漂浮于培养上清中(图 1B)。
|
图 1 Vero细胞经EV71感染后的光镜观察 Figure 1 Microscopical observation of EV71-infected Vero cells (Original magnification: ×20). A: Normal Vero cells; B: EV71-infected cells. |
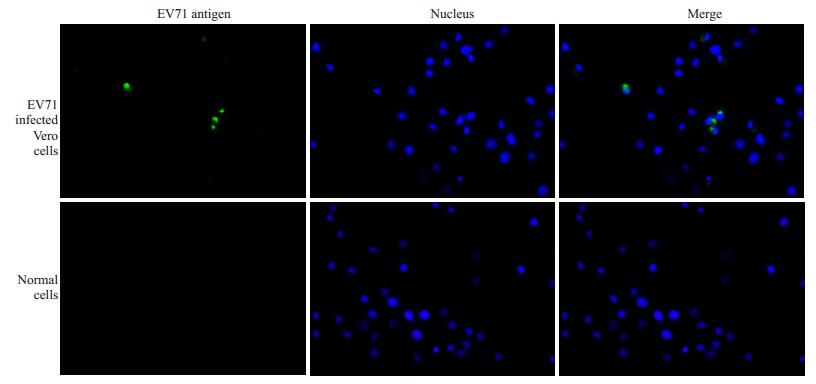
免疫荧光检测显示,Vero细胞感染EV71后,EV71抗原位于细胞质中,而不是在细胞核内,提示EV71定居在感染的Vero细胞胞质中(图 2)。
|
图 2 Vero细胞经EV71感染后EV71抗原免疫荧光检测 Figure 2 EV71 antigen detection by immunofluorescence in EV71-infected Vero cells (Original magnification: × 20). Blue immunofluorescence signals represented the nucleus of the Vero cells, and green signals the EV71 antigens. EV71 antigens were detected in the cytoplasm of the infected cells. |
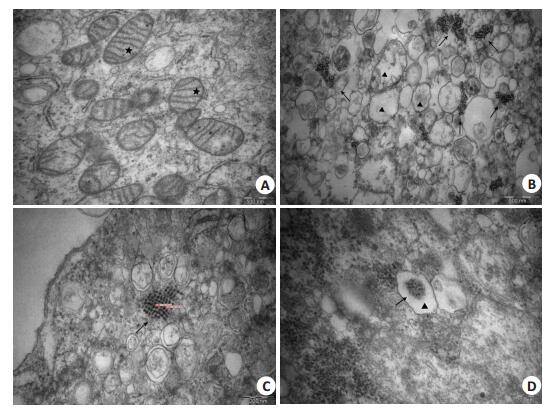
EV71感染Vero细胞后,定位在细胞质并增殖,在细胞器间可见大量呈团分布、晶格状排列、大小较一致的高电子密度病毒颗粒。病毒颗粒呈球状,粒子外无突起(图 3B、C)。对比未接种EV71的Vero细胞(图 3A),EV71感染的Vero细胞胞质中出现大量空泡,线粒体肿胀、变性并明显空泡化,线粒体嵴断裂、减少,线粒体内可见散在或游离的病毒颗粒(图 3B、C、D)。病变进一步发展,则可见细胞死亡,核消失,细胞膜也消失,呈现出大量微泡结构。
|
图 3 Vero细胞经EV71感染后的超微结构改变 Figure 3 Ultrastructural changes of EV71-infected Vero cells. A: Uninfected Vero cells. The asterisks indicate normal mitochondria with normal mitochondrial cristae and complete mitochondrial membrane (Original magnification: × 50 000). B, C: Large numbers of viral particles (arrows) in the cytoplasm of EV71-infected Vero cells. The diameter of the viral particles was 15-20 nm. Most of the mitochondria showed swelling, vacuoles and degeneration (▲). B:(×60 000), C:(×100 000). D: Viral particles (arrows) in degenerated mitochondria (▲) (× 100 000). |
病毒团块中EV71的直径为14.79~20.00(16.29±1.63)nm,变异系数为10%;EV71的面积密度为(38.3±9.79)%,变异系数为26%。空泡化线粒体占所有线粒体的比例及其面积密度测试结果显示,空泡化线粒体数量占全部线粒体数量的(90.90±8.88)%,变异系数为10%;空泡化线粒体面积密度为(89.21±10.36)%,变异系数为12%。
3 讨论EV71属小RNA病毒科肠道病毒属成员,是单股正链RNA病毒,为二十面体立体对称的球形结构,无包膜和突起,直径约为24~30 nm,由外层的衣壳和RNA核心构成[10]。Vero细胞是非洲绿猴肾细胞,繁殖快、营养要求低,易于培养,对多种病毒敏感,为EV71培养的宿主细胞[11]。本研究用分离自一手足口病死亡病例标本的EV71,接种于Vero细胞,观察Vero细胞感染后的形态学变化。
3.1 关于EV71在Vero细胞中的增殖部位及特点本研究超微结构显示EV71在Vero细胞胞质中增殖,为大小较一致的高电子密度颗粒,呈团块状分布、晶格状排列,面积密度为24.6%~53.1%,是病毒大量增殖的典型超微结构特点[12]。细胞核内未见病毒颗粒。
3.2 关于EV71病毒颗粒的大小及其制样收缩问题本研究观察测试结果显示EV71病毒颗粒通过常规透射电镜制样,其直径表现为14.79~20 nm,与文献报道的24~30 nm不同[13]。我们认为两者不矛盾,因为文献报道的结果为EV71非收缩状态下的大小。常规透射电镜制样过程中组织和细胞会收缩,如果我们按收缩系数为65%来计算,那么文献中报道的24~30 nm经收缩则为15.6~19.5 nm,与我们测得的数据基本吻合。这也提示EV71病毒颗粒在电镜制样过程中也会发生收缩,其收缩系数我们推测约为65%(60%~70%)。
3.3 关于胞质内EV71损伤的靶标本研究EV71感染Vero细胞后,线粒体损伤显著,明显空泡化,其内可见EV71,提示线粒体是EV71的损伤靶标,EV71可直接损伤线粒体。线粒体损伤表现为线粒体嵴崩解断裂,线粒体空泡化,空泡化线粒体的数量可占到71%~100%;面积密度由69%~100%不等。研究发现,EV71感染胶质瘤细胞,引起细胞内活性氧生成,线粒体跨膜电位下降,影响呼吸链电子传递,从而导致细胞产能障碍[14]。EV71感染能通过半胱氨酸天冬氨酸蛋白酶(caspases)依赖的细胞凋亡途径,致线粒体内存在的凋亡相关因子释放出来[15],也可通过诱导线粒体Ca2+内流,激活钙蛋白酶,促进线粒体内凋亡相关因子转移到宿主细胞核,导致细胞凋亡的发生[16]。但是,EV71是如何损伤线粒体的?其机制尚未认识清楚。本文根据超微结构的观察,首次提供了EV71可直接入侵宿主细胞线粒体造成线粒体结构损伤,导致细胞死亡的证据。
3.4 线粒体损伤对于EV71增殖的作用线粒体损伤对EV71的增殖有何影响呢?本文认为线粒体损伤后释放出的DNA,降解形成核苷酸后可为EV71增殖提供所需的基本原料,有助于EV71的增殖。
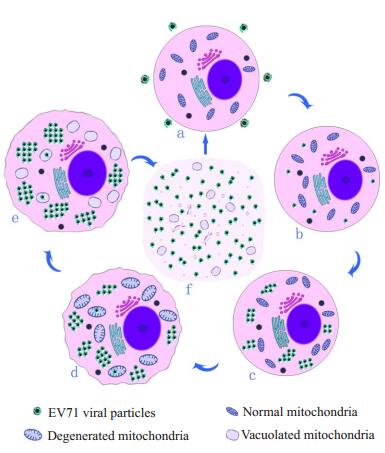
3.5 关于EV71对Vero细胞的感染、损伤作用及其增殖循环过程基于以上分析,我们提出EV71在Vero细胞中通过以下循环方式不断感染、增殖并损伤细胞的新机制。(1)EV71侵入Vero细胞;(2)EV71在Vero细胞胞质内增殖;(3)Vero细胞胞质内的EV71侵入线粒体并造成线粒体损伤,导致线粒体空泡化并崩解;(4)由于线粒体产能障碍,导致整个细胞功能障碍或丧失,细胞水肿并崩解死亡;此外,损伤的线粒体释放出的线粒体DNA,在胞质内降解成核苷酸,成为EV71增殖所需的基本原料,有助于EV71的进一步增殖;(5)死亡的Vero细胞崩解并释放出EV71,伺机感染新的宿主细胞或靶细胞。上述循环过程即是EV71的感染、增殖方式,也是其对Vero细胞的损伤方式及机制,本文将其概括为图 4。我们猜测EV71在Vero细胞中的上述循环、增殖过程及对Vero细胞的损伤作用和机制或许同样存在于机体组织中。
|
图 4 EV71对Vero细胞的感染、损伤作用及其增殖循环过程 Figure 4 The process of infection, damage and proliferation of EV71 in Vero cells. a. EV71 was around the cell; b. EV71 invaded the cell; c. EV71 proliferated in the cytoplasm; d. EV71 invaded the mitochondria, leading to the degeneration; e. EV71 proliferated and the mitochondria presented vacuole; f. The infected cells progressed to disruption and released the viral particles. |
虽然我们观察到EV71可感染Vero细胞并损伤其线粒体,但是EV71是如何侵入细胞的?是通过受体途径、细胞的吞噬作用还是简单弥散方式得以进入细胞?EV71又是如何侵入并损伤线粒体的?EV71除了对线粒体有直接损伤作用外,是否还具有间接损伤作用?这些问题还有待进一步研究。
| [1] | Huang CC, Liu CC, Chang YC, et al. Neurologic complications in children with enterovirus 71 infection[J]. N Engl J Med,1999, 341 (13) : 936-42. DOI: 10.1056/NEJM199909233411302. |
| [2] | Mcminn PC. An overview of the evolution of enterovirus 71 and its clinical and public health significance[J]. FEMS Microbiol Rev,2002, 26 (1) : 91-107. DOI: 10.1111/j.1574-6976.2002.tb00601.x. |
| [3] | 高璐璐, 陈清, 钟小祝, 等. 广州市某定点医院2008年5~12月手足口病收治状况及病原学研究[J]. 南方医科大学学报,2010, 30 (6) : 1333-5. |
| [4] | Gao L, Lin P, Liu S, et al. Pathological examinations of an enterovirus 71 infection: an autopsy case[J]. Int J Clin Exp Pathol,2014, 7 (8) : 5236-41. |
| [5] | Chen JF, Zhang RS, Ou XH, et al. The role of enterovirus 71 and coxsackievirus A strains in a large outbreak of hand, foot, and mouth disease in 2012 in Changsha, China[J]. Int J Infect Dis,2014, 28 : 17-25. DOI: 10.1016/j.ijid.2014.07.024. |
| [6] | Zhang YC, Jiang SW, Gu WZ, et al. Clinicopathologic features and molecular analysis of enterovirus 71 infection: report of an autopsy case from the epidemic of hand, foot and mouth disease in China[J]. Pathol Int,2012, 62 (8) : 565-70. DOI: 10.1111/pin.2012.62.issue-8. |
| [7] | Reed LJ, Munch H. A simple method of estimating fifty percent endpoints[J]. Am J Hyg,1938, 7 : 493-7. |
| [8] | 申洪, 沈忠英. 实用生物体视学技术[M]. 广州: 中山大学出版社, 1991 : 64 -89. |
| [9] | 吴正蓉, 申洪. 大肠肿瘤组织线粒体形态结构定量研究[J]. 世界华人消化杂志,2003, 09 (9) : 1372-4. |
| [10] | Wang XX, Peng W, Ren JS, et al. A sensor-adaptor mechanism for enterovirus uncoating from structures of EV71[J]. Nat Struct Mol Biol,2012, 19 (4) : 424-9. DOI: 10.1038/nsmb.2255. |
| [11] | Yin YX, Xu Y, Ou ZY, et al. A simple and highly repeatable viral plaque assay for enterovirus 71[J]. J Basic Microbiol,2015, 55 (4) : 538-41. DOI: 10.1002/jobm.v55.4. |
| [12] | 张景强. 病毒的电子显微镜研究[M]. 北京: 科学出版社, 2011 : 31 -6. |
| [13] | Liu CC, Guo MS, Lin FH, et al. Purification and characterization of enterovirus 71 viral particles produced from vero cells grown in a serum-free microcarrier bioreactor system[J]. PLoS One,2011, 6 (5) : e20005. DOI: 10.1371/journal.pone.0020005. |
| [14] | Cheng ML, Weng SF, Kuo CH, et al. Enterovirus 71 induces mitochondrial reactive Oxygen species Generation that is required for efficient replication[J]. PLoS One,2014, 9 (11) : e113234. DOI: 10.1371/journal.pone.0113234. |
| [15] | Shi W, Li X, Hou X, et al. Differential apoptosis gene expressions of rhabdomyosarcoma cells in response to enterovirus 71 infection[J]. BMC Infect Dis,2012, 12 : 327. DOI: 10.1186/1471-2334-12-327. |
| [16] | Lu JR, Lu WW, Lai JZ, et al. Calcium flux and calpain-mediated activation of the apoptosis-inducing factor contribute to enterovirus 71-induced apoptosis[J]. J Gen Virol,2013, 94 (Pt 7) : 1477-85. |
 2015, Vol. 35
2015, Vol. 35