2. 天津中医药大学第一附属医院麻醉科,天津 300073
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin, 300073, China
研究表明,全身麻醉药物可影响肿瘤的生长和转移[1]。目前临床普遍应用的静脉麻醉药丙泊酚,可显著增加细胞毒性T淋巴细胞的活性,具有抗肿瘤免疫作用[2];还可作为H460肿瘤细胞内质网应激和JNK信号通路的正向调节因子,抑制细胞的增殖、诱导其凋亡[3],亦可抑制肺癌、卵巢癌、前列腺癌、骨肉瘤等多种肿瘤细胞的侵袭和转移[3-6],显示丙泊酚具有抗肿瘤作用。上皮型钙粘蛋(E-cadherin)与其胞内域相连接的β-连环蛋白(β-catenin)构成的E-钙粘蛋白-连环蛋白复合体(E-cadherin/catenin),是细胞间粘附分子的重要部分,在抑制肿瘤的侵袭和转移过程中发挥重要的作用[7-9]。我们前期研究发现,丙泊酚可抑制MADB106肿瘤细胞的肺转移,并下调转移瘤中MTA1和Wnt1的表达[10],表明丙泊酚可能通过Wnt通路抑制肿瘤的转移及增殖。为进一步探讨丙泊酚对肿瘤转移的作用及机制,本研究通过MADB106肿瘤细胞肺转移大鼠模型,观察不同剂量丙泊酚对肿瘤肺转移及转移瘤组织E-cadherin和β-catenin表达的影响。
1 材料和方法 1.1 实验动物、药品和试剂清洁级Fischer344雄性大鼠,12~14周龄,体质量200~220 g(北京维通利华实验动物技术有限公司提供)。
鼠抗人E-cadherin单克隆抗体(即用型),鼠抗人β-catenin单克隆抗体(即用型)均购自proteintech-武汉三鹰生物技术有限公司;丙泊酚(英国阿斯利康公司,200 mg/20 mL,批号JK222)。
1.2 肿瘤细胞培养MADB106肿瘤细胞系(武汉大学中国典型培养物保藏中心提供),MADB106是大鼠乳腺腺癌细胞系的一种选择性变异,经静脉注入Fischer344大鼠循环系统后,只高选择性地种植转移在大鼠肺部。MADB106细胞在RPMI 1640培养液(1640基础培养基90%,FBS 10%,双抗0.1%)中培养,放于37 ℃,100%湿度和5% CO2的培养箱中培养,并通过使用0.25%胰蛋白酶消化后传代培养。
1.3 动物分组40只大鼠随机分为4组:生理盐水组(S组);脂肪乳剂组(F组);丙泊酚30 mg/kg组(P1组);丙泊酚50 mg/kg组(P2组),每组10只。1%戊巴比妥钠50 mg/kg腹腔注射后行股静脉置管,经大鼠股静脉持续泵入等容量生理盐水,脂肪乳剂和丙泊酚,维持鼠肛温在36~37 ℃,呼吸频率约为60次/min,心率320~340次/min左右;给药1 h后经大鼠经股静脉注入0.5 mL MADB106肿瘤细胞(2×105个),拔除股静脉置管,缝合切口,在SPF级环境中饲养3周。
1.4 指标检测 1.4.1 计数肺转移瘤的数量大鼠饲养3周后处死,切除肺肿瘤组织,置于4%中性福尔马林固定24 h,再经70%的酒精脱洗后,计数肺转移瘤的结节数,计算肺表面结节转移抑制率:转移抑制率(%)=(1-用药组平均转移结节数/对照组平均转移结节数)×100%。之后常规石蜡包埋,4 μm连续切片作免疫组化标记。
1.4.2 结果判定β-catenin与E-cadherin在正常肺组织,定位于细胞膜,免疫组化阳性反应为棕黄色或黄色细颗粒状着色。肺转移瘤组织中则主要表现出不同程度的细胞质和或细胞核显色,而细胞膜的显色减少,免疫组化阳性反应为棕黄色或黄色细颗粒状。光镜10× 40倍下,于细支气管或肺泡上皮阳性染色处随机选择5个视野,用Olympus DP70CCD采集图像。采用Image-pro plus 10.0免疫组化彩色图像分析系统对结果进行半定量分析,以图片中一个阳性细胞为基础,测定、分析整幅图片的阳性细胞平均光密度(OD)值。
1.5 统计学处理统计学分析采SPSS 13.0统计软件,计量资料,β-catenin和E-cadherin和在各组间的表达以均数±标准差表示,组间比较采用单因素方差分析,相关性分析采用Pearson法,以P < 0.05认为具有统计学意义。
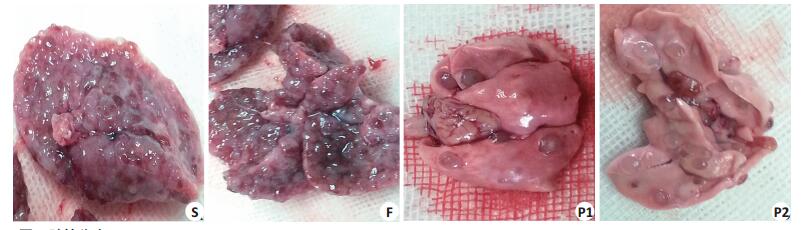
2 结果 2.1 肺转移瘤数目及转移抑制率S组与F组相比,肺转移瘤数目无显著差异(P > 0.05);与S组相比,P1组和P2组肺转移瘤数目减少(P < 0.01),转移抑制率增加(P < 0.01)。F组、P1组和P2组肺表面结节转移抑制率分别为9.63%,48.15%,68.89%,P2组明显高于F组(P < 0.05)。肺转移瘤个数与丙泊酚剂量负相关,Pearson相关系数为-0.879(P < 0.01,表 1,图 1)。
| 表 1 丙泊酚对肺转移瘤的影响 Table 1 Effects of propofol on pulmonary metastatic tumor (n=10) |
|
图 1 肺转移瘤 Figure 1 Expression of E-cadherin and β-catenin in pulmonary metastasis tumor (Mean±SD, n=10) |
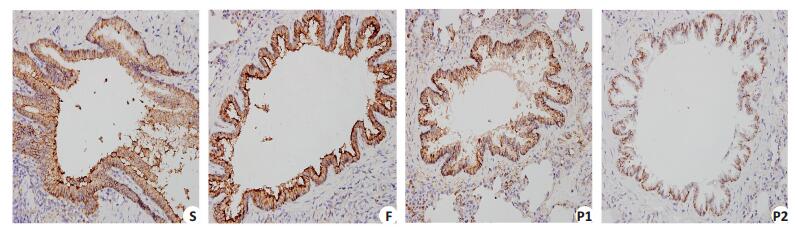
β-catenin的表达,S组和F组肿瘤组织染色深,数量多,平均光密度值的差异无统计学意义,两组β-catenin的表达无显著差异(P > 0.05);与S组相比,P1组和P2组中的肿瘤组织染色浅,数量少,平均光密度值减少,β-catenin蛋白表达减少,差异有统计学意义(P < 0.05);P2组和P1组相比,肿瘤组织染色浅,数量少,平均光密度值减少,β-catenin蛋白表达减少,差异有统计学意义(P < 0.05)。β-catenin的表达与丙泊酚剂量负相关,Pearson相关系数为-0.693(P < 0.01,表 2,图 2)。
| 表 2 肺转移瘤E-cadherin及β-catenin的表达 Table 2 Expression of E-cadherin and β-catenin in pulmonary metastasis tumor (Mean±SD, n=10) |
|
图 2 大鼠肺转移瘤组织中β-catenin的表达 Figure 2 Immunohistochemical staining of β-catenin in the metastatic tumor tissue (SP, original magnification: ×400). S: Normal saline; F: Intralipid; P1: 30 mg/kg propofol; P2: 50 mg/kg propofol. |
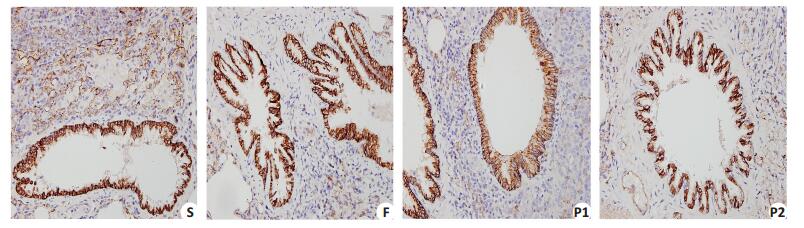
E-cadherin的表达,S组和F组肿瘤组织染色深,数量多,平均光密度值的差异无统计学意义,两组E-cadherin的表达无显著差异(P > 0.05);与S组相比,P1组和P2组中的肿瘤组织染色浅,数量少,平均光密度值减少,E-cadhrin蛋白表达减少,差异有统计学意义(P < 0.05);P2组和P1组相比,肿瘤组织染色浅,数量少,平均光密度值减少,E-cadherin蛋白表达减少,差异有统计学意义(P < 0.05)。E-cadherin的表达与丙泊酚剂量负相关,Pearson相关系数分别为-0.755(P < 0.01,表 2,图 3)。
|
图 3 大鼠肺转移瘤组织中E-cadherin的表达 Figure 3 Immunohistochemical results of E-cadherin in the metastatic tumor tissue (SP, original magnification: × 400). S: Normal saline; F: Intralipid; P1: 30 mg/kg propofol; P2: 50 mg/kg propofol. |
静脉麻醉药丙泊酚,在临床麻醉和重症监护病房应用广泛。Wu KC等[11]发现丙泊酚可以抑制肿瘤细胞的增殖。动物实验显示,连续4周每天腹腔给予丙泊酚40 mg/kg,可抑制小鼠肿瘤细胞的侵袭能力而减少肺转移结节数[12]。临床相关浓度的丙泊酚(1~5 μg/mL)能降低人肿瘤细胞的转移潜能;20~40 mg/(kg·d)持续输注丙泊酚可以抑制小鼠骨肉瘤的肺转移[12]。本研究表明,丙泊酚可抑制MADB106肿瘤细胞肺转移,显示丙泊酚具有不同程度的抗肿瘤作用,但丙泊酚对不同肿瘤细胞的作用及机制可能有所不同。丙泊酚可抑制Slug的表达来抑制卵巢癌细胞的侵袭和转移[13];通过HIF-1α途径抑制前列腺癌的细胞增值扩撒和迁移[5];可抑制乳腺癌细胞中NF-κB通路而降低MMP表达水平,从而抑制乳腺癌细胞的转移能力[14]。丙泊酚还可以增加T细胞的活性[2],促进T细胞诱导协同刺激分子的表达[15],增加细胞免疫作用来达到抗肿瘤增效应,而其抗肿瘤的机制有待进一步研究。
研究表明[8, 9, 16],作为Wnt/β-catenin通路的关键蛋白分子,E-cadherin与其胞内域相连接的β-catenin构成的E-钙粘蛋白-连环蛋白复合体,在抑制肿瘤的侵袭转移过程中发挥着极其重要的作用。在没有Wnt信号刺激的情况下,β-catenin与GSK-3组成的降解复合物结合,通过磷酸化,泛蛋白化等过程发生降解,使胞质β-catenin保持在较低水平[17]。但当Wnt途径异常激活时,就可能使细胞发生异常的增生和分化,导致肿瘤形成。而E-cadherin的抑癌作用主要是通过与β-catenin形成复合体介导同质细胞之间的相互粘附,抑制肿瘤细胞的迁移和侵袭性;同时E-cadherin竞争性的和β-catenin结合,降低细胞内游离型β-连环蛋白水平,从而抑制其参与Wnt信号通路细胞增殖基因的表达[8]。进一步研究发现,β-catenin的表达与肿瘤的转移密切相关[18],并且β-catenin的表达随着细胞转移能力的增强而逐渐增加[19],它与肿瘤组织的低分化以及淋巴结转移以及人类多种肿瘤转移都有密切的关系,如乳腺癌[20],胃癌[21],肺癌[22]。迄今为止,丙泊酚的抗肿瘤作用及其与E-cadherin和β-catenin的关系,未见报道。
本实验通过MADB106细胞的大鼠肺转移模型,在体观察了丙泊酚对肿瘤肺转移及转移瘤组织中E-cadherin和β-catenin的影响。结果发现,丙泊酚30 mg/kg组和50 mg/kg组与生理盐水组和脂肪乳剂组相比,肺转移瘤数、E-cadherin及β-catenin蛋白的表达均明显减少,与丙泊酚剂量负相关,表明丙泊酚可呈剂量依赖性地下调肺转移瘤组织中E-cadherin和β-catenin的表达,抑制MADB106肿瘤细胞肺转移。敲除β-catenin后不仅抑制了肺腺癌A549细胞的Wnt/β-catenin信号转导通路,而且能抑制肺癌细胞的增殖、克隆形成及侵袭转移能力[23]。研究表明[24],吲哚美辛成浓度和时间依赖性地增加结肠癌细胞内E-钙粘蛋白的表达,并使β-连环蛋白从细胞浆和细胞核内转位到细胞膜上,增强细胞之间的粘附作用,提示可以通过纠正E-钙粘蛋白和β-连环蛋白的表达和分布异常以增强细胞之间粘附作用的途径来降低肿瘤细胞的侵袭转移潜能。通过干扰A549细胞中β-catenin的表达,可抑制细胞增长、克隆形成、迁移及耐药性,肺癌干细胞标志物OCT-4的基因及蛋白表达均降低;同时用GSK-3β的抑制剂作用于A549细胞,β-catenin表达增加并出现核转移,增殖活性、克隆形成能力、OCT-4表达均增强[25]。以上研究均说明,抑制肿瘤组织E-cadherin和β-catenin的表达,可减少肿瘤组织的转移能力。
Wnt/β-catenin信号通路的异常激活与人类多种肿瘤和疾病相关。研究发现,Wnt/β-catenin信号通路是乳腺癌干细胞增殖转移的重要环节[26],同时信号通路的开放与肺癌和乳腺癌骨破坏有关[27];三人参皂苷衍生物可抑制Wnt/β-catenin通路,抑制肺癌细胞增殖[28];大麻素亦可通过抑制Wnt/β-catenin通路,抑制乳腺癌细胞的上皮间质转化过程,减弱其侵袭能力[29]。我们前期研究也发现,丙泊酚呈剂量的抑制MADB106肿瘤细胞的肺转移,并下调转移瘤中MTA1和Wnt1的表达[10]。而Wnt1是Wnt/β-catenin的启动蛋白,可见阻断或抑制Wnt/β-catenin通路,可抑制肿瘤细胞的转移能力。本实验的结果也佐证了这一点,即丙泊酚可以通过抑制Wnt/β-catenin通路,使其胞内游离型β-catenin保持在较低水平,以抑制其参与Wnt/β-catenin信号通路细胞增殖基因的表达,从而抑制了MADB106细胞肺转移。临床研究也已证实,E-cadherin的异常表达可以作为肺癌侵袭转移和不良预后的一个独立指标,β连环蛋白异常表达者生存期短[30]、和不良预后密切相关[31-34]。因此以Wnt/β-catenin信号转导途径为靶点,抑制此通路在转移性肺癌中的活化及其靶基因的表达,有望成为转移性肺癌分子靶向治疗的新靶点。
综上所述,丙泊酚可通过抑制Wnt/β-catenin通路,下调转移瘤组织中E-cadherin和β-catenin的表达,从而抑制MADB106细胞的肿瘤转移。而丙泊酚对E-钙粘蛋白复合体的表达和调控涉及到多种机制,直接影响到其对肿瘤细胞的生物学作用,但这种复杂的调节机制还不甚清楚,有待进一步研究。
| [1] | 黄翔, 杨承祥, 梁桦. 麻醉药物对肿瘤影响的研究新进展[J]. 医学综述,2012, 18 (16) : 2629-31. |
| [2] | Kushida A, Inada T, Shingu K. Enhancement of antitumor immunity after propofol treatment in mice[J]. Immunopharmacol Immunotoxicol,2007, 29 (3/4) : 477-86. |
| [3] | Cui WY, Liu Y, Zhu YQ, et al. Propofol induces endoplasmic reticulum (ER) stress and apoptosis in lung cancer cell H460[J]. Tumour Biol,2014, 35 (6) : 5213-7. DOI: 10.1007/s13277-014-1677-7. |
| [4] | Su ZK, Wen Q. P.. propofol induces apoptosis of epithelial ovarian cancer cells by upregulation of microRNA let-7i expression[J]. Eur J Gynaecol Oncol,2014, 35 (6) : 688-91. |
| [5] | Huang H, Benzonana LL, Zhao H, et al. Prostate cancer cell malignancy via modulation of HIF-1α pathway with isoflurane and propofol alone and in combination[J]. Br J Cancer,2014, 111 (7) : 1338-49. DOI: 10.1038/bjc.2014.426. |
| [6] | Ye Z, Jingzhong L, Yangbo L, et al. Propofol inhibits proliferation and invasion of osteosarcoma cells by regulation of microRNA-143 expression[J]. Oncol Res,2013, 21 (4) : 201-7. |
| [7] | 王洪涛, 周清华. E-钙粘蛋白复合体与肺癌的侵袭转移[J]. 中国肺癌杂志,2010, 13 (3) : 254-9. |
| [8] | Gottardi CJ, gumbiner B.M. e-cadherin suppresses cellular transformation by inhibiting beta-catenin signaling in an adhesion-independent manner[J]. J Cell Biol,2001, 153 (5) : 1049-60. DOI: 10.1083/jcb.153.5.1049. |
| [9] | Solanas G, Porta-De-La-Riva M, Agustí C, et al. E-cadherin controls beta-catenin and NF-kappaB transcriptional activity in mesenchymal gene expression[J]. J Cell Sci,2008, 121 (Pt 13) : 2224-34. |
| [10] | 张雅静, 林春水, 等. 丙泊酚对荷瘤大鼠肿瘤肺转移及MTA1和Wnt1表达的影响[J]. 南方医科大学学报,2014 (7) : 1011-5. |
| [11] | Wu KC, Yang ST, Hsia TC, et al. Suppression of cell invasion and migration by propofol are involved in down-regulating matrix metalloproteinase-2 and p38 MAPK signaling in A549 human lung adenocarcinoma epithelial cells[J]. Anticancer Res,2012, 32 (11) : 4833-42. |
| [12] | Mammoto T, Mukai M, Mammoto A, et al. Intravenous anesthetic, propofol inhibits invasion of cancer cells[J]. Cancer Lett,2002, 184 (2) : 165-70. DOI: 10.1016/S0304-3835(02)00210-0. |
| [13] | Wang P, Chen J, Mu LH, et al. Propofol inhibits invasion and enhances paclitaxel-induced apoptosis in ovarian cancer cells through the suppression of the transcription factor slug[J]. Eur Rev Med Pharmacol Sci,2013, 17 (13) : 1722-9. |
| [14] | Li Q, Zhang L, Han Y, et al. Propofol reduces MMPs expression by inhibiting NF-κB activity in human MDA-MB-231 cells[J]. Biomedicine & Pharmacotherapy,2012, 66 (1) : 52-6. |
| [15] | 林长赋, 潘英丽, 丁锦屏, 等. 丙泊酚对肺癌根治术患者T淋巴细胞可诱导协同刺激分子的影响[J]. 临床麻醉学杂志,2010, 26 (4) : 284-6. |
| [16] | Kam Y, Quaranta V. Cadherin-bound beta-catenin feeds into the Wnt pathway upon adherens junctions dissociation: evidence for an intersection between beta-catenin pools[J]. PLoS One,2009, 4 (2) : e4580. DOI: 10.1371/journal.pone.0004580. |
| [17] | 王新颖, 王菁, 龚伟, 等. 磷酸化GSK-3β, c-myc与大肠侧向发育型肿瘤关系的研究[J]. 广东医学,2010, 31 (15) : 1973-5. |
| [18] | Chen CH, Chuang SM, Yang MF, et al. A novel function of YWHAZ/β-catenin axis in promoting epithelial-mesenchymal transition and lung cancer metastasis[J]. Mol Cancer Res,2012, 10 (10) : 1319-31. DOI: 10.1158/1541-7786.MCR-12-0189. |
| [19] | Li ZL, Shao SH, Jiao F, et al. Cyclin D1 regulates lung cancer invasion and metastasis[J]. Sheng Li Xue Bao,2012, 64 (1) : 55-61. |
| [20] | Cheng CW, Liu YF, Yu JC, et al. Prognostic significance of cyclin D1, β-catenin, and MTA1 in patients with invasive ductal carcinoma of the breast[J]. Ann Surg Oncol,2012, 19 (13) : 4129-39. DOI: 10.1245/s10434-012-2541-x. |
| [21] | Kim MY, Lim SC. roles of cyclin-dependent kinase 8 and betacatenin in the oncogenesis and progression of gastric adenocarcinoma[J]. Int J Oncol,2011, 38 (5) : 1375-83. |
| [22] | Chiu CG, Chan SK, Fang ZA, et al. Beta-catenin expression is prognostic of improved non-small cell lung cancer survival[J]. Am J Surg,2012, 203 (5) : 654-9. DOI: 10.1016/j.amjsurg.2012.01.002. |
| [23] | 滕颖, 王秀问, 王亚伟, 等. 小干扰RNA干扰β连环素表达对肺腺癌A549细胞Wnt信号通路的作用[J]. 中华医学杂志,2010, 90 (14) : 988-92. |
| [24] | Kapitanović S, Cacev T, Antica M, et al. Effect of indomethacin on E-cadherin and beta-catenin expression in HT-29 colon cancer cells[J]. Exp Mol Pathol,2006, 80 (1) : 91-6. DOI: 10.1016/j.yexmp.2005.04.008. |
| [25] | Teng Y, Wang X, Wang Y, et al. Wnt/beta-catenin signaling regulates cancer stem cells in lung cancer A549 cells[J]. Biochem Biophys Res Commun,2010, 392 (3) : 373-9. DOI: 10.1016/j.bbrc.2010.01.028. |
| [26] | Malanchi I, Santamaria-Martínez A, Susanto E, et al. Interactions between cancer stem cells and their niche govern metastatic colonization[J]. Nature,2012, 481 (7379) : 85-9. |
| [27] | Johnson RW, Merkel AR, Page JM, et al. Wnt signaling induces gene expression of factors associated with bone destruction in lung and breast cancer[J]. Clin Exp Metastasis,2014, 31 (8) : 945-59. DOI: 10.1007/s10585-014-9682-1. |
| [28] | Bi X, Xia X, Mou T, et al. Anti-tumor activity of three ginsenoside derivatives in lung cancer is associated with Wnt/β-catenin signaling inhibition[J]. Eur J Pharmacol,2014, 742 (5) : 145-52. |
| [29] | Laezza C, D'alessandro A, Paladino S, et al. Anandamide inhibits the Wnt/β-catenin signalling pathway in human breast cancer MDA MB 231 cells[J]. Eur J Cancer,2012, 48 (16) : 3112-22. DOI: 10.1016/j.ejca.2012.02.062. |
| [30] | Nozawa N, Hashimoto S, Nakashima Y, et al. Immunohistochemical alpha-and beta-catenin and E-cadherin expression and their clinicopathological significance in human lung adenocarcinoma[J]. Pathol Res Pract,2006, 202 (9) : 639-50. DOI: 10.1016/j.prp.2006.03.007. |
| [31] | Xu HT, Wang L, Lin D, et al. Abnormal beta-catenin and reduced axin expression are associated with poor differentiation and progression in non-small cell lung cancer[J]. Am J Clin Pathol,2006, 125 (4) : 534-41. DOI: 10.1309/0MDY02KHEW1F6RT6. |
| [32] | Choi YS, Shim YM, Kim SH, et al. Prognostic significance of E-cadherin and beta-catenin in resected stage I non-small cell lung cancer[J]. Eur J Cardiothorac Surg,2003, 24 (3) : 441-9. DOI: 10.1016/S1010-7940(03)00308-7. |
| [33] | Retera JM, Leers MP, Sulzer MA, et al. The expression of betacatenin in non-small-cell lung cancer: a clinicopathological study[J]. J Clin Pathol,1998, 51 (12) : 891-4. DOI: 10.1136/jcp.51.12.891. |
| [34] | Salon C, Moro D, Lantuejoul S, et al. E-cadherin-beta-catenin adhesion complex in neuroendocrine tumors of the lung: a suggested role upon local invasion and metastasis[J]. Hum Pathol,2004, 35 (9) : 1148-55. DOI: 10.1016/j.humpath.2004.04.015. |
 2015, Vol. 35
2015, Vol. 35
