2. 福建医科大学省立临床学院,福建 福州 350001
2. Provincial Clinical Institute of Fujian Medical University, Fuzhou 350001, China
妊娠是一种独特的实现母胎同种异体共存而不发生排斥反应的免疫状态[1]。人体的固有免疫系统在适应妊娠、胚胎流产以及病理妊娠的发生中扮演着重要角色[2-3]。孕酮诱导封闭因子(PIBF)介导的妊娠免疫耐受是孕激素维持适宜的母胎免疫耐受的重要途径之一。其与胎儿丢失的相关性已被多项研究证实,例如Wu等[4]发现早孕期蜕膜和滋养细胞PIBF的低表达与复发性流产相关,Beta等[5]孕期监测发现11~13周血清PIBF水平与34周前的自发性早产相关。流产早产和子痫前期(PE)都与早期胎盘形成不良、滋养细胞侵袭力异常相关。子痫前期被公认为是典型的胎盘源性疾病,但其病因学及病理生理机制在产科领域一直存在争议。本研究拟通过PIBF在重度子痫前期胎盘及外周血的表达情况及其与临床指标之间的关联,探讨其在母胎界面介导的Th1/Th2免疫细胞失衡参与子痫前期发病的可能性,丰富子痫前期的发病机制理论,为子痫前期的治疗及管理提供理论依据。
1 资料与方法 1.1 一般资料本次研究选取2012年1月~2012年12月在福建省立医院产科住院分娩产妇72例,其中早发型重度子痫前期组(EOPE)25例,晚发型重度子痫前期组(LOPE)22例,对照组25例。重度子痫前期诊断参考第23版《Williams Obstetrics》的诊断标准,发病 < 34周为早发型重度子痫前期,≥34周为晚发型重度子痫前期。纳入标准:(1)病例组选取重度子痫前期剖宫产结束分娩患者;(2)对照组选取足月妊娠因社会因素、胎位异常(如臀位、横位)剖宫产分娩孕妇。排除标准:(1)胎膜早破、宫内感染;(2)妊娠合并慢性高血压;(3)系统性红斑狼疮,糖尿病,恶性肿瘤;(4)肝炎、结核等传染病史;(5)多胎妊娠(≥2胎);(6)烟酒等不良嗜好。
1.2 实验方法 1.2.1 一般资料收集孕妇年龄、孕次、产次、发病孕周、入院时血压、24 h尿蛋白定量等临床资料。
1.2.2 外周血采集入院时抽取肘静脉血液3 mL,血液自然凝固后,以1000 r/min×5 min离心,取上清,置于-80 ℃冰箱保存。
1.2.3 胎盘采集剖宫产娩出胎盘后在直视下剪取胎盘母体面中央1.0 cm×1.0 cm×1.0 cm大小无钙化、无机化的胎盘组织,10%甲醛固定24 h,石蜡包埋制成蜡块。
1.2.4 PIBF含量采用PIBF ELISA试剂盒检测孕妇血清中的PIBF含量。
1.2.5 胎盘免疫组化及光密度分析免疫组化染色后光镜下观察胞核内或者细胞质内呈现不同程度的棕黄色或棕褐色粗大颗粒反应者为PIBF抗体染色阳性细胞。应用美国Media Cybernetics公司专业图片分析软件Image-Pro Plus 6.0分析。将免疫组化切片图像通过图像采集系统以×40物镜输入,每张切片图像随机采集10张,对图像中阳性反应部位进行平均光密度分析,记录积分光密度(IOD),取10张图片平均值作为标本的结果。
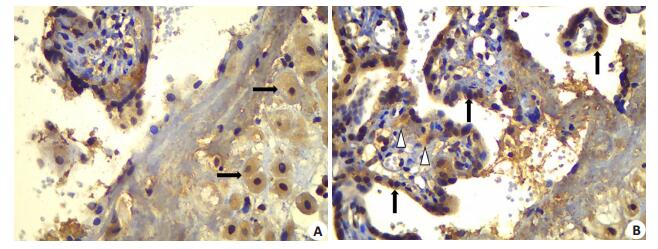
|
图 1 免疫组化PIBF在胎盘组织的定位表达 Figure 1 Immunohistochemical staining with PIBF expression in placenta. →: decidual cell. ↑: syncytiotrophoblast. △: trophoblast cell. |
调整流式细胞仪前向角和侧向角参数,分别在横坐标和纵坐标之间设门,用PerCp标记的CD3单抗和侧向角散射光双参数圈出CD3阳性细胞群,再用CD8-FITC筛除CD8+T细胞,留下CD4+T细胞,对照消除自发荧光和非特异荧光,点图最后测定Th1(CD8-CD3 + IFN-γ +)、Th2(CD8-CD3+IL-4+)的百分率,计算外周血中Th1/Th2比率。
1.3 统计学分析采用SPSS 19.0统计软件进行统计分析。计数资料采用均数±标准差表示。3组间均数比较采用单因素方差分析,符合双变量正态分布资料采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较本研究共纳入72例孕妇,EOPE组25例,年龄20~41(29.24±5.52)岁;LOPE组22例,年龄17~43(28.00±5.89)岁;对照组年龄19~36(28.40±4.82)岁。3组年龄差异无统计学意义(F=0.326,P=0.723)。
2.2 胎盘免疫组化图像分析免疫组化染色切片上可见胎盘蜕膜组织、合体滋养层细胞、部分绒毛滋养层细胞均有PIBF表达。
2.3 3组血清PIBF含量、Th1/Th2比值和胎盘PIBFIOD值的差异3组间血清PIBF含量、Th1/Th2比值和胎盘PIBF-IOD值的差异都有统计学意义(P < 0.05)。EOPE组与对照组相比,血清PIBF降低、外周血Th1/Th2比值增高有统计学意义(P < 0.05)。EOPE组和LOPE组与对照组相比胎盘PIBF表达量(PIBF-IOD)减少均有统计学意义(P < 0.05,表 1)。
| 表 1 3组外周血PIBF含量、Th1/Th2比值和胎盘PIBF-IOD值的比较 Table 1 Difference of serum PIBF, blood Th1/Th2 and placental PIBF-IOD among three groups (Mean±SD) |
子痫前期血清PIBF水平与平均动脉压(MAP)无相关关系(P > 0.05)。在EOPE组中,血清PIBF水平与24 h尿蛋白定量、外周血Th1/Th2呈负相关关系,与胎盘PIBF-IOD呈正相关关系(P < 0.05)。在LOPE组中,血清PIBF水平与胎盘PIBF-IOD呈正相关关系,与外周血Th1/Th2呈负相关关系(P < 0.05)。
| 表 2 血清PIBF与平均动脉压(MAP)、24 h尿蛋白定量、胎盘PIBF-IOD及外周血Th1/Th2的关系 Table 2 Relationship of serum PIBF with MAP, 24-hour urinary protein quantity, placental PIBF-IOD and blood Th1/Th2 |
1985年Szekeres-Bartho等[6]首次发现正常妊娠孕妇在孕激素刺激下外周血淋巴细胞可以分泌相对分子质量为34 000的PIBF。该基因全长约90 000,位于染色体的13q21-q22区域,编码含有757个氨基酸的的蛋白质。全长的PIBF位于细胞核中心体,而外显子可跳跃选择性剪接产生几个不同长度片段的PIBF,34 000的PIBF就是一种被分泌到细胞质的分泌蛋白。妊娠期淋巴细胞和恶性肿瘤细胞都可以表达PIBF,因此PIBF被称为一把“双刃剑”,通过其诱导形成的“Th2型”免疫反应抑制免疫功能[6]。一方面有助于母胎之间免疫耐受的建立,另一方面支持肿瘤细胞实现免疫逃逸[1]。
尽管流产早产和子痫前期都与胎盘形成不良密切相关,但是子痫前期患者体内PIBF的表达是否存在异常尚未引起广泛的关注,且国内外尚未有血清PIBF与子痫前期的相关报道。本研究测定的正常对照组孕妇的血清PIBF平均值为273.91±48.57 ng/mL,与先兆早产研究中足月妊娠对照组的参考值272.85±114.87 ng/mL [7]十分相近,具有很好的可比性。Polgar等[8]率先用ELISA方法探索子痫前期和正常妊娠孕妇尿液中的PIBF的含量,发现患者尿液中的PIBF水平与同等孕周正常妊娠孕妇相似,但有两个或者两个以上症状的子痫前期孕妇尿液的PIBF水平显著低于正常孕妇。本研究直接取材于人体外周血标本,可以更直接反应体内PIBF水平,结果显示早发型重度子痫前期孕妇血清PIBF水平为213.58±44.93 ng/mL且显著低于正常孕妇,与既往研究中自发性流产214.4±120.6 ng/mL [9]接近,高于24~37周先兆早产171.12±162.06 ng/mL [7]。在与临床指标的相关性研究中,发现血清PIBF和平均动脉压无相关关系,可能由于血压受到测量的时间孕周等多因素影响有关,但早发型重度子痫前期孕妇的血清PIBF与24 h尿蛋白定量呈线性负相关关系。尽管美国妇产科医师学会(ACOG)《妊娠高血压疾病指南》指出,大量蛋白尿不作为子痫前期严重表现的诊断标准[10],但是临床上还是把尿蛋白定量作为观察监测的重要指标之一,尤其是对于早发型重度子痫前期患者,尿蛋白出现的孕周早晚和定量多少,在很大程度上决定了病情的预后,因此血清PIBF可以间接反映重度子痫前期时肾脏的损害情况,对预估病情具有一定意义。
本研究中胎盘PIBF免疫组化染色显示该蛋白表达于蜕膜组织、合体滋养层细胞和部分绒毛滋养层细胞,细胞定位和Anderle等[11]的研究结果基本一致,即在胎盘侵袭性绒毛膜外滋养细胞(EVT细胞)、合体滋养层细胞以及部分绒毛滋养层细胞有3种不同长度的PIBF蛋白表达。Polgar等[12]也发现合体滋养层细胞可以分泌PIBF释放入血液循环参与全身免疫耐受,胎盘是外周血PIBF的来源之一,因此我们猜测在重度子痫前期中胎盘分泌的PIBF可能是影响血清PIBF水平的主要因素。本研究证实血清PIBF水平与胎盘PIBF的表达量(IOD)呈正相关关系,能如实反映胎盘的病理生理状况,可考虑作为在各个孕周监测的外周血指标。另外,用PIBF干预滋养细胞发现瘦素(Leptin)及其受体表达降低,影响葡萄胎及绒毛膜癌等疾病的滋养细胞侵袭能力[13],PIBF还可以通过改变金属基质蛋白酶(MMP)调节滋养细胞能力[14]。因此除了免疫耐受失衡外,PIBF还可能涉及重度子痫前期发病初期胎盘形成时滋养细胞侵袭能力的异常。
在胎盘的母胎免疫界面中,Thl和Th2细胞数量及其分泌的细胞因子保持动态平衡,是避免病理妊娠的免疫基础。Th1/Th2细胞免疫失衡现象,即Th1/Th2功能亚群平衡向Th1偏移,Th1型细胞因子如TNF-α、IFN-γ介导的细胞免疫功能增强,而Th2型细胞因子如IL-4、IL-10等介导的体液免疫功能减弱。Hudić等[7]证实自发性早产时血清PIBF水平降低,与抗炎细胞因子IL-10降低,而促炎细胞因子IFN-γ升高有关。本研究利用流式细胞仪检测外周血中Th1和Th2细胞的百分率,计算Th1/Th2比值,发现该比值升高与重度子痫前期孕妇血清PIBF降低呈相关关系,较Th1和Th2细胞所分泌的细胞因子更直观地阐明了免疫细胞比例失衡的机制,并且进一步将重度子痫前期时PIBF的胎盘表达减少、血清PIBF表达水平下降和免疫细胞Th1/Th2平衡向Th1偏移这三者的关系串联起来,揭示PIBF参与重度子痫前期发病的可能性。另外,由于PIBF与滋养细胞侵袭力的关联[13-14],PIBF低表达时胎盘滋养细胞承受的母体免疫攻击将增加,其侵袭数量和能力都可能受损,从而出现滋养细胞侵袭不完全,影响胎盘螺旋小动脉重塑,最终导致胎盘形成不良。由于免疫微环境是一个多途径多因素的复杂过程,Saito等[15]提出将Th1/Th2失衡进一步拓展至Th1/Th2/Th17失衡学说,期待能更加合理地解释病理妊娠时的分子和功能改变。
综上所述,重度子痫前期孕妇胎盘PIBF表达及外周血清PIBF减少,导致Th1/Th2向Th1偏移,PIBF介导的免疫耐受失衡可能参与重度子痫前期的发病。PIBF是妊娠诱发淋巴细胞分泌的免疫调节抑制因子,是重度子痫前期的保护因素之一,未来研究可以着力于不同孕周的血清PIBF异常改变,有望找到临床早期诊断的外周血标志物。Raghupathy等[16]研究发现复发性流产和早产孕妇接受PIBF治疗后,通过上调Th2型细胞因子如IL-4、IL-6和IL-10等促使Th1/Th2平衡向Th2偏移。临床上应用地屈孕酮治疗先兆早产患者,可以提高血清PIBF水平从而改善Th1/Th2失衡现象[17]。如果通过外源性补充增加外周血PIBF水平,纠正逆转Th1/ Th2失衡,则可能治疗或者延缓重度子痫前期进展,为重度子痫前期的治疗开启新的思路。
| [1] | Ermisch C, Markert UR. PIBF-Progesterone-Induced blocking factor[J]. Z Geburtshilfe Neonatol,2011, 215 (3) : 93-7. DOI: 10.1055/s-0031-1271742. |
| [2] | Perez-Sepulveda A, Torres MJ, Khoury M, et al. Innate immune system and preeclampsia[J]. Front Immunol,2014, 5 (5) : 244. |
| [3] | Szekeres-Bartho J, Falkay G. The mechanism of the inhibitory effect of progesterone on lymphocyte cytotoxicity: I.Relationship between cytotoxicity and the cyclooxygenase pathway of arachidonic acid metabolism[J]. Am J Reprod Immunol Microbiol,1985, 9 (1) : 15-8. DOI: 10.1111/j.1600-0897.1985.tb00334.x. |
| [4] | Wu S, Zhang H, Tian J, et al. Expression of kisspeptin/GPR54 and PIBF/PR in the first trimester trophoblast and decidua of women with recurrent spontaneous abortion[J]. Pathol Res Pract,2014, 210 (1) : 47-54. DOI: 10.1016/j.prp.2013.09.017. |
| [5] | Beta J, Szekeres-Bartho J, Skyfta E, et al. Maternal serum progesterone-induced blocking factor at 11-13 weeks' gestation in spontaneous early preterm delivery[J]. Fetal Diagn Ther,2011, 29 (3) : 197-200. DOI: 10.1159/000322388. |
| [6] | Szekeres-Bartho J, Polgar BP. The double edged sword. pregnancy and tumor[J]. Am J Reprod Immunol,2010, 64 (2) : 77-86. |
| [7] | Hudić I, Fatusić Z, Szekeres-Bartho J, et al. Progesterone-induced blocking factor and cytokine profile in women with threatened pre-term delivery[J]. Am J Reprod Immunol,2009, 61 (5) : 330-7. DOI: 10.1111/j.1600-0897.2009.00699.x. |
| [8] | Polgar B, Nagy E, Miko F, et al. Urinary progesterone-induced blocking factor concentration is related to pregnancy outcome[J]. Biol Reprod,2004, 71 (5) : 1699-705. DOI: 10.1095/biolreprod.104.030437. |
| [9] | Hudić I, Fatusić Z. Progesterone-induced blocking factor (PIBF) and Th (1)/Th (2) cytokine in women with threatened spontaneous abortion[J]. J Perinat Med,2009, 37 (4) : 338-42. |
| [10] | Homer CS, Brown MA, Mangos G, et al. Non-proteinuric preeclampsia: a novel risk indicator in women with gestational hypertension[J]. J Hypertens,2008, 26 (2) : 295-302. DOI: 10.1097/HJH.0b013e3282f1a953. |
| [11] | Anderle C, Hammer A, Polgár B, et al. Human trophoblast cells Express the immunomodulator progesterone-induced blocking factor[J]. J Reprod Immunol,2008, 79 (1) : 26-36. DOI: 10.1016/j.jri.2008.06.002. |
| [12] | Polgar B, Kispal G, Lachmann M, et al. Molecular cloning and immunologic characterization of a novel cDNA coding for progesterone-induced blocking factor[J]. J Immunol,2003, 171 (11) : 5956-63. DOI: 10.4049/jimmunol.171.11.5956. |
| [13] | Miko E, Halasz M, Jericevic-Mulac B, et al. Progesterone-induced blocking factor (PIBF) and trophoblast invasiveness[J]. J Reprod Immunol,2011, 90 (1) : 50-7. DOI: 10.1016/j.jri.2011.03.005. |
| [14] | Halasz M, Polgar B, Berta G, et al. Progesterone-induced blocking factor differentially regulates trophoblast and tumor invasion by altering matrix metalloproteinase activity[J]. Cell Mol Life Sci,2013, 70 (23) : 4617-30. DOI: 10.1007/s00018-013-1404-3. |
| [15] | Saito S, Nakashima A, Shima T, et al. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J]. Am J Reprod Immunol,2010, 63 (6) : 601-10. DOI: 10.1111/(ISSN)1600-0897. |
| [16] | Raghupathy R, Al-Mutawa E, Al-Azemi M, et al. Progesteroneinduced blocking factor (PIBF) modulates cytokine production by lymphocytes from women with recurrent miscarriage or preterm delivery[J]. J Reprod Immunol,2009, 80 (2) : 91-9. |
| [17] | Hudić I, Szekeres-Bartho J, Fatušić Z, et al. Dydrogesterone supplementation in women with threatened preterm delivery--the impact on cytokine profile, hormone profile, and progesteroneinduced blocking factor[J]. J Reprod Immunol,2011, 92 (1/2) : 103-7. |
 2015, Vol. 35
2015, Vol. 35
