血吸虫病是联合国开发计划署/世界银行/世界卫生组织联合倡议“热带病特别规划”在全球重点防治的10种热带病之一,流行广泛,是目前仍严重威胁民众健康的人兽共患寄生虫病[1]。我国仅流行日本血吸虫病。血吸虫病的主要致病因子是虫卵。日本血吸虫尾蚴入侵宿主后的23~25 d,发育成熟的雌虫开始产卵并主要沉积于肝、肠组织,初产卵(未成熟虫卵)一般经历11 d发育为内含毛蚴的成熟虫卵,而后历时11 d成熟虫卵在组织内逐渐钙化、死亡。血吸虫病主要病变是成熟虫卵释放可溶性虫卵抗原(soluble egg antigen, SEA),激活宿主免疫应答系统,介导肉芽肿反应破坏宿主正常组织[2-3]。
近年来,我国血吸虫病疫情得到有效控制,相关基础性研究如日本血吸虫基因组、转录组、microRNA组学亦取得系列进展,但至今仍无有效的日本血吸虫病疫苗,且血吸虫对首选治疗药物吡喹酮存在产生抗药性的风险,已达标地区疫情不稳定[4],对已病变组织中虫卵肉芽肿的治愈仍没有很好的解决方案。因而,解析SEA激发宿主肉芽肿形成的分子机制,有利于寻找有效的潜在抗病免疫靶标分子,意义重大。WHO/TDR已将血吸虫肉芽肿形成机制及控制方法的研究列入重点课题。
目前,对激发曼氏血吸虫虫卵肉芽肿形成的SEA成分已有较深入了解,曼氏血吸虫主要虫卵抗原p40(Smp40)是其中关键性分子,Smp40是曼氏血吸虫虫卵中含量最丰富的组分,约占SEA的10%,已证实Smp40是强Th细胞致敏分子,具有强免疫原性,能诱发宿主产生细胞免疫及体液免疫反应,在虫卵肉芽肿的形成过程中扮演重要角色,并具有一定的抗病免疫潜能[5-7]。本实验室前期研究证实Sjp40与Smp40高度同源,是日本血吸虫的主要虫卵抗原,在日本血吸虫虫卵期的转录水平和蛋白水平均呈高表达,并具有一定的早期诊断价值[8],相应制备了抗Sjp40单抗,并获得中国发明专利授权。Sjp40是否与Smp40同样在血吸虫肉芽肿病变中具有重要作用并具备抗病免疫潜能?Sjp40和Smp40隶属于具有ɑ晶体蛋白结构域的小热休克蛋白sHSP20家族[9-10],sHSP与细胞抗凋亡及生物体应激反应密切相关[11]。Sjp40在血吸虫肉芽肿病变的发生、发展过程中的分子机制如何?本研究制备日本血吸虫感染新西兰白兔模型,取未成熟虫卵沉积但尚未发生肉芽肿病变的肝脏组织以及大量成熟虫卵聚集并发生广泛肉芽肿急性病变期的肝脏组织进行Sjp40的表达量测定及其免疫定位,旨在为深入展开Sjp40的分子致病机制研究奠定工作基础。
1 材料与方法 1.1 材料 1.1.1 细胞株与抗体抗日本血吸虫Sjp40-McAb 9G7 [12]和抗弓形虫tSAG1-McAb Y3A8[13]杂交瘤细胞株由本室制备保存;Goat anti-Mouse IgG, PeroxidaseConjugayed,H+L(Millipore,美国),goat anti-mouseIgG-FITC(Santa Cruz Biotechnology,美国)。
1.1.2 主要仪器ABI 7500 Real Time PCR System(Applied Biosystems, 美国),Nikon ECLIPSE TE2000-S倒置荧光显微镜(Nikon,日本),Nano Drop 2000超微量分光光度计(Thermo Scientific,美国),Gel Doc 2000凝胶成像系统(Bio-Rad,美国),Mini-PROTEAN TetraCell电泳仪(Bio-Rad,美国)。
1.1.3 主要试剂Taq聚合酶、PrimeScriptTM RT reagentKit with gDNA Eraser(Perfect Real Time)(Takara,日本),RNA酶抑制剂(Invitrogen,美国),DEPC处理水(鼎国昌盛生物技术有限责任公司,中国),MaximaProbe qPCR Master Mix(2X),ROX Solution provided(Thermo Scientific,美国),TRIzol试剂(Invitrogen,美国),Protease Inhibitor Cocktail Tablets,EDTA-Free(Sigma,美国),PMSF(100 mmol/L)(鼎国昌盛生物技术有限责任公司,中国),Precision Plus ProteinTMKaleidoscopeTM Standards(Bio-Rad,美国),Protein GSepharose 4 FF(GE,美国)。
1.1.4 实验动物雄性新西兰白兔7~9月龄,2.1~2.3 kg,BALB/c雌性小鼠6~8周龄,20~22 g,均购自南方医科大学实验动物中心;野生型日本血吸虫阳性钉螺购自湖南省血吸虫病防治研究所。
1.2 方法 1.2.1 动物感染与肝脏收集取雄性新西兰白兔9只,分为3组,3只收集正常肝脏,其余6只分别经腹部感染日本血吸虫尾蚴2000条[9],于感染后第29天(29 dpi)和45天(45 dpi)剖杀,迅速收集各期兔肝脏,每只兔肝脏均自不同部位取材3份,共计27份标本,迅速置于液氮,用于qRT-PCR的样品制备;同步取部分肝组织置于10%pH7.2 PBS-福尔马林固定,用于组织切片制备。
1.2.2 Taqman探针qRT-PCR未感染组、29 dpi组和45 dpi组的每只兔肝脏不同部位取材的27份置于液氮中的新鲜标本,迅速在液氮下研磨成均匀粉末状,按TRIzol试剂说明书提取其总RNA,Prime ScriptTM RTreagent Kit with gDNA Eraser(Perfect Real Time)去除基因组DNA后逆转录成cDNA。qRT-PCR的引物及探针参照本实验室前期工作[9],以日本血吸虫甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH, Genbank登录号:AY812850.1)作为内参,按照说明书步骤配制25 µL体系PCR反应液,其中MaximaProbe qPCR Master Mix(2X)12.5 µL,PCRForward Primer(10 µmol/L)0.8 µL,PCR ReversePrimer(10 µmol/L)0.8 µL,Taqman探针(10 µmol/L)0.4 µL,ROX Solution(5 µmol/L)0.15 µL,模板cDNA2 µL。扩增条件为:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 60 s程序进行40个循环。在退火60 ℃ 60 s时,ABI7500 qPCR扩增仪进行实时荧光信号收集。根据循环阈值(Ct值),由公式2-ΔCT得出未感染组、29 dpi组和45 dpi组新西兰白兔肝脏沉积虫卵中Sjp40的mRNA表达情况。29 dpi组和45 dpi组两组兔肝脏沉积虫卵间Sjp40的mRNA表达差异比较利用SPSS 13.0统计软件处理,采用独立样本t检验分析,P < 0.05表示差异具有统计学意义。
1.2.3 抗日本血吸虫Sjp40-McAb 9G7和抗弓形虫tSAG1-McAb Y3A8的制备和纯化 1.2.3.1 单克隆抗体细胞株复苏、培养及接种小鼠液氮罐中取出冻存的抗Sjp40-McAb 9G7和抗弓形虫tSAG1-McAb Y3A8两株杂交瘤细胞进行复苏,培养细胞至对数生长期,在预先注射液体石蜡(0.5 mL/只)1周致敏的每只BALB/c小鼠腹腔分别接种1×106~2×106杂交瘤细胞,10 d后采集腹水并离心[13],收集上清,分装,保存于-80 ℃备用。
1.2.3.2 Protein G Sepharose 4 FF纯化单克隆抗体常规硫酸铵沉淀法初步纯化腹水中抗体,将最后收集到的蛋白沉淀用PBS溶液(pH7.4)溶解,留取标本100 μL,Nano Drop 2000超微量分光光度计测定其蛋白含量,按照Protein G Sepharose 4 FF和小鼠抗体的结合能力为10 mg/mL确定已初步纯化的抗体的上样量,装有Protein G和样品的柱子置于摇床中4 ℃过夜,使样品与Protein G充分结合,次日向柱子中缓慢加入5~10倍柱体积结合缓冲液(20 mmol/L磷酸盐缓冲液,pH7.0)进行洗涤后向柱子中缓慢加入1倍柱体积的洗脱液(0.1 mol/L甘氨酸-盐酸缓冲液,pH2.7)依次进行7次洗脱,收集每次洗脱出来液体,Nanodrop 2000超微量分光光度计测定洗脱液中蛋白浓度,分装,保存于-80 ℃备用。
1.2.4 Western blot检测Sjp40在各组新西兰白兔肝脏组织中的蛋白表达情况未感染组、29 dpi组和45 dpi组新西兰白兔肝脏用液氮研磨成均匀粉末状后,分别加入100 µL 1×蛋白裂解液(Protease Inhibitor CocktailTablets一片,加入到10 mL pH=7.2 PBS中,加入100 μL的PMSF制成10×蛋白裂解液的储备溶液,分装,-20 ℃保存,临使用前配制1×蛋白裂解液),充分混匀后4 ℃静置1.5 h,12 000 g离心15 min取上清,4 ℃过夜,次日4 ℃ 12 000 g再次离心15 min取上清;所得各组肝脏总蛋白经10% SDS-PAGE分离后转移至PVDF膜,5%BSA 4℃封闭过夜,以纯化抗Sjp40-McAb 9G7(稀释度:1:2500)作为一抗,室温孵育1.5 h;Goat anti-MouseIgG,Peroxidase Conjugayed(稀释度:1:30 000)作为二抗,室温孵育45 min;曝光拍照。
1.2.5 HE染色与间接免疫荧光技术 1.2.5.1 固定及切片未感染组、29 dpi组和45 dpi组新西兰白兔新鲜肝脏组织经10% pH7.2 PBS-福尔马林固定包埋成石蜡组织块,制作蜡块组织切片,厚度为4~6 µm;进一步制备成含组织切片玻片。
1.2.5.2 HE染色观察感染兔肝脏虫卵肉芽肿的形成与发展取各组兔肝脏玻片于65 ℃烤箱中烤片1 h,依次浸泡二甲苯2次,每次10 min,无水乙醇10 min,95%乙醇5 min,80%乙醇5 min,75%乙醇5 min,去离子水5 min脱蜡;苏木精液染色5 min,流水冲洗1~3 s,1%盐酸乙醇浸泡1~3 s,流水冲洗10~30 s,蒸馏水漂洗1~2 s,0.5%伊红液染色1~3 min,蒸馏水漂洗1~2 s,依次浸泡上行梯度酒精75% 1~2 s、80% 2~3 s、95% 3~5 s、100%5~10 min脱水,二甲苯浸泡3次透明,每次3~5 min,中性树胶封固,显微镜下观察。
1.2.5.3 间接免疫荧光观察Sjp40在感染新西兰白兔肝脏中的定位取各期兔肝脏玻片于65 ℃烤箱中烤片1 h,依次浸泡二甲苯2次,每次10 min,无水乙醇10 min,95%乙醇5 min,80%乙醇5 min,75%乙醇5 min,去离子水5 min和PBS 5 min脱蜡;脱蜡后玻片用3%过氧化氢浸泡10 min,0.01 µmol/L PBS(pH7.4)漂洗3次,每次5 min,80 ℃~100 ℃ 0.01 mol/L柠檬酸盐缓冲液水浴加热处理玻片20 min,0.01 µmol/L PBS漂洗两次,每次5 min;10% BSA 4 ℃封闭过夜,纯化后的抗Sjp40-McAb 9G7和抗弓形虫tSAG1-McAb Y3A8(稀释度:1:2500)室温孵育1.5 h,PBST(pH7.4)漂洗3次,每次5 min;goat anti-mouse IgG-FITC(稀释度:1:10 000)室温避光孵育45 min,PBST(pH7.4)漂洗5次,每次5 min;荧光显微镜下观察。本实验中的未感染兔肝脏标本和感染兔肝脏标本(29 dpi组和45 dpi组),均以抗Sjp40-McAb 9G7进行特异性检测,抗弓形虫tSAG1-McAb Y3A8为无关抗体检测,以PBS替代一抗作为空白对照检测。
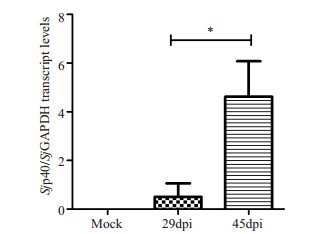
2 结果 2.1 Taqman探针qRT-PCR检测感染新西兰白兔肝脏沉积虫卵中Sjp40 mRNA表达情况qRT-PCR检测结果显示Sjp40在未感染组兔肝脏中没有表达,在29 dpi感染兔肝脏中mRNA的表达水平较低,而在45 dpi感染兔肝脏中其mRNA表达水平显著增加(图 1)。
|
图 1 qRT-PCR检测日本血吸虫感染新西兰白兔肝脏沉积虫卵中Sjp40 mRNA的表达 Figure 1 Sjp40 mRNA levels detected by qRT-PCR in the eggs trapped in the livers of New Zealand white rabbits infected with S. japonicum at 29 and 45 days post-infection (dpi). Mock: Uninfected livers of rabbits. *P < 0.05 vs 29 dpi. |
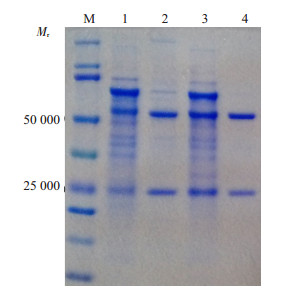
SDS-PAGE分析抗Sjp40-McAb 9G7和抗弓形虫tSAG1-McAb Y3A8两株杂交瘤细胞分别制备的BALB/c小鼠腹水,经硫酸铵盐析法和Protein G免疫亲和柱层析法纯化前后效果比较,纯化后结果显示无明显杂带,抗体重链约50 000和轻链约25 000,两条条带清晰,大小符合预期(图 2),获得纯度较高的两株单抗蛋白。
|
图 2 SDS-PAGE分析抗Sjp40-McAb 9G7和抗弓形虫tSAG1-McAb Y3A8纯化效果 Figure 2 SDS-PAGE analysis of the purity of anti-Sjp40 mAb 9G7 and anti-tSAG1 mAb Y3A8 after immunoaffinity chromatography purification. M: Protein marker; 1: BALB/c mice ascites containing anti-Sjp40 mAb 9G7; 2: Purified BALB/c mice ascites containing anti-Sjp40 mAb 9G7; 3: BALB/c mice ascites containing anti-tSAG1 mAb Y3A8; 4: Purified BALB/c mice ascites containing anti-tSAG1 mAb Y3A8. |
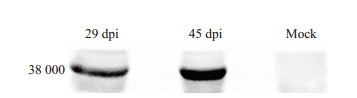
Western blot结果显示本实验室自己纯化制备的抗Sjp40-McAb 9G7能特异性地检测到日本血吸虫感染新西兰白兔29 dpi和45 dpi两组兔肝脏中Sjp40的蛋白表达,未感染组兔肝脏中未检测到Sjp40的蛋白表达(图 3)。
|
图 3 Western blot分析感染新西兰白兔肝脏中Sjp40表达的特异性 Figure 3 Identification of Sjp40 expression in the livers of New Zealand white rabbits infected with S. japonicum by Western blot at 29 and 45 dpi. |
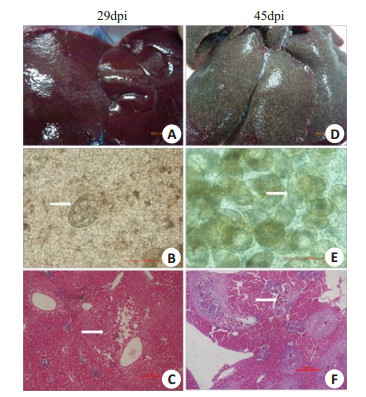
肝脏表面病变情况观察结果显示29 dpi兔肝脏未见明显病变(图 4A),切取此肝脏压片于高倍镜下观察发现肝脏中虫卵极少且单个存在,虫卵中可见卵黄细胞,此时虫卵全部属于未成熟卵阶段(图 4B),病理观察也显示此期兔肝脏中虫卵极少,未见虫卵肉芽肿形成,但肝脏已有轻微病变(图 4C);肝脏表面病变情况观察结果显示45 dpi兔肝脏病变明显,虫卵结节布满整个肝脏(图 4D),切取此肝脏压片于高倍镜下观察可见大量虫卵堆积,大部分虫卵中可见成熟毛蚴(图 4E)。病理观察显示此期肝脏中虫卵大量成簇沉着,虫卵肉芽肿随处可见(图 4F)。图中所有白色箭头指示日本血吸虫虫卵。
|
图 4 感染新西兰白兔肝脏中日本血吸虫虫卵肉芽肿形成观察 Figure 4 Observation of egg granuloma formation in the livers of New Zealand white rabbits infected with S. japonicum. A, D: Gross fresh specimens of the infected rabbit livers harvested at 29 dpi and 45 dpi, respectively; B, E: Fresh specimens of the infected rabbit livers harvested at 29 dpi and 45 dpi, respectively, observed under microscopy; C, F: HE staining of the paraffin slices of the infected rabbit livers harvested at 29 dpi and 45 dpi, respectively. B, E: Scale bar=100 μm; C, F: Scale bar=500 μm. |
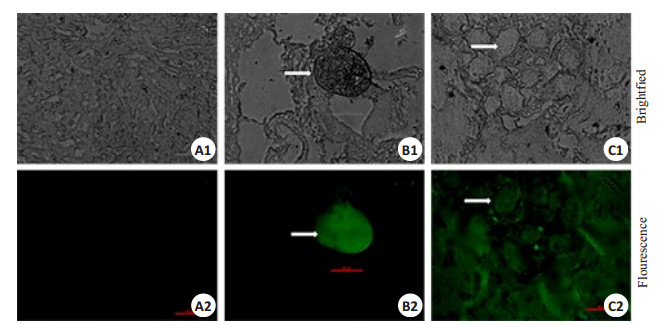
荧光显微镜下观察,以抗Sjp40-McAb 9G7作为一抗的特异性检测结果显示:未感染新西兰白兔肝脏没有Sjp40蛋白(绿色荧光)表达(图 5A);29 dpi感染兔肝脏中Sjp40蛋白均匀聚集在肝脏沉积的虫卵中(图 5B);45dpi感染兔肝脏中Sjp40除聚集在肝脏中沉积的虫卵外,向虫卵周围的肝脏肉芽肿组织有明显的播散,聚集的虫卵显示内含毛蚴(图 5C)。图中所有白色箭头指示日本血吸虫虫卵。同步以抗弓形虫tSAG1-McAb Y3A8为无关抗体检测,以PBS替代一抗作为空白对照检测,均在同等曝光条件下未显示明显荧光(因无明显荧光显示,此两组图片略)。
|
图 5 抗Sjp40-McAb 9G7检测Sjp40在感染新西兰白兔肝脏沉积卵及其周围肉芽肿组织免疫定位 Figure 5 Immunofluorescence localization of Sjp40 in the trapped eggs and surrounding egg granulomas in livers of New Zealand white rabbits infected with S.japonicum. A: Uninfected rabbit liver; B, C: Infected rabbit liver harvested at 29 and 45 dpi, respectively. Scale bar=50 μm. |
本研究所制备日本血吸虫感染新西兰白兔动物模型显示:在29dpi感染兔肝脏中有未成熟虫卵沉积,但尚未见肉芽肿病变发生;在45dpi感染兔肝脏则显示遍布整个肝脏的急性肉芽肿病变,肉芽肿的中心存在大量成簇日本血吸虫虫卵,以内含毛蚴的成熟虫卵为主。此现象与血吸虫病的主要致病机制源于成熟虫卵所分泌SEA诱导肉芽肿组成形成的相关研究结果相符。目前血吸虫病免疫病理学研究仍是血防研究重点方向之一[14]。虫卵肉芽肿病变是血吸虫病最主要的病理损害[2, 15]。与曼氏血吸虫不同,日本血吸虫虫卵在宿主组织中的沉积常成簇存在,故形成的肉芽肿和病灶也较大[16]。同种血吸虫不同株(地区)的发育速度也有一定差异[17]。小鼠和新西兰白兔是至今研究较为透彻的日本血吸虫适宜宿主模型,小鼠体内日本血吸虫产卵的时间中国大陆株始于感染后第24~25天,感染后第25~26天肝肠组织内开始出现初产卵,而成熟期虫卵于感染后第36天出现,在45~50 d达到高峰,此后由于变性虫卵出现和积累使成熟期虫卵及其前期的虫卵比率减少,新西兰白兔宿主体内日本血吸虫开始产卵时间较小鼠早1~2 d,但不同地区的宿主以及宿主个体的差异都可能影响到雌虫产卵的时间,我们经前期实验验证,为保证本实验顺利观察到肝脏中只含初产未成熟卵和绝大部分为内含活毛蚴的成熟卵的两个阶段,本研究选取感染日本血吸虫(中国大陆湖南株)后的第29天和第45天的新西兰白兔肝脏作为研究对象,发现29 dpi兔肝脏尚无虫卵结节形成,肝脏无明显病变,而45 dpi兔肝脏则病变严重,满布虫卵结节;将29 dpi和45 dpi两个时期的新鲜兔肝脏压片后于高倍镜下观察可见29 dpi兔肝脏中有极少量虫卵沉积且皆属于胚胎发育期的未成熟卵,而45 dpi兔肝脏中大部分为内含活毛蚴的成熟卵;组织病理结果也显示29 dpi肝脏中虫卵很少,无虫卵肉芽肿形成,而45 dpi肝脏中虫卵大量成簇沉积,虫卵周围形成的肉芽肿随处可见。杨健美等[18]对日本血吸虫适宜宿主黄牛、山羊和非适宜宿主水牛的49 dpi肝脏进行了病理切片的观察及比较,发现水牛组的肝细胞无变性,肝脏组织无炎症细胞集聚浸润、小叶结构完整;而黄牛组和山羊组的肝脏组织炎性细胞显著增多且聚集,虫卵周围出现大量嗜酸性细胞、炎性淋巴细胞聚集浸润,形成典型的条纹状嗜伊红沉淀物。本实验所用动物模型新西兰白兔为适宜宿主,病理切片观察结果与杨健美等研究结果相符。
虫卵肉芽肿的形成是宿主对虫卵的一种免疫应答效应,而非血吸虫自身的毒性因子所致[19]。实验研究证实,日本血吸虫虫卵肉芽肿的形成是由T淋巴细胞介导的迟发型超敏反应,其基本过程是成熟毛蚴释放的SEA经巨噬细胞处理,呈递给辅助性T细胞(Th),同时分泌白细胞介素-1(IL-1),致敏Th细胞,产生多种细胞因子引起以巨噬细胞、嗜酸性细胞、成纤维细胞等为主的细胞群聚集于虫卵周围形成以虫卵为中心的肉芽肿[20]。但影响虫卵肉芽肿形成的因素和宿主的免疫病理和免疫调节机制复杂多变,不同的宿主对血吸虫的抵抗和清除机制也不尽相同。研究还发现虫卵一旦发育成熟,肉芽肿便迅速形成,故推测宿主对童虫-成虫的免疫反应在虫卵成熟前已使宿主处于致敏状态,这可能参与了虫卵肉芽肿的形成[21]。Sjp40 mRNA和蛋白在日本血吸虫尾蚴和成虫阶段皆已有表达[9, 22],且纯化的Sjp40抗原可识别21 dpi兔血清以及急性病人血清[22],该分子已被证实是一个早期诊断优势抗原[8, 22-23],本实验室这些前期结果显示,Sjp40在早期已激发宿主产生免疫反应。本研究进一步呈示Sjp40在日本血吸虫感染新西兰白兔肝脏沉积虫卵中的转录水平随虫卵发育成熟而显著增加,在感染兔急性肉芽肿病变期(45 dpi)呈现由虫卵向其周围肉芽肿组织扩散现象,说明Sjp40在童虫、成虫期的低水平表达使宿主在其虫卵成熟前的感染早期已致敏。随着虫卵成熟而上升的Sjp40表达量和释放至虫卵周围组织再次刺激宿主,提示Sjp40在日本血吸虫虫卵肉芽肿形成与发展过程中具有重要作用,为后续深入的Sjp40日本血吸虫致病分子机制研究奠定基础。
致谢: 对南方医科大学基础医学院病理学系张静华老师在肝组织切片制备和湖南省血吸虫病防治研究所罗新松老师在日本血吸虫感染动物模型制备方面给予的鼎力支持,在此一并致以衷心感谢!| [1] | Wang W, Dai JR, Liang YS. Apropos: factors impacting on progress towards elimination of transmission of schistosomiasis japonica in China[J]. Parasit Vectors,2014, 7 : 408. DOI: 10.1186/1756-3305-7-408. |
| [2] | Boros DL. Immunopathology of schistosoma mansoni infection[J]. Clin Microbiol Rev,1989, 2 (3) : 250-69. DOI: 10.1128/CMR.2.3.250. |
| [3] | 何毅勋, 杨惠中. 日本血吸虫卵形成的生理[J]. 动物学报,1974 (3) : 243-62. |
| [4] | 雷正龙, 郑浩, 张利娟, 等. 2013年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志,2014, 6 : 591-7. |
| [5] | Asahi H, Stadecker MJ. Analysis of egg antigens inducing hepatic lesions in schistosome infection[J]. Parasitol Int,2003, 52 (4) : 361-7. DOI: 10.1016/S1383-5769(03)00052-7. |
| [6] | Hernandez HJ, Trzyna WC, Cordingley JS, et al. Differential antigen recognition by T cell populations from strains of mice developing polar forms of granulomatous inflammation in response to eggs of Schistosoma mansoni[J]. Eur J Immunol,1997, 27 (3) : 666-70. DOI: 10.1002/(ISSN)1521-4141. |
| [7] | Stadecker MJ, Hernandez HJ. The immune response and immunopathology in infection with Schistosoma mansoni: a key role of major egg antigen Sm-p40[J]. Parasite Immunol,1998, 20 (5) : 217-21. DOI: 10.1046/j.1365-3024.1998.00150.x. |
| [8] | 周晓红, 陈晓光, 冯明钊, 等. 日本血吸虫成虫及虫卵可溶性抗原的早期诊断分子筛选[J]. 寄生虫与医学昆虫学报,2000, 7 (1) : 24-9. |
| [9] | 陈敏芳, 麦荣嘉, 莫倩珍, 等. 日本血吸虫小热休克蛋白Sjp40的RNA干扰效应[J]. 南方医科大学学报,2012, 32 (4) : 456-61. |
| [10] | Nene V, Dunne DW, Johnson KS, et al. Sequence and expression of a major egg antigen from Schistosoma mansoni. Homologies to heat shock proteins and alpha-crystallins[J]. Mol Biochem Parasitol,1996, 21 (2) : 179-88. |
| [11] | Sun Y, Macrae TH. Small heat shock proteins: molecular structure and chaperone function[J]. Cell Mol Life Sci,2005, 62 (21) : 2460-76. DOI: 10.1007/s00018-005-5190-4. |
| [12] | 吴锦雅, 周晓红, 陈晓光. 抗重组日本血吸虫P38抗原单克隆抗体的制备与鉴定[J]. 中国寄生虫学与寄生虫病杂志,2005, 23 (2) : 110-3. |
| [13] | 言慧, 李华, 陈晓光, 等. 抗弓形虫重组SAG1抗原单克隆抗体的制备与鉴定[J]. 中国寄生虫病防治杂志,2005, 18 (5) : 357-60. |
| [14] | Colley DG, Secor WE. Immunology of human schistosomiasis[J]. Parasite Immunol,2014, 36 (8) : 347-57. DOI: 10.1111/pim.2014.36.issue-8. |
| [15] | Burke ML, Jones MK, Gobert GN, et al. Immunopathogenesis of human schistosomiasis[J]. Parasite Immunol,2009, 31 (4) : 163-76. DOI: 10.1111/pim.2009.31.issue-4. |
| [16] | Cheever AW. Comparison of pathologic changes in mammalian hosts infected with Schistosoma mansoni, S. japonicum and S. haematobium[J]. Mem Inst Oswaldo Cruz,1987, 82 (Suppl 4) : 39-45. |
| [17] | Hsu HF, Hsu SY. Distribution of eggs of different geographic strains of Schistosoma japonicum in the viscera of infected hamsters and mice[J]. Am J Trop Med Hyg,1960, 9 : 240-7. |
| [18] | 杨健美, 苑纯秀, 冯新港, 等. 日本血吸虫感染不同相容性动物宿主的比较研究[J]. 中国人兽共患病学报,2012, 28 (12) : 1207-11. |
| [19] | Pearce EJ, Macdonald AS. The immunobiology of schistosomiasis[J]. Nat Rev Immunol,2002, 2 (7) : 499-511. DOI: 10.1038/nri843. |
| [20] | Chuah C, Jones MK, Burke ML, et al. Cellular and chemokinemediated regulation in schistosome-induced hepatic pathology[J]. Trends Parasitol,2014, 30 (3) : 141-50. DOI: 10.1016/j.pt.2013.12.009. |
| [21] | 管晓虹, 赵慰先. 小鼠感染日本血吸虫后肝脏内的细胞反应[J]. 寄生虫学与寄生虫病杂志,1985 (4) : 16-20, 83. |
| [22] | Zhou XH, Wu JY, Huang XQ, et al. Identification and characterization of Schistosoma japonicum Sjp40, a potential antigen candidate for the early diagnosis of schistosomiasis[J]. Diagn Microbiol Infect Dis,2010, 67 (4) : 337-45. DOI: 10.1016/j.diagmicrobio.2010.03.003. |
| [23] | 周晓红, 陈晓光, 冯明钊, 等. 日本血吸虫可溶性虫卵抗原38kDa分子的纯化及诊断价值的初步评估[J]. 中国寄生虫学与寄生虫病杂志,2000, 3 : 9-11. |
 2016, Vol. 35
2016, Vol. 35
