2. 南方医科大学南方医院 影像中心,广东 广州 510515
2. Imaging Center, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
膝关节腔内注射玻璃酸钠(HA)作为治疗膝关节骨关节炎(KOA)的手段之一,学术界对其治疗KOA的疗效一直争议不断,不同临床研究之间观点尖锐对立,大量研究指出HA可有效缓解KOA症状并改善膝关节功能[1-2],但也有文献认为其缺乏临床疗效[3]。为探索上述观点对立的根源,本研究组回顾文献发现,所有临床研究均未标注HA的给药位点--给药位点差异若可导致HA在关节腔内分布范围不同,则很可能是造成结果偏歧的原因。而观察不同给药位点对HA在膝关节腔内分布范围的影响,则需要首先建立一种能够用于观察HA在膝关节腔内分布情况的有效模型。因此,本研究拟在HA制剂内掺入适量碘海醇作为示踪手段,以CT三维重建和X透视下动态显影为研究手段[4-5],建立HA在兔膝关节腔内分布的成像模型,为进一步了解给药位点差异是否造成HA在关节腔内的分布差异奠定基础。
1 材料与方法 1.1 HA-I混合制剂的制备与均一性评价将HA注射液(佰备,上海景峰制药股份有限公司)与碘海醇注射液(欧苏,扬子江药业集团有限公司)均匀混合(图 1),配制碘海醇浓度分别为2.5%、5%、10%、20%、40%的HA-I混合制剂各0.5 mL,行CT扫描并测量CT值(南方医科大学研发PACS软件),观察碘海醇在混合制剂中是否均一分布,判断其是否能够反映HA的分布情况。

|
图 1 均匀混合后的HA-I制剂 Figure 1 Well mixed HA and iohexol mixtures. |
体质量2.5 kg左右的新西兰白兔若干,雌雄均可,无膝关节损伤和结构异常,由南方医科大学动物实验中心提供。3%戊巴比妥钠按1 mL/kg从耳缘静脉注射麻醉成功后,膝关节备皮、皮肤消毒后,按照以下两种给药位点向膝关节腔注射HA-I制剂。(1)髌骨下给药位点:双侧后肢自然伸直,以髌骨内侧中点为穿刺点,穿刺针与水平面呈15°~20°进入关节腔,针头到达髌骨中心下方,缓慢匀速注射HA-I混合制剂0.5 mL;(2)关节线给药位点:双侧后肢自然屈曲,以膝关节线内侧处为穿刺点,穿刺针垂直进入关节腔,针头到达股骨髁间窝前方,缓慢匀速注射HA-I混合制剂0.5 mL。
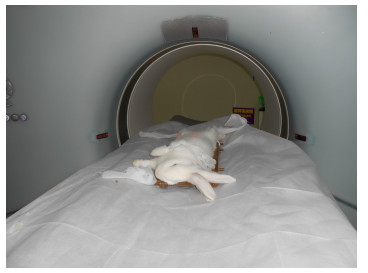
1.3 CT扫描及三维重建从关节线给药位点注射HA-I混合制剂完毕后立即行CT扫描(图 2)。测量膝关节周围软组织、胫骨骨皮质、关节腔中HA-I混合制剂三者的CT值,并对图像进行三维重建。扫描参数:(1)图像采集设备,西门子SOMATOM Spirit双源CT;(2)扫描条件,80 kV,140 kV,层厚0.8 mm,窗宽1400,窗位300;(3)扫描范围,膝关节上下3 cm,无间距连续扫描。
|
图 2 双源CT扫描 Figure 2 Dual-source CT scanning |
通过综合评估CT平扫与三维重建图像中药物分布与软组织及骨质的成像区分度,计算膝关节周围软组织、胫骨骨皮质、关节腔中HA-I制剂三者的平均CT值比值,筛选出能良好呈现药物在兔膝关节腔内成像分布的最适宜碘海醇浓度。
1.5 动态X线透视观察分别从髌骨下和关节线位点,向兔膝关节腔注射0.5 mL的5%碘海醇示踪的HA-I制剂。注射过程中X线透视观察,了解HA在关节腔内的初始分布范围。注射完毕后,屈伸兔膝关节50次,活动过程中同步X线透视观察药物的动态扩散方向和分布范围。
1.6 CT扫描观察同上,0.5 mL HA-I制剂从不同位点给药后,被动活动50次模拟膝关节行走。随后,进行双源CT扫描及图像三维重建。对比观察两种给药位点下HA在膝关节腔的内分布特征的差异。
2 结果 2.1 HA-I混合制剂均一性试验HA-I混合制剂的CT扫描图像呈现均匀一致灰度,提示混合制剂能够客观反映HA的分布情况(图 3)。

|
图 3 HA-I混合制剂均一性试验 Figure 3 Uniformity test of HA-iohexol mixtures containing different concentrations of iohexol. |
所有兔膝关节的周围软组织CT值范围波动于61.8±5.4~64.1±3.1 Hu,胫骨骨皮质CT值范围波动于1380.6±8.6~1488.5±10.6 Hu。关节腔内HA-I混合制剂CT值随碘海醇浓度增加而明显递增,并大致呈正比例关系;碘海醇浓度分别为2.5%、5%、10%、20%、40%时,膝关节软组织、HA-I制剂及骨组织三者的CT值对比值分别为2:7:46,2:14:44,2:28:44,2:60:46,2:98:45(表 1)。
| 表 1 软组织、胫骨皮质及不同碘海醇浓度HA-I的CT值 Table 1 CT values of soft tissues, bone cortex and HA-iohexol mixtures containing different concentrations of iohexol in the knee joint cavity (Mean±SD) |
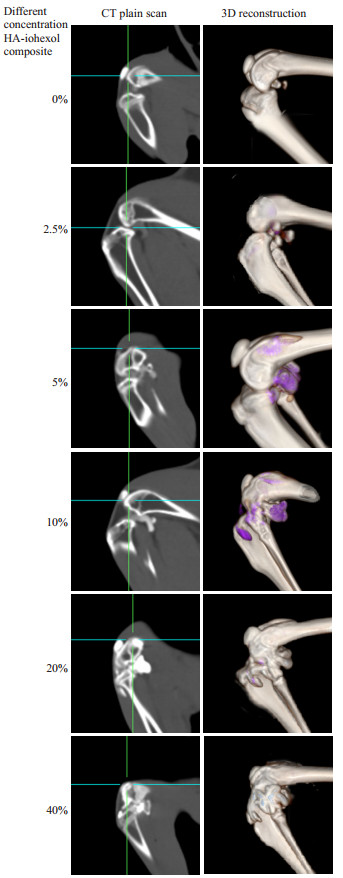
从CT平扫矢状位影像及三维重建图像(表 2)可见,碘海醇浓度为20%、40%时,显示为高密度影,无法与关节腔周围骨质区别;碘海醇浓度为2.5%时,因密度过低而无法观察;碘海醇浓度为5%、10%时,混合制剂密度与骨质能够良好区别,对比效果好,易于观察。为最大限度保持药物原始性状,从而实现模型的最佳拟合性,最终选择5%碘海醇浓度的HA-I制剂进行药物示踪。
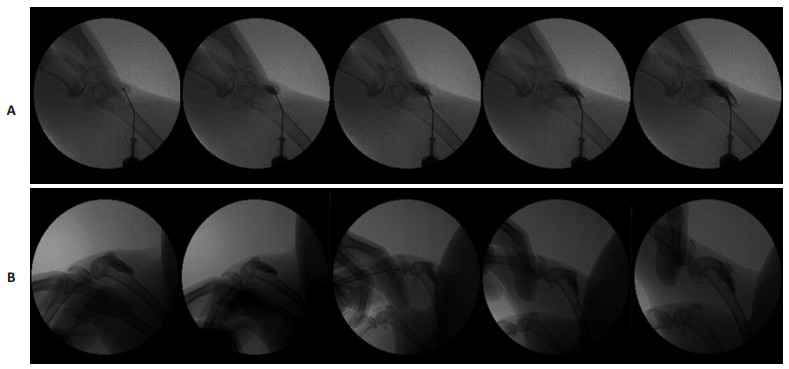
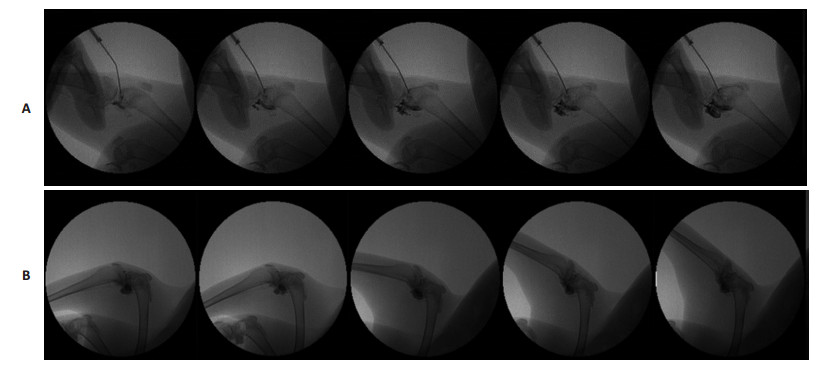
2.4 HA示踪模型的动态X线透视观察结果X线透视的动态摄像结果显示:以0.5 mL 5%碘海醇示踪的HA-I制剂可清楚显示HA药物进入关节腔,并向周围扩散和再分布的过程(图 5A)。膝关节屈伸运动后,髌骨下方给药的HA仍然主要存在于髌骨下方,仅少部分向四周扩散(图 5B)。而关节线给药的HA(图 6A),则主要向后关节腔转移(图 6B)。可见,本研究的药物示踪模型可有效甄别不同给药位点给药后HA在动物膝关节腔内分布特点的差异,示踪效果肯定。
|
图 4 不同碘海醇浓度下膝关节CT平扫及三维重建效果 Figure 4 CT plain scan and 3D reconstruction of rabbit knee joint after injection of HA-iohexol mixtures containing different concentrations of iohexol. |
|
图 5 X线透视下兔膝关节腔髌骨下给药的HA动态观察 Figure 5 Dynamic observation of HA administered through the patella medial approach by X-ray. A: Static; B: Knee movement. |
|
图 6 X线透视下兔膝关节腔关节线给药的HA分布动态观察 Figure 6 Dynamic observation of HA administered through the medial joint line approach by X-ray. A: Static; B: Knee movement. |
应用相同的示踪方法结合CT扫描和三维重建,结果(图 7)显示:膝关节屈伸运动后,经不同给药位点注射的HA,在关节腔内的分布范围存在差异,髌骨下方给药的HA主要分布在前关节腔,关节线给药的HA主要分布在后关节腔。
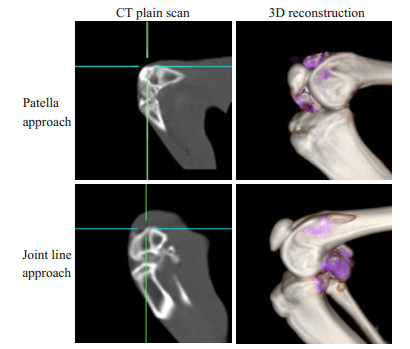
|
图 7 髌骨下给药及关节线给药的HA-I制剂在兔膝关节腔内分布的CT平扫及三维重建效果 Figure 7 CT plain scan and 3D reconstruction of rabbit knee joint showing the distribution of HA administered through the patella medial approach and medial joint line approach. |
CT三维重建所提示的药物分布范围与X线透视吻合,进一步证实当前HA药物示踪模型的有效性,可有效显示药物的分布范围,直观呈现不同给药位点带来的药物分布范围差异。
3 讨论膝关节腔内注射HA治疗KOA不仅安全性良好,并具有长期、稳定、可观的治疗效应[6]。然而,近年来不同文献针对HA治疗KOA的疗效却存在矛盾。Ishijima等[7]及Leighton等[8]指出HA治疗KOA疗效与NSAIDs类药物及激素封闭相当,镇痛效应卓越,同时具备更佳的安全性;Huang等[9]一项纳入200例亚洲KOA患者的临床试验指出,HA可持久缓解疼痛症状并改善膝关节功能。但Rutjes等[10]在一项系统评价中则认为HA治疗KOA并无显著临床疗效,反而带来相关严重不良反应;Kul-Panza等[11]也指出HA在KOA患者症状与膝关节功能改善方面疗效与安慰剂无异。
Alshami等[12]指出,KOA以软骨损害和丢失为特征,损伤部位包括髌股关节、胫股关节内侧间隙及外侧间隙软骨,不同的软骨损伤部位对应不同的临床表现。而临床工作中关节腔内注射HA治疗KOA包括髌骨下给药、关节线给药[13]等不同给药位点。回顾文献发现,以上所有临床研究均未标注HA的给药位点,那么是否存在可能性-不同的给药位点导致HA在关节软骨表面的分布及覆盖范围差异,进而造成疗效差异。因此,有必要观察不同给药位点相应的药物分布范围,为解决给药位点差异可能带来的疗效差异问题奠定基础。本实验以HA-I混合制剂[14]作为示踪剂,旨在探索一种通过CT扫描及X线透视观察HA在膝关节腔内分布情况的动物示踪模型。
HA为高分子聚合物,浓稠具有粘性,可溶于水;碘海醇属于非离子造影剂,其高密度特性使其在CT扫描及X线透视中清晰观察[15];两者混合不产生化学反应。实验结果显示HA-I混合制剂在CT平扫及X线透视图像上呈现一致性,具备作为直观、间接反映HA在关节腔内分布的示踪剂基本条件。
回顾文献,涉及膝关节腔解剖及给药位点的影像学研究大多采用CT辅助的关节造影术,如Vandeweerd等[16]报道运用腔内注射造影剂以研究山羊膝关节各个间室关系及不同给药途径成功率,但目前尚未见造影剂与HA混合以示踪其在膝关节内分布的影像学研究。本实验并未单纯采用造影剂(碘海醇)作为示踪剂,而选择HA与碘海醇混合这一示踪模式,原因在于:(1)碘海醇的CT值较高,在CT图像中呈现与骨质相似的高密度,不能很好与骨质区别,必须稀释至适合浓度以与骨质以及关节腔内软组织区别;(2)碘海醇本身为流质液体,弥散快,HA则质粘浓稠[17],碘海醇与HA混合后不但可被示踪观察,同时能够获得与HA相似的物理粘弹性,能够模拟HA在膝关节腔内的流动、扩散特点。
由于混合制剂中碘海醇的浓度与CT平扫及三维重建质量优劣有密切关系,因此模型成功建立的关键在于筛选出最适宜示踪剂浓度。本研究发现,低水平碘海醇浓度(0%、2.5%)下,HA-I混合制剂CT值较低,与软组织相当,其平扫及三维图像丢失大量原有药物分布信息,无法完整呈现药物分布概况;在高水平碘海醇浓度(20%、40%)下,HA-I混合制剂CT值高于胫骨皮质CT值,其平扫图像中基本仍可识别药物密度影,但在三维重建中因成像重叠,无法区分骨质与药物分布影,失去实验观察意义。与低水平及高水平浓度相比,碘海醇浓度为5%和10%的HA-I制剂在基本保留HA原有物理特性基础上,其CT值介于周围软组织与骨质CT值之间,既完整保留原有药物分布信息,又满足三维重建区分识别度需要,避免与骨质和关节周围软组织的混淆,实现良好的呈现,可作为本模型的合适示踪剂浓度。5%及10%碘海醇浓度的HA-I制剂均可提供药物与关节软组织、骨质之间的良好对比。考虑到实现模型的最佳拟合性,HA是本研究实验的观察对象,其质地稠,具有高粘弹性,而碘海醇则为流质液体,为最大限度保留HA的物理特性,从而更好地模拟HA在关节腔的实际分布趋势与特征,HA-I制剂的碘海醇浓度应尽量降低,因此本模型的最适宜示踪剂应为5%碘海醇浓度的HA-I制剂。
本模型以5%浓度的碘海醇掺入HA,依托X线透视和CT三维重建技术进行静态和动态观察,成功实现对HA药物在膝关节内分布过程和分布范围的示踪。X线透视和CT三维重建图像所提供的清楚信息,以及二者所展示药物分布范围的一致性,证实了该HA药物示踪模型的有效性。
传统观点认为膝关节内的各个间室互相交通,不论从何种给药位点注射,HA进入膝关节腔后药物将向四周均匀扩散并覆盖各个间室内软骨[18]。本研究实验中通过碘海醇示踪结合CT扫描及X线透视观察可见,不同给药位点注射HA-I制剂,可引起药物在膝关节腔的分布差异。髌骨下给药的HA主要分布于髌股关节,关节线给药的HA则主要分布于胫股关节,与传统观点相抵。这一基于实验动物的发现,在直接挑战传统观点的同时,为进一步的HA药物分布的人体实体研究提供了思路。本研究所建立的HA药物示踪模型,也为未来的人体研究奠定了方法学基础。
需要指出,当前模型还存在一定局限性:(1)根据实验观察,活体兔膝关节腔中HA-I混合制剂在35~40 min内会逐渐弥散、吸收,无法长时间动态观察药物的远期分布特征;(2)只能提供定性分布趋势,而未能获取定量分布数据。
综上所述,本研究以碘海醇浓度为5%的HA-I混合制剂作为示踪剂,结合CT扫描及X线透视技术,成功构建了玻璃酸钠在兔膝关节腔内分布的示踪模型。该模型可有效示踪HA在实验动物关节腔内的分布。当前动物模型动物所发现的给药位点差异影响HA在膝关节腔内分布范围差异的信息,也为进一步的人体实体研究提供了方法和思路。
| [1] | Altman RD, Rosen JE, Bloch DA, et al. A double-blind, randomized, saline-controlled study of the efficacy and safety of EUFLEXXA for treatment of painful osteoarthritis of the knee, with an open-label safety extension (the FLEXX trial)[J]. Semin Arthritis Rheum,2009, 39 (1) : 1-9. DOI: 10.1016/j.semarthrit.2009.04.001. |
| [2] | Navarro-Sarabia F, Coronel P, Collantes E, et al. A 40-month multicentre, randomised placebo-controlled study to assess the efficacy and carry-over effect of repeated intra-articular injections of hyaluronic acid in knee osteoarthritis: the AMELIA project[J]. Ann Rheum Dis,2011, 70 (11) : 1957-62. DOI: 10.1136/ard.2011.152017. |
| [3] | Jørgensen A, Stengaard-Pedersen K, Simonsen O, et al. Intraarticular hyaluronan is without clinical effect in knee osteoarthritis: a multicentre, randomised, placebo-controlled, double-blind study of 337 patients followed for 1 year[J]. Ann Rheum Dis,2010, 69 (6) : 1097-102. |
| [4] | Takaishi R, Aoyama T, Zhang X, et al. Three-dimensional reconstruction of rat knee joint using episcopic fluorescence image capture[J]. Osteoarthritis Cartilage,2014, 22 (10) : 1401-9. DOI: 10.1016/j.joca.2014.06.016. |
| [5] | Biedert R, Sigg A, Gal I, et al. 3D representation of the surface topography of normal and dysplastic trochlea using MRI[J]. Knee,2011, 18 (5) : 340-6. DOI: 10.1016/j.knee.2010.07.006. |
| [6] | Ray TR. Using viscosupplementation to treat knee osteoarthritis[J]. Phys Sportsmed,2013, 41 (4) : 16-24. DOI: 10.3810/psm.2013.11.2032. |
| [7] | Ishijima M, Nakamura T, Shimizu K, et al. Intra-articular hyaluronic acid injection versus oral non-steroidal anti-inflammatory drug for the treatment of knee osteoarthritis: a multi-center, randomized, open-label, non-inferiority trial[J]. Arthritis Res Ther,2014, 16 (1) : R18. DOI: 10.1186/ar4446. |
| [8] | Leighton R, Akermark C, Therrien R, et al. NASHA hyaluronic acid vs. methylprednisolone for knee osteoarthritis: a prospective, multi-centre, randomized, non-inferiority trial[J]. Osteoarthritis Cartilage,2014, 22 (1) : 17-25. DOI: 10.1016/j.joca.2013.10.009. |
| [9] | Huang TL, Chang CC, Lee CH, et al. Intra-articular injections of Sodium hyaluronate (Hyalgan®) in osteoarthritis of the knee. a randomized, controlled, double-blind, multicenter trial in the Asian population[J]. BMC Musculoskelet Disord,2011, 12 : 221. DOI: 10.1186/1471-2474-12-221. |
| [10] | Rutjes AW, Jüni P, Da Costa BR, et al. Viscosupplementation for osteoarthritis of the knee: a systematic review and meta-analysis[J]. Ann Intern Med,2012, 157 (3) : 180-91. DOI: 10.7326/0003-4819-157-3-201208070-00473. |
| [11] | Kul-Panza E, Berker N. Is hyaluronate Sodium effective in the management of knee osteoarthritis? A placebo-controlled doubleblind study[J]. Minerva Med,2010, 101 (2) : 63-72. |
| [12] | Alshami AM. Knee osteoarthritis related pain: a narrative review of diagnosis and treatment[J]. Int J Health Sci (Qassim),2014, 8 (1) : 85-104. DOI: 10.12816/0006075. |
| [13] | Toda Y, Tsukimura N. A comparison of intra-articular hyaluronan injection accuracy rates between three approaches based on radiographic severity of knee osteoarthritis[J]. Osteoarthritis Cartilage,2008, 16 (9) : 980-5. DOI: 10.1016/j.joca.2008.01.003. |
| [14] | Park KD, Ahn JK, Lee SC, et al. Comparison of ultrasound-guided intra-articular injections by long axis in plane approach on three different sites of the knee[J]. Am J Phys Med Rehabil,2013, 92 (11) : 990-8. DOI: 10.1097/PHM.0b013e3182923691. |
| [15] | Dauffenbach J, Pingree MJ, Wisniewski SJ, et al. Distribution pattern of sonographically guided iliopsoas injections: cadaveric investigation using coned beam computed tomography[J]. J Ultrasound Med,2014, 33 (3) : 405-14. DOI: 10.7863/ultra.33.3.405. |
| [16] | Vandeweerd JM, Kirschvink N, Muylkens B, et al. A study of the anatomy and injection techniques of the ovine stifle by positive contrast arthrography, computed tomography arthrography and gross anatomical dissection[J]. Vet J,2012, 193 (2) : 426-32. DOI: 10.1016/j.tvjl.2011.12.011. |
| [17] | Park H, Choi B, Hu J, et al. Injectable chitosan hyaluronic acid hydrogels for cartilage tissue engineering[J]. Acta Biomater,2013, 9 (1) : 4779-86. DOI: 10.1016/j.actbio.2012.08.033. |
| [18] | Fenn S, Datir A, Saifuddin A. Synovial recesses of the knee: Mr imaging review of anatomical and pathological features[J]. Skeletal Radiol,2009, 38 (4) : 317-28. DOI: 10.1007/s00256-008-0570-0. |
 2016, Vol. 35
2016, Vol. 35
