溶质转运体26A (SLC26A)家族是一个相对年轻的蛋白家族,人们在近二十几年才对它有所了解[1]。迄今为止发现的哺乳动物SLC26A转运体家族的编码基因共有11个,SLC26A1-A11,其中A10是假基因[2]。SLC26A转运体均为膜蛋白,分布在消化、听觉、内分泌、泌尿、骨骼、生殖等系统的上皮细胞膜上,某些成员如A2、A11的分布几乎涵盖了各个组织和器官[3]。SLC26A转运体家族的经典功能是转运阴离子,当阴离子与SLC26A转运体结合后会导致蛋白出现构象变化从而将离子从膜的一侧转运到另一侧。现已发现它可以转运卤化物(Cl-,I-),硫氰根(SCN-),一价含氧阴离子(OH-,HCO3-,甲酸盐,乙醛酸)和二价含氧阴离子(SO42-,草酸盐)且拥有一定的离子选择性[4-6]。由于其生理功能非常重要,因此SLC26A转运体的缺失或功能异常会导致多种严重的疾病[7]。根据生物信息学数据分析,SLC26A转运体是一种大分子蛋白,包含700~1000个氨基酸[8]。根据推测,其基因编码的多肽包括胞质内的N-端和C-端以及结构未知的跨膜区域,预计这个区域的蛋白跨膜10~14次[3]。由于蛋白结晶较为困难,因此人们对这一家族的蛋白结构以及转运离子的机制并不清楚。
为了更好地研究SLC26A家族转运功能的分子机制,在本实验中,我们构建了瞬时表达SLC26A转运体质粒的HEK-293细胞并用全细胞膜片钳方法检测其功能。结果发现,SLC26A转运体与离子结合的能力与其在细胞膜上表达的程度呈正相关,并表现出一定的离子选择性。本实验为后续研究SLC26A蛋白结构域的功能分区以及转运机制奠定了基础。
1 材料和方法 1.1 材料(1) HEK-293细胞购自美国ACTT公司;(2)人类SLC26A家族A2、A4、A5、A6、A7、A9、A11全长的cDNA由美国GenScript公司合成(Piscataway,NJ);(3) pEGFP-N1载体购自BD Biosciences公司;(4)E.coli DH5α感受态细胞购自博大泰克公司。
1.2 主要试剂和仪器(1) 试剂Plasmid Midi Kit (10)质粒提取试剂盒购自Omega公司,卡那霉素购自Sigma公司;DMEM、胎牛血清、0.25%的胰蛋白酶,Lipofectamine 2000,均为Invitrogen公司产品;电生理记录配置细胞内外液的药品均来自Sigma公司;(2)仪器激光共聚焦显微镜(Olympus, JAP),CO2培养箱(Thermo, USA),P-97微电极拉制仪(Sutter Instrument, USA),数模转换器(Digidata1322A, USA),荧光显微镜(NIKON, JAP),放大器(Muticlamp 200B, USA),PCR仪(BIO-RAD, USA)。
1.3 方法 1.3.1 系统进化树的构建将从NCBI上获得的人类的SLC26A家族的蛋白序列(序列编码列在表 1中)输入Clustalx 1.83进行多序列比对,把比对结果导入MEGA5.05中,用最大相似性方法计算并获得无根的系统进化树。
| 表 1 SLC26A多功能阴离子交换体或阴离子通道基因家族 Table 1 SLC26A multifunctional anion exchanger/anion channel gene family |
将实验所需的SLC26A家族的cDNA与pEGFP-N1连接。以构建SLC26A5(prestin)为例,首先用引物5'-TCGTCATCGTGGCAGGAGTGAACGCAACC-3'和5'-GGTTGCGTTCACTCCTGCCACGATGACGATGTCATCG-3' [9],给A5(prestin)编码序列的始末端增加两个限制性酶切位点ScaⅠ和Hind Ⅲ。接着用PCR技术进行基因的扩增并回收产物。然后将回收产物用限制性内切酶ScaⅠ和Hind Ⅲ进行双酶切并用Cycle pure Kit纯化酶切产物同时将载体pEGFP-N1也用限制性内切酶ScaⅠ和Hind Ⅲ进行双酶切并回收。用T4连接酶将A5(prestin)的基因与pEGFP-N1连接,最终A5(prestin)全长的编码片段被克隆在pEGFP-N1的XhoⅠ和BamHⅠ位点。第2步是将连接产物进行转化并筛选鉴定。按同类研究的方法将质粒转化并筛选后,将长出的单克隆菌落制成菌液送公司测序,筛选药物为卡那霉素。第3步是制备转染用的质粒DNA。取测序正确的克隆菌液接种到含有卡那霉素(50 mg/μL)的LB培养板上培养12 h,挑选大小合适的单个菌落接种到含有卡那霉素(50 mg/μL)的LB培养基中用摇床摇12 h,最后用质粒提取试剂盒提取质粒。
1.3.3 细胞培养及转染HEK-293细胞培养在7 mL含10%胎牛血清的DMEM溶液的培养瓶(75 mm2)中。转染前,将培养瓶中对数生长期的HEK-293细胞用血球计数板计数,将5×105细胞接种在培养皿内,培养过夜,当细胞覆盖皿底面积的80%~90%时,进行转染。转染时将10 μL lipofectamine 2000和4 μg质粒用175 μL无血清DMEM混匀加入待转染细胞的培养皿中,6 h后换完全培养基继续培养。
1.3.4 Confocal图像的采集转染后48 h,用激光共聚焦显微镜获取HEK-293细胞图片。拍照前,先将转染后的细胞用1 mL 0.25%胰酶消化1 min,接着用4 mLDMEM将培养皿内的细胞取出并离心,最后用1 mLDMEM将离心后的细胞制成细胞悬液并转移至5个Confocal专用培养皿中立即用共聚焦显微镜观察并摄片。摄片时将细胞置于激发波长为488 nm的蓝光下,先在40倍的物镜下选择呈现绿色荧光的细胞,然后转换成60倍的油镜拍片并保存。每个质粒均随机选取有荧光表达的50个细胞摄片,所有图像获取时的亮度、对比度、增益、放大倍数等参数均一致。保存的Confocal图片用Image J软件分析其膜上的平均荧光强度来反映蛋白表达程度。
1.3.5 全细胞膜片钳记录转染48 h后可做电生理记录。记录前,将转染后的细胞用0.25%的胰酶消化50 s,并取一半细胞离心后加1 mL细胞外液制成细胞悬液并转移至自制记录槽中。将记录槽放与荧光显微镜下,给予细胞激发波长为488 nm的蓝光,选择表达有绿色荧光的细胞进行记录。记录的细胞在40倍的水浸物镜下呈圆形,表面光滑,颗粒少并沉底。记录时,在荧光显微镜下,通过微操纵器MP285(SUTTER, USA)使玻璃微电极接触细胞并施加负压形成高阻封接(大于1 GΩ),稳定后破膜形成全细胞记录。形成全细胞记录后,钳制电压为-70 mV,给予两个正弦波的电压刺激(峰值在10 mV,频率为390.6和781.2 Hz),记录膜电容。全细胞记录所用的记录电极为硼硅酸盐毛细玻璃管,用微电极拉制仪P-97拉制成尖端直径为0.5~1 μm并抛光,充灌电极内液后电阻在4~6 MΩ。细胞外液成分为(mmol/L):124 NaCl,2 MgCl2,10 CsCl,20 tetraethylammonium (TEA),10 HEPES和10 4-aminopyridine (4-AP),外液中含SO42-时将124 NaCl换成64 NaCl和40 Na2SO4。电极内液成分为(mmol/L):140 CsCl,2 MgCl2,10 EGTA和10 HEPES。刺激与记录系统:AXON200B,数模转换器为Axon1322。
1.3.6 数据采集数据的获得使用jClamp (Scisoft, NewHaven, CT)。记录指标为膜电容。以前有研究表明,当细胞的膜电位改变,如果离子与膜蛋白结合并进出蛋白会导致细胞的膜电容出现非线性改变,类似于一条钟形曲线,称为非线性膜电容(NLC)[10],NLC可以用一个与电压相关的非线性移动电荷的二次Boltzmann方程的一阶导数来表示[11, 12]。膜电容方程如下:
| $ {C_m} = {C_{lin}} + \frac{{{Q_{\max }}a}}{{\exp \left[ {a\left( {{V_m} - {V_{V2}}} \right)} \right]{{\left\{ {1 + \exp \left[ { - a\left( {{V_m} - {V_{V2}}} \right)} \right]} \right\}}^2}}} $ |
其中Qmax表示转运时的最大电荷,V1/2表示达到电压依赖膜电容的峰值时所对应的电压,Clin表示线性膜电容;α=ze/kT是电压依赖的电荷转运的斜率,其中k是Boltzmann常数,T是绝对温度,z是电荷移动的效价,e是电子电荷。由于线性膜电容(Clin)与细胞的大小成比例,不同的细胞大小会影响NLC的大小,因此我们用标准化的非线性膜电容来分析(NLC/Clin),此值为曲线的峰值。
1.3.7 统计学分析实验结果用均数±标准差表示,采用两独立样本t检验的统计学方法对两组数据进行比较,P < 0.05表示差异有统计学意义。数据统计分析通过统计学软件SPSS13.0软件完成。作图采用origin8.0,COARDRAW等软件。
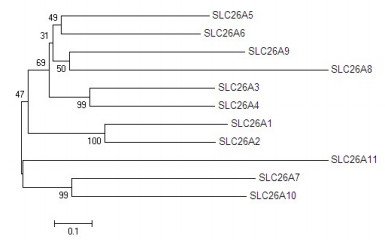
2 结果 2.1 SLC26A转运体的序列分析虽然SLC26A转运体家族成员均担负着将阴离子从表皮细胞膜的一侧转运到另一侧的功能,但不同成员转运离子的种类和机制各不相同(表 1)。这提示虽然同属一个蛋白家族,但不同成员之间在行使生理功能的空间结构上有差别。蛋白的空间结构和生理功能很大程度上由氨基酸一级序列决定,因此我们首先对人类SLC26A蛋白家族所有成员做序列相关性比较。图 1表示将SLC26A家族的氨基酸序列进行多序列比对后获得的无根系统进化树。系统进化树中每个节点表示一个分类单元。分支的长度代表进化过程中氨基酸改变的数量。节点上的数字表示的是bootstrap的值。结果发现,SLC26A家族的保守性相对较低,各成员之间只有21%~43%的氨基酸序列相同。依据系统进化树的节点以及各成员的功能特点,我们将SLC26A家族分为6个亚组(图 1):A1和A2,为硫酸根和草酸根的转运体;第2组是A3和A4,为Cl-/HCO3-交换体;第3组成员是A5和A6,转运底物为Cl-;第4组为A7,除了转运Cl-、HCO3-,硫酸根外还是Cl-通道;第5组为A8和A9;A11与其他成员之间序列相似性最低,亲缘关系最远,单独作为一组。在下面的实验中,我们从每一组中选取1~2成员作为代表,以SLC26A2、A4、A5、A6、A7、A9、A11作为研究对象来考察这些蛋白在HEK-293细胞中的表达情况及其功能。
|
图 1 人类的SLC26A转运体家族的进化树 Figure 1 Phylogenetic tree of the human SLC26A transporter family. A protein multiple sequence alignment was generated using the Clustalx 1.83 program with SLC26A protein sequences from NCBI listed in Tab.1. The evolutionary tree was created using Maximum likelihood methods of MEGA5.05 and analyzed using 500 bootstraps. In this unrooted phylogenetic tree, each node represents a taxon, and the scale of the branch represents the number of amino acid changes. The bootstrap supporting values are shown at each branching point. The scale bar indicates the number of substitutions per site (0.1 means 10% changes observed between two sequences) for measuring the branch length. |
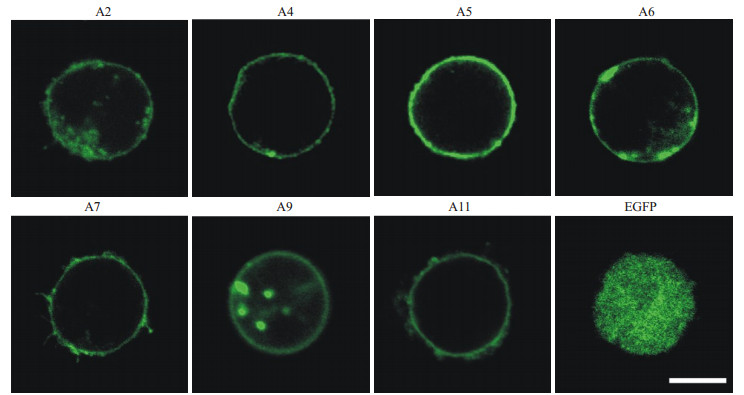
使用瞬时转染技术,我们将带有SLC26A转运体基因的pEGFP-N1质粒导入培养的HEK-293细胞中,培养2 d待质粒稳定表达后,在荧光显微镜下观察细胞中的绿色荧光,以检测SLC26A转运体在细胞中的表达情况。不带SLC26A的空载体作为阴性对照同时观察。图 2显示表达各SLC26A转运体的典型细胞的共聚焦显微镜图片。结果表明,各质粒,包括阴性对照的空载体都能在细胞中表达,细胞显示出融合的GFP蛋白绿色荧光。不同质粒在HEK-293细胞中的转染效率相差不大,在40%~55%之间。A4,A5,A6,A7和A11转染的细胞,主要在细胞膜上观察到荧光,在显微镜下呈现出环状(图 2)。而A2和A9转染的细胞,除了在膜上有荧光外,在细胞质中也有GFP表达。而EGFP空载体的荧光则主要出现在细胞质中。这表明不同的转运体蛋白在细胞内合成并运输到细胞膜上的过程存在一定差异。转运体蛋白要行使正常的生理功能,必须定位和组装在细胞膜上。细胞膜上的GFP荧光亮度代表了处在正确位置上转运体的数量。因此我们计算了转染并表达转运体HEK细胞上细胞膜的荧光强度。结果发现A5,A6和A7的荧光强度最高,在100~120之间,A2,A4,A9,A11的膜表达较强,在50~100之间。而EGFP空载体转染的细胞荧光则集中在细胞质中,膜上荧光强度为14.73±6.25,基本没有表达。不同转运体在转染后HEK-293细胞中的表达情况见表 2。
|
图 2 在转染有SLC26A基因家族的人胚肾293细胞(HEK-293)上所获得的不同基因的表达情况 Figure 2 Confocal microscopy images showing HEK-293 cells transfected by SLC26A2 (A2), SLC26A4 (A4), SLC26A5 (A5), SLC26A6 (A6), SLC26A7 (A7), SLC26A9 (A9), SLC26A11 (A11) and enhanced green fluorescent protein (EGFP). Bar: 10 μm. |
| 表 2 SLC26A转运体在HEK-293细胞中的表达情况和NLC Table 2 NLC and expression of SLC26A family in HEK-293 cells |
不管是离子转运体还是交换体,其工作的一个普遍机制都是离子进入蛋白内部,与蛋白的结合部位相互作用,引发蛋白质的构象产生改变,将离子由膜的一侧翻转或运输到另一侧并释放。这个过程与离子经过离子通道到达膜的另一侧的一个共同特征是,当离子穿过膜或者进入膜蛋白时,细胞膜的电容特性会发生改变。由于SLC26A蛋白家族转运的是带电荷的阴离子,阴离子在电场的驱动下会有穿过膜或者进出转运体蛋白的趋势。因此,我们可以用全细胞膜片钳技术,改变表达SLC26A转运体的HEK细胞的膜电位,检测细胞膜电容的变化。如果当膜电位变化时,我们检测到膜电容的改变,说明离子能够进入到SLC26A转运体中并与结合部位发生作用。因为SLC26A转运体的结合部位对离子具有选择性,因此这种膜电容的改变与膜电压的关系往往是非线性的,即一条钟形的电容曲线,称为非线性膜电容(NLC)。电容改变的幅度越大,说明转运的离子数量越多,转运体与离子结合或转运的能力也越强。
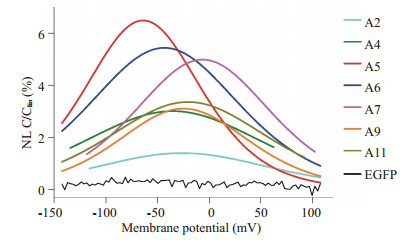
图 3表现的是用全细胞膜片钳技术改变细胞的膜电位时,表达不同SLC26A转运体及EGFP空载体的多个HEK细胞的平均膜电容。当电极内液和细胞外液中阴离子均为Cl-时,我们看到只表达EGFP的细胞膜电容没有呈现出变化,即离子没有与膜上蛋白发生相互作用。但是在膜上表达SLC26A转运体的HEK细胞中,我们却记录到了典型的钟形电容曲线(图 3)。为了排除所记录的细胞大小不同带来的影响,我们将测得的电容除以线性部分(代表的是膜面积的大小),得到多个细胞的平均非线性膜电容-膜电压曲线。我们测量非线性膜电容曲线的峰值来衡量该细胞与离子相互作用的能力。结果发现A5的NLC峰值最大,为6.45±3.75(Mean±SD,n=8)。A6和A7与A5的值较为接近,分别为5.36±1.32(n=8)和4.99±1.32(n=7)。A4,A9和A11的值较小,而最小的为A2,只有1.39±0.20(n=7)。每种转运体所记录电容值的细胞数及非线性膜电容幅度见表 2。
|
图 3 非线性膜电容 Figure 3 Nonlinear capacitance (NLC). Examples of NLC obtained from HEK-293 cells transfected by SLC26A2 (A2), SLC26A4 (A4), SLC26A5 (A5), SLC26A6 (A6), SLC26A7 (A7), SLC26A9 (A9), SLC26A11 (A11), respectively. HEK-293 cells transfected by EGFP were used as the negative control. Linear capacitance (Clin) was subtracted from the response and only NLC was plotted. NLC was normalized by Clin. |
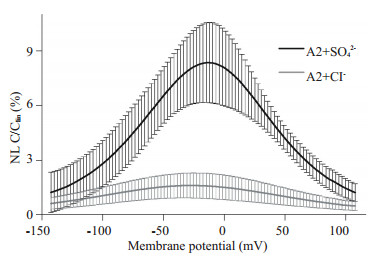
非线性膜电容曲线的幅度反映了进出SLC26A转运体蛋白并与之相互作用的离子数量,这与单位膜面积上表达的转运体蛋白量相关。在表 2中我们总结了膜蛋白的荧光强度与非线性膜电容变化幅度的关系,结果也印证了这一点:在细胞膜上表达强的A5、A6和A7记录到了最大的膜电容变化;而表达较弱的A4、A9和A11则表现出较小的膜电容变化。但是表达A2的细胞膜上荧光强度较强,而电容的变化幅度却很小。其可能的原因是A2主要转运硫酸根,其对氯离子的结合及转运能力较弱。当细胞内外阴离子均以Cl-为主时,进出A2蛋白并与之发生结合作用的离子数量很少,这样对膜电容的影响也较小。为了证实这个猜想,我们将细胞外液中的Cl-替换成硫酸根离子并记录膜电容随膜电压的变化曲线。图 4中所示结果表明,当硫酸根作为主要阴离子存在时,A2的非线性膜电容峰值由平均1.39(SD=0.20,n=7)变为8.47(SD=2.21,n=9),并有显著性差异(P < 0.001,t检验)。
|
图 4 将细胞外液中氯离子替换成硫酸根离子后A2的非线性膜电容的变化 Figure 4 NLC changes of A2 after substitute Cl- with SO42-. NLC was measured using extracellular solutions with Cl- or SO42-. NLC of A2 was normalized by Clin and the curves were plotted as mean±SD (n=7 and 9 for Cl- and SO42-). |
自从上个世纪九十年代Sat-1(SLC26A1)作为硫酸根离子转运体被报道并首次克隆出来后[13],SLC26A家族的其他成员才逐渐被人们所研究和认识。虽然SLC26A家族是一个较为年轻的转运体家族,但其广泛分布在人体多种器官的上皮细胞中(表 1),转运以Cl-、HCO3-和硫酸根为主的阴离子[2, 14]。由于Cl-和HCO3-是人体组织液中最重要的阴离子,承担着维持渗透压和PH平衡的作用,因此SLC26A转运体的缺失或功能异常,往往导致上皮组织病变,引起包括囊性纤维化、耳聋、前庭大水管综合征、氯性腹泻等在内的多种严重疾病。由于SLC26A转运体为膜蛋白,结晶困难,因此目前对这个转运体家族的结构及功能机制了解较少。
SLC26A转运体家族一共有11个成员,其中A10是一个假基因。通过对人类SLC26A转运体家族的氨基酸序列分析,我们发现SLC26A转运体之间保守性相对较低(图 1)。这提示不同的成员之间,空间结构及转运离子的分子机制存在较大的不同。这种不同也是系统研究这个转运体家族结构和功能机制较为困难的一个重要原因。除了各成员之间变异性较大外,同一转运体在不同物种中,一级结构也存在较大的差别。有报道表明,鼠和人的SLC26A转运体之间,氨基酸的同一性只有76%,低于其他蛋白86%的平均相似性[15]。一级结构的不同预示着不同动物种类中SLC26A的功能有差别。以功能研究较为清楚的SLC26A5(prestin)为例,在非哺乳动物中,A5(prestin)转运以Cl-为主的一价阴离子。但在哺乳动物中,A5特异性地表达在耳蜗外毛细胞的细胞膜上,转运离子功能大大下降[10]。但是胞内的Cl-能与A5相互作用,引起蛋白在长和短两种构象之间的快速转换,从而驱动外毛细胞胞体进行伸缩运动。在这个过程中,A5(prestin)行使马达蛋白的功能,被认为是哺乳动物听觉中耳蜗放大的分子基础[16]。
将功能性蛋白表达到细胞系中来研究其功能是目前生物医学研究中常用的手段。我们使用脂质体瞬时转染的方法将代表性的SLC26A转运体质粒表达到HEK-293细胞中,通过观察融合的绿色荧光的方法来检测表达的情况。由于SLC26A转运体是膜蛋白,需要定位在细胞膜上才能行使其功能,因此对转染细胞功能检测的一个重要前提条件是转运体蛋白要表达在细胞膜上。本实验结果证明,与绿色荧光蛋白只表达在细胞质不同,我们构建的SLC26A转运体均能表达在细胞膜上,且具有较高的转染效率和表达强度(图 2)。这一结果为我们在转染细胞中研究SLC26A转运体与离子相互作用提供了可能。
检测转运体的功能,一种方法是直接测量跨过膜的离子数量[9, 10, 17]。但这种方法对实验操作精度要求较高,不同质粒转染效率不同也会带来较大误差。在本实验中,我们通过测量转染细胞的膜电容来测量不同转运体与离子的作用能力。当带电离子在膜电位的驱动下进入膜上的转运体蛋白内部时,膜的电容呈现一个非线性的变化。这种通过测量膜电容来衡量转运体或者离子通道功能的方法,已经被广泛报道[9, 17-20]。非线性膜电容的幅度大小反映了进入转运体蛋白内部的离子数量,是衡量转运体与离子相互作用的重要指标[9, 17, 21]。我们的结果显示,表达在膜上的各SLC26A转运体都表现出相当幅度的非线性膜电容幅度,而且幅度的大小与转运体在细胞膜上的表达强度呈正相关。实验中我们还发现,在细胞膜上有较强表达的A2,在Cl-作用下非线性膜电容幅度很小。当用SO42-替换Cl-后,我们发现表达A2的细胞非线性膜电容有显著增大。即使考虑到硫酸根带两个电荷,该增加的幅度也有显著统计学意义。这说明,膜上表达的转运体蛋白不仅具有与离子相互作用的能力,而且还表现出与在原位组织上相似的离子选择性。这一结果进一步说明我们的实验方法能很好的检测SLC26A转运体的生理功能。本实验第1次通过电生理学实验方法,系统报道了SLC26A转运体家族与转运离子相互作用的生理功能,建立了在HEK-293细胞系中表达SLC26A转运体家族的研究方法,为后续研究SLC26A转运体家族的结构和功能的关系奠定了基础,也为SLC26A家族相关疾病致病机制以及治疗方法提供了新的视角。
| [1] | Kere J. Overview of the SLC26 family and associated diseases[J]. Novartis Found Symp,2006, 273 : 2-11. DOI: 10.1002/SERIES1767. |
| [2] | Mount DB, Romero MF. The SLC26 gene family of multifunctional anion exchangers[J]. Pflugers Arch,2004, 447 (5) : 710-21. DOI: 10.1007/s00424-003-1090-3. |
| [3] | Alper SL, Sharma AK. The SLC26 gene family of anion transporters and channels[J]. Mol Aspects Med,2013, 34 (2/3) : 494-515. |
| [4] | Chernova MN, Jiang L, Friedman DJ, et al. Functional comparison of mouse slc26a6 anion exchanger with human SLC26A6 polypeptide variants: differences in anion selectivity, regulation, and electrogenicity[J]. J Biol Chem,2005, 280 (9) : 8564-80. DOI: 10.1074/jbc.M411703200. |
| [5] | Ohana E, Yang D, Shcheynikov N, et al. Diverse transport modes by the solute carrier 26 family of anion transporters[J]. J Physiol,2009, 587 (Pt 10) : 2179-85. |
| [6] | Ohana E, Shcheynikov N, Yang D, et al. Determinants of coupled transport and uncoupled current by the electrogenic SLC26 transporters[J]. J Gen Physiol,2011, 137 (2) : 239-51. DOI: 10.1085/jgp.201010531. |
| [7] | Dawson PA, Markovich D. Pathogenetics of the human SLC26 transporters[J]. Curr Med Chem,2005, 12 (4) : 385-96. DOI: 10.2174/0929867053363144. |
| [8] | Dorwart MR, Shcheynikov N, Yang D, et al. The solute carrier 26 family of proteins in epithelial ion transport[J]. Physiology (Bethesda),2008, 23 : 104-14. DOI: 10.1152/physiol.00037.2007. |
| [9] | Tang J, Pecka JL, Tan XD, et al. Engineered pendrin protein, an anion transporter and molecular motor[J]. J Biol Chem,2011, 286 (35) : 31014-21. DOI: 10.1074/jbc.M111.259564. |
| [10] | Tan XD, Pecka JL, Tang J, et al. From zebrafish to mammal: functional evolution of prestin, the motor protein of cochlear outer hair cells[J]. J Neurophysiol,2011, 105 (1) : 36-44. DOI: 10.1152/jn.00234.2010. |
| [11] | Schweinfest CW, Henderson KW, Suster S, et al. Identification of a colon mucosa gene that is down-regulated in colon adenomas and adenocarcinomas[J]. Proc Natl Acad Sci USA,1993, 90 (9) : 4166-70. DOI: 10.1073/pnas.90.9.4166. |
| [12] | Hoglund P, Haila S, Socha J, et al. Mutations of the down-regulated in adenoma (DRA) gene cause congenital chloride diarrhoea[J]. Nat Genet,1996, 14 (3) : 316-9. DOI: 10.1038/ng1196-316. |
| [13] | Bissig M, Hagenbuch B, Stieger B, et al. Functional expression cloning of the canalicular sulfate transport system of rat hepatocytes[J]. J Biol Chem,1994, 269 (4) : 3017-21. |
| [14] | Dorwart MR, Shcheynikov N, Wang Y, et al. SLC26A9 is a Cl (-) Channel regulated by the WNK kinases[J]. J Physiol,2007, 584 : 333-45. DOI: 10.1113/jphysiol.2007.135855. |
| [15] | Makalowski W, Boguski MS. Synonymous and nonsynonymous substitution distances are correlated in mouse and rat genes[J]. J Mol Evol,1998, 47 (2) : 119-21. DOI: 10.1007/PL00006367. |
| [16] | Dallos P, Prestin FB. A new type of motor protein[J]. Nat Rev Mol Cell Biol,2002, 3 (2) : 104-11. DOI: 10.1038/nrm730. |
| [17] | Tang J, Pecka JL, Fritzsch B, et al. Lizard and frog prestin: evolutionary insight into functional changes[J]. PLoS One,2013, 8 (1) : e54388. DOI: 10.1371/journal.pone.0054388. |
| [18] | Chambard JM, Ashmore JF. Sugar transport by mammalian members of the SLC26 superfamily of anion-bicarbonate exchangers[J]. J Physiol,2003, 550 (3) : 667-77. DOI: 10.1113/jphysiol.2003.039321. |
| [19] | Shcheynikov N, Yang D, Wang YX, et al. The Slc26a4 transporter functions as an electroneutral Cl-/I-/HCO3- exchanger: role of Slc26a4 and Slc26a6 in I-and HCO3- secretion and in regulation of CFTR in the parotid duct[J]. J Physiol,2008, 586 (16) : 3813-24. DOI: 10.1113/jphysiol.2008.154468. |
| [20] | Schaechinger TJ, Oliver D. Nonmammalian orthologs of prestin (SLC26A5) are electrogenic divalent/chloride anion exchangers[J]. Proc Natl Acad Sci USA,2007, 104 (18) : 7693-8. DOI: 10.1073/pnas.0608583104. |
| [21] | Beurg M, Tan XD, Fettiplace R. A prestin motor in chicken auditory hair cells: active force Generation in a nonmammalian species[J]. Neuron,2013, 79 (1) : 69-81. DOI: 10.1016/j.neuron.2013.05.018. |
 2016, Vol. 35
2016, Vol. 35
