结直肠癌日益成为危害人类健康的重大杀手,于全球已成为病死率居第四的恶性肿瘤[1]。尽管如此,关于结直肠癌发生发展的具体机制,在很大程度上仍然不清。胶原三股螺旋重叠蛋白(CTHRC1)首见于动脉炎,通过抑制胶原蛋白的表达促进细胞迁移[2]。其在诸多实体肿瘤中异常表达,CTHRC1在肝癌、胃癌、胰腺癌、非小细胞肺癌、乳腺癌、结直肠癌等中已成为独立的预后或治疗评估指标[3-8]。本研究通过检测CTHRC1在结直肠癌组织和细胞的表达情况,筛选LOVO作为操作细胞株,采用shRNA敲低CTHRC1的表达后,进一步研究其对细胞增殖、迁移、侵袭的作用变化及其可能参与的细胞信号通路。
1 材料和方法 1.1 材料 1.1.1 一般资料20例新鲜结直肠癌组织及配对的正常组织取自南方医院2013年3月~2014年2月的结直肠癌手术标本,取材后短暂置于液氮中转移至-80 ℃冰箱储存。患者年龄范围30~82岁,中位年龄56岁。手术前均未经过放化疗治疗,术后病理诊断为癌。
1.1.2 细胞系及载体人结直肠癌细胞株HT29、LS174T、SW480、SW620、LOVO均购自美国ATCC公司。短发卡RNA(shRNA):pGPU6-CTHRC1-shRNA及阴性对照:pGPU6-shNC购自苏州吉玛公司。pGPU6-CTHRC1-shRNA序列为:5'-GCAGCGTTGG TATTTCACATTTCAAGAGAATGTGAAATACCAA CGCTGTT-3' pGPU6-shNC序列为:5'-GTTCTCCGA ACGTGTCACGTCAAGAGATTACGTGACACGTT CGGAGAATT-3'
1.1.3 试剂RMPI 1640培养基及胎牛血清购自Hyclone公司,Lipofectamine2000购自Invitrogen公司,总RNA提取试剂RNAisoTM Plus、RNA逆转录试剂PrimeScriptTM RT Master Mix、real-time PCR试剂SYBR® Premix Ex TaqTM Ⅱ及CTHRC1和GAPDH引物均购自日本Takara公司。CCK-8试剂盒买自南京凯基公司,Transwell小室购自Coring公司,基质胶购自BD公司。兔抗人CTHRC1、GAPDH多克隆抗体购自Proteintech公司。兔抗人E-cadherin、N-cadherin、vimentin、β-catenin、ERK1/2、P-ERK1/2多克隆抗体购自美国bioworld公司。
1.2 方法 1.2.1 细胞培养5株结直肠癌细胞株均以含10%胎牛血清的RMPI 1640培养基,在37 ℃、5% CO2饱和湿度的条件下适时传代培养,细胞状态良好时用于实验。
1.2.2 RT-PCR检测CTHRC1在组织里和细胞的表达按照Takara公司的说明书,以RNAisoTM Plus提取20对组织或细胞里的总RNA,然后以PrimeScriptTM RT Master Mix制备cDNA,反应体系如下:RNA 0.5 μg;5× PrimeScript RT Master Mix 2 μl,加ddH2O至总体积10 μl,反应条件为:37 ℃ 15 min,85 ℃ 5 s,反应产物加双蒸水40 μl稀释5倍后用于qRT-PCR。以SYBR® Green法进行PCR反应,反应体系如SYBR® Premix Ex TaqTM Ⅱ。反应条件为:预变性95 ℃ 30 s,变性95 ℃ 5 s,延伸60 ℃ 34 s,共40个循环。
1.2.3 Western Blotting检测CTHRC1在组织和细胞的表达以RIPA加蛋白酶抑制剂和磷酸酶抑制剂以适当比例混合后为裂解液,提取组织或细胞总蛋白,以BCA法测量蛋白浓度。每组蛋白上样30 μg,以10% SDSPAGE胶电泳后,恒流转移到PVDF膜上,以含10% TBST脱脂牛奶室温封闭1 h,以相应的一抗(1:1000)4 ℃孵育过夜,再以过氧化物酶标记的羊抗兔二抗(1: 5000)室温孵育1 h,以10% TBST洗3遍,每次10 min。以GAPDH为内参,SynGene显影仪显影。
1.2.4 细胞转染以Lipofectamine2000为转染试剂,以相应说明书为基准。转染前24 h以状态较好的LOVO细胞接种于6孔板,待细胞汇合度达到70%~90%时,以无血清基础培养基为溶剂将4 μg shRNA与10 μl Lipofectamine2000混合,室温孵育20 min后添加入6孔板内,4~6 h后更换为完全培养基。转染48~72 h后进行下一步检测。
1.2.5 CCK-8检测结直肠癌细胞增殖能力将已处理过的细胞以每孔2×103/100 μl的密度接种于96孔板中,选取第1,2,3,4,5 d固定时间点进行检测。每孔设3个复孔。检测前弃去原来培养基,将100 μl完全培养基与10 μl CCK-8试剂混合后加入,于37℃孵箱孵育2 h,使用酶标仪于450 nm检测OD值,每板设空白对照。
1.2.6 细胞迁移和侵袭实验将已处理过的细胞消化后,均匀计数。以无血清基础培养基将细胞浓度稀释为5×105/ml,吸取200 μl分别接种到不含基质胶和已预先铺设好基质胶Matrigel的transwell上室,下室加入600 μl含20%胎牛血清的完全培养基。于37 ℃孵箱孵育24 h后,取出小室,弃去孔中培养基,加入500 μl甲醇固定小室下室面,0.5%结晶紫染色30 min,用棉签轻轻檫去上室未迁移细胞,PBS洗涤。显微镜下随机选取3~5个视野计数穿过膜的细胞。
1.2.7 平板克隆形成实验将已处理过的细胞消化后,均匀计数。以每孔2×102接种于6孔板,于37 ℃孵箱继续培养2周,每组设3个复孔。14 d后取出培养板,弃去孔内培养基,加入1 ml甲醇固定细胞10 min,0.1%结晶紫染色10 min,PBS洗涤后计数肉眼可见的克隆数并拍照。
1.2.8 数据分析使用SPSS13.0统计学软件进行数据分析,数据采用均数±标准差表示。组织标本采用配对样本t检验,其余体外实验,两组之间采用student t检验,多组之间采用单因素方差分析。CCK-8增殖实验采用析因设计的方差分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 荧光定量PCR和WB检测CTHRC1在结直肠癌组织中稳定高表达使用qRT-PCR检测20对配对的结直肠癌组织中CTHRC1 mRNA的表达,将其2-△△Ct值通过配对样本t检验,分析显示:结直肠癌组织中CTHRC1 mRNA的平均表达量为0.0411±0.0540,正常组织平均表达为0.00865±0.0106;CTHRC1 mRNA在结直肠癌组织中的表达明显高于正常黏膜组织(t=-2.640,P=0.016,图 1A)。同时以Western blotting检测了8对CTHRC1蛋白水平的表达,可见CTHRC1在结直肠癌组织中的表达亦明显高于正常黏膜组织(图 1B)
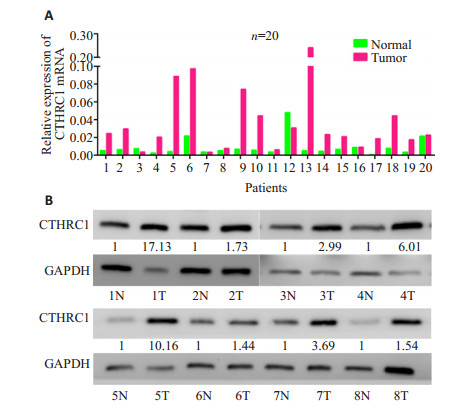
|
图 1 Real-time PCR和Western blotting检测结直肠癌组织中CTHRC1的表达 Figure 1 Expression of CTHRC1 in human colorectal cancer tissues detected by real-time PCR (A) and Western blotting (B). |
使用qRT-PCR检测HT-29、LS174T、SW480、SW620和LOVO 5株细胞中CTHRC1的表达。结果显示:CTHRC1在LOVO和SW620细胞中表达最高,在LS174T和HT29细胞中表达较低(图 2A)。WB的结果与之一致(图 2B)。
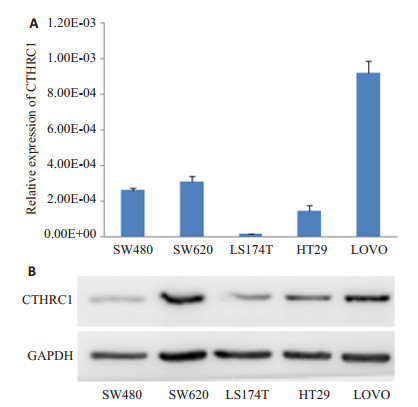
|
图 2 Real-time PCR和Western blotting检测结直肠癌细胞株中CTHRC1的表达 Figure 2 Expression of CTHRC1 in human colorectal cancer cell lines detected by real-time PCR (A) and Western blotting (B). |
采用CCK-8检测LOVO/pGPU6-CTHRC1-shRNA及LOVO/pGPU6-shNC两种处理LOVO细胞的体外增殖能力,细胞生长曲线如图 3。两种细胞生长时间水平差异具有统计学意义(F=55.721,P < 0.001);细胞组间的增殖能力也具有统计学差异(F=225.810,P < 0.001)。两种处理细胞每1 d生长数据经t检验分析,除第1、2天(P=0.484、P=0.056)无差异外,第3、4、5天,两种处理细胞组间均有统计学意义(P=0.002,P=0.003,P=0.041)。以上实验说明敲低CTHRC1抑制了LOVO细胞在体外的增殖活力。
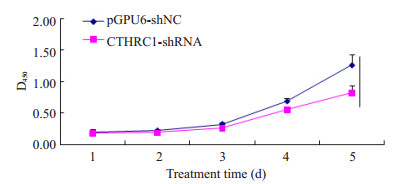
|
图 3 CCK-8检测转染对LOVO细胞的增殖能力的作用 Figure 3 Proliferation ability of LOVO cells after transfection detected by CCK-8 assay. |
Transwell实验(图 4)结果显示:LOVO/pGPU6-CTHRC1-shRNA及LOVO/pGPU6-shNC两种处理LOVO细胞迁移(图 4A、B)的细胞数分别为(76.670±9.074,233.670±7.767)。前者较后者明显降低,差异具有统计学意义(t=22.767,P < 0.001)。侵袭实验(图 4C、D)结果为:LOVO/pGPU6-CTHRC1-shRNA(14.330±2.517);LOVO/pGPU6-shNC(62.330±8.083),前者较后者亦明显降低,差异具有统计学意义(t=9.821,P=0.001)。
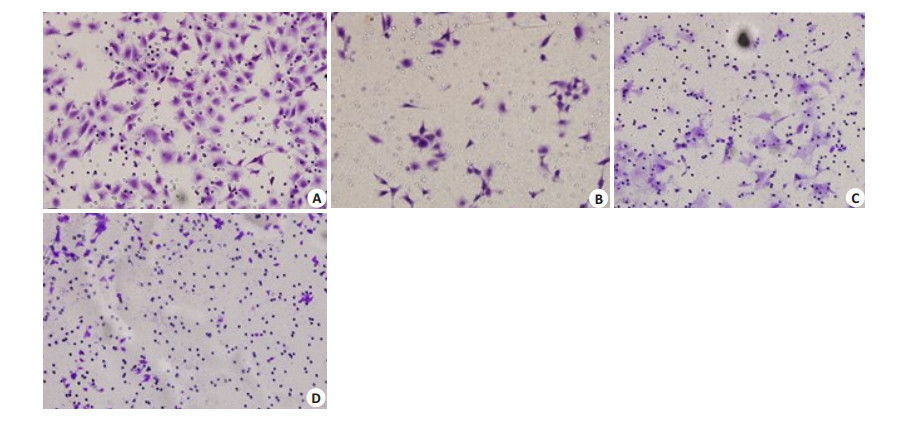
|
图 4 Transwell实验检测转染对LOVO细胞的迁移和侵袭能力的影响 Figure 4 Effect of CTHRC1 shRNA transfection on migration and invasion of LOVO cells. A, B: Cell migration; C, D: Cell invasion; A, C: pGPU6-NC group; B, D: sh-CTHRC1 group. |
平板克隆实验用以评估LOVO/pGPU6-CTHRC1-shRNA及LOVO/pGPU6-shNC两种处理LOVO细胞的克隆形成活力。结果显示如图 5,LOVO/pGPU6-CTHRC1-shRNA形成的克隆数(19±2.000)较LOVO/ pGPU6-shNC对照(41±3.606)明显降低,差异具有统计学意义(t=9.242,P=0.001)。前者的克隆形成率(0.095±0.010)较后者(0.205±0.018)亦明显降低,差异具有统计学意义(t=9.242,P=0.001)
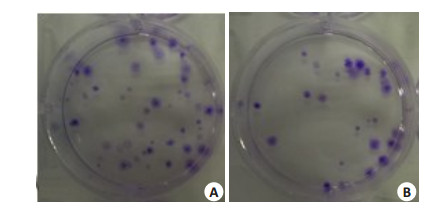
|
图 5 平板克隆实验检测转染对LOVO细胞定殖和克隆的作用 Figure 5 Colony-forming ability of the transfected LOVO cells. A: pGPU6-NC; B: sh-CTHRC1. |
通过qRT-PCR检测:当应用CTHRC1-shRNA处理LOVO细胞后,LOVO/pGPU6-CTHRC1-shRNA组(0.00014±0.000003)较之LOVO/pGPU6-shNC组(0.00042±0.000008),其CTHRC1 mRNA表达明显降低,差异具有统计学意义(t=-55.352,P < 0.001)。CTHRC1蛋白水平(图 6)的表达亦同时被敲低时,如图 7所示:与LOVO/pGPU6-shNC对照组相比,LOVO/ pGPU6-CTHRC1-shRNA处理组中活化的ERK1/2(即P-ERK1/2)明显降低,而总ERK1/2基本保持不变,随之EMT过程亦发生了逆转(即MET:E-cad升高,N-cad、vimentin、β-catenin降低)。
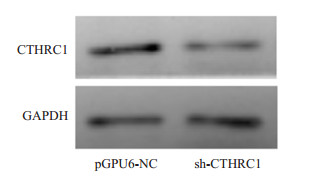
|
图 6 Western blotting检测转染对CTHRC1蛋白表达的影响 Figure 6 Expression of CTHRC1 in LOVO cells after transfection detected by Western blotting. |
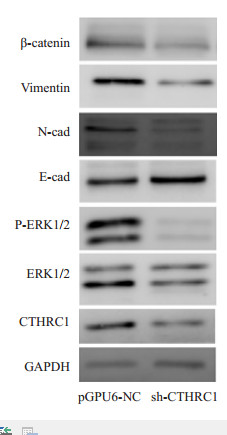
|
图 7 Western blotting检测转染对ERK1/2和EMT标记的作用 Figure 7 The effect on the activation of ERK1/2 and EMT markers. |
CTHRC1可以促进细胞迁移、侵袭且与多种实体肿瘤的转移密切相关[9-11]。我们通过在20对配对结直肠癌组织和5株结直肠癌细胞中进行荧光定量PCR和WB,发现CTHRC1在mRNA和蛋白水平均于结直肠癌组织中高表达。同时相较于低转移潜能的SW480和HT29,CTHRC1在高转移潜能的SW620和LOVO细胞中表达更高。故我们选择LOVO细胞作为下一步的操作细胞。通过瞬时转染靶向作用于CTHRC1的shRNA和阴性对照NC,通过观察荧光达到较高转染效率后进行CCK-8、transwell、平板克隆等实验,并检测了处理组相较于对照组在增殖、迁移、侵袭、克隆形成等生物学功能的变化,初步说明了CTHRC1的促癌作用。我们的结果与之前的报道一致。
上皮间充质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,涉及上皮特性如细胞极性的丧失、细胞之间粘性、桥粒和紧密连接的消失、降解,同时伴随间充质特性如细胞运动能力的增强以及细胞骨架和形态的改变[12]。除在胚胎发育、慢性炎症、组织重建和多种纤维化疾病中发挥了重要作用外,EMT在肿瘤转移过程中伴随着上皮标记分子,如:细胞黏附分子(E-钙黏蛋白)等表达的降低、间充质标记分子,如:N-钙黏蛋白、波形蛋白、β-catenin及侵袭能力的标记分子,如:基质金属蛋白酶(matrix Metalloproteinase, MMPs)表达的增加[13-15]。近年来的研究表明,EMT过程广泛参与了实体肿瘤的侵袭、转移过程[12]。而TGF-β通路是最广为人知的调控EMT过程的信号通路[16]。CTHRC1受TGF-β通路的调控[17],随着TGF-β1的刺激时间延长,其表达逐渐升高[18],但LeClair等[19]等却证实了CTHRC1可以阻断TGF-β诱导的pSmad2/3升高的这一进程。两者看似矛盾,却揭示了细胞EMT调控机制的复杂。那么结直肠癌中EMT是如何发生的,CTHRC1促进细胞迁移、侵袭与EMT的发生之间究竟有何关系?
MAPK/ERK通路广泛参与细胞生长、分化等生命过程,Kim等[20]证实了CTHRC1可以通过激活ERK1/2诱导MMP9的表达。而在A431细胞中MMP9可以和转录因子Snail共同诱导EMT的发生[21]。那么,CTHRC1在结直肠癌中是否通过促进ERK1/2的磷酸化激活EMT过程进而发生侵袭转移呢?
通过将敲低组和对照组分别进行WB,检测EMT标记和ERK1/2和P-ERK1/2的变化,我们发现CTHRC1可以增强ERK1/2的磷酸化,进而发生了促EMT过程。
通过以上实验,初步证实了CTHRC1在结直肠癌组织和高转移潜能细胞中高表达。敲低CTHRC1抑制了结直肠癌细胞株LOVO的增殖、迁移、侵袭、克隆形成能力。CTHRC1通过增强ERK1/2的磷酸化介导EMT过程的发生从而促进结直肠癌的侵袭转移。这为理解结直肠癌的发生发展和转移提供了一个新的视角,为进一步研究EMT的发生机制作出了有意义的补充。
| [1] | Jemal A, Center MM, DeSantis C, et al. Global patterns of cancer incidence and mortality rates and trends[J]. Cancer Epidemiol Biomarkers Prev,2010, 19 (8) : 1893-907. DOI: 10.1158/1055-9965.EPI-10-0437. |
| [2] | Pyagay P, Heroult M, Wang Q, et al. Collagen triple helix repeat containing 1, a novel secreted protein in injured and diseased arteries, inhibits collagen expression and promotes cell migration[J]. Circ Res,2005, 96 (2) : 261-8. DOI: 10.1161/01.RES.0000154262.07264.12. |
| [3] | Chen YL, Wang TH, Hsu HC, et al. Overexpression of CTHRC1 in hepatocellular carcinoma promotes tumor invasion and predicts poor prognosis[J]. PLoS One,2013, 8 (7) : e70324. DOI: 10.1371/journal.pone.0070324. |
| [4] | Gu L, Liu L, Zhong L, et al. Cthrc1 overexpression is an independent prognostic marker in gastric cancer[J]. Hum Pathol,2014, 45 (5) : 1031-8. DOI: 10.1016/j.humpath.2013.12.020. |
| [5] | Tang SC, Chen YC. Novel therapeutic targets for pancreatic cancer[J]. World J Gastroenterol,2014, 20 (31) : 1082544. |
| [6] | Liu X, Liu B, Cui Y, et al. Collagen triple helix repeat containing 1 (Cthrc1) is an independently prognostic biomarker of non-small cell lung cancers with cigarette smoke[J]. Tumour Biol,2014, 21 . |
| [7] | Kim JH, Baek TH, Yim HS, et al. Collagen triple helix repeat containing-1 (CTHRC1) expression in invasive ductal carcinoma of the breast: the impact on prognosis and correlation to clinicopathologic features[J]. Pathol Oncol Res,2013, 19 (4) : 731-7. DOI: 10.1007/s12253-013-9636-y. |
| [8] | Tan F, Liu F, Liu H, et al. CTHRC1 is associated with peritoneal carcinomatosis in colorectal cancer: a new predictor for prognosis[J]. Med Oncol,2013, 30 (1) : 473. DOI: 10.1007/s12032-013-0473-3. |
| [9] | Park EH, Kim S, Jo JY, et al. Collagen triple helix repeat containing-1 promotes pancreatic cancer progression by regulating migration and adhesion of tumor cells[J]. Carcinogenesis,2013, 34 (3) : 694-702. DOI: 10.1093/carcin/bgs378. |
| [10] | Ma MZ, Zhuang C, Yang XM et al. CTHRC1 acts as a prognostic factor and promotes invasiveness of gastrointestinal stromal tumors by activating Wnt/PCP-Rho signaling[J]. Neoplasia, 2014, 16(3): 265-78, 278. e1-13. |
| [11] | Tameda M, Sugimoto K, Shiraki K, et al. Collagen triple helix repeat containing 1 is overexpressed in hepatocellular carcinoma and promotes cell proliferation and motility[J]. Int J Oncol,2014, 45 (2) : 541-8. |
| [12] | Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer,2002, 2 : 442-54. DOI: 10.1038/nrc822. |
| [13] | Micalizzi DS, Farabaugh SM, Ford HL. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression[J]. J Mammary Gland Biol Neoplasia,2010, 15 (2) : 117-34. DOI: 10.1007/s10911-010-9178-9. |
| [14] | Taylor MA, Parvani JG, Schiemann WP. The pathophysiology of epithelial-mesenchymal transition induced by transforming growth fa ctor-β in normal and malignant mammary epithelial cells[J]. J Mammary Gland Biol Neoplasia,2010, 15 (2) : 169-90. DOI: 10.1007/s10911-010-9181-1. |
| [15] | Thiery JP, Acloque H, Huang RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell,2009, 139 : 871-90. DOI: 10.1016/j.cell.2009.11.007. |
| [16] | Wendt MK, Tian M, Schiemann WP. Deconstructing the mechanisms and consequences of TGF-β-induced EMT during cancer progression[J]. Cell Tissue Res,2012, 347 (1) : 85-101. DOI: 10.1007/s00441-011-1199-1. |
| [17] | Pyagay P, Heroult M, Wang Q, et al. Collagen triple helix repeat containing 1, a novel secreted protein in injured and diseased arteries, inhibits collagen expression and promotes cell migration[J]. Circ Res,2005, 96 (2) : 261-8. DOI: 10.1161/01.RES.0000154262.07264.12. |
| [18] | Wang P, Wang YC, Chen XY, et al. CTHRC1 is upregulated by promoter demethylation and transforming growth factor-b1 and may be associated with metastasis in human gastric cancer[J]. Cancer Sci,2012, 103 (7) : 1327-33. DOI: 10.1111/j.1349-7006.2012.02292.x. |
| [19] | LeClair RJ, Durmus T, Wang Q, et al. Cthrc1 is a novel inhibitor of transforming growth factor-beta signaling and neointimal lesion formation[J]. Circ Res,2007, 100 (6) : 826-33. DOI: 10.1161/01.RES.0000260806.99307.72. |
| [20] | Kim HC, Kim YS, Oh HW, et al. Collagen Triple Helix Repeat Containing 1 (CTHRC1) acts via ERK-dependent induction of MMP9 to promote invasion of colorectal cancer cells[J]. Oncotarget,2014, 5 (2) : 519-29. DOI: 10.18632/oncotarget. |
| [21] | Lin CY, Tsai PH, Kandaswami CC, et al. Matrix metalloproteinase-9 cooperates with transcription factor Snail to induce epithelialmesenchymal transition[J]. Cancer Sci,2011, 102 (4) : 815-27. DOI: 10.1111/cas.2011.102.issue-4. |
 2015, Vol. 35
2015, Vol. 35
