肾细胞癌(renal cell carcinoma, RCC),简称肾癌,是泌尿系统最常见的恶性肿瘤之一,仅次于膀胱癌和前列腺癌。我国著名肿瘤学专家郝希山院士连续20年(1981~2002)的调查研究发现RCC位于男性高发恶性肿瘤的第10位,上升幅度在59种恶性肿瘤中排名第1[1]。RCC的早期缺乏特征性的症状体征,早期诊断除影像学检查外尚无有效的方法,实验室检查只作为对患者术前一般状况、肝肾功能以及预后判定的评价指标,RCC早期诊断手段的缺乏使得早发现早治疗具有一定的困难,且转移性肾癌的生存期只有11个月[2],所以寻找利于早期诊断的新标志物迫在眉睫,如尿液中标志性代谢产物。
代谢组学是系统生物学的一个新的分支。国外已有学者[3-4]应用代谢组学方法研究肾癌患者的体液及组织样本,并取得一定的成绩。本文利用GC-MS技术建立一套筛选RCC患者尿液特异性代谢产物的分析方法,研究RCC患者尿液的表达谱,以期找到特异性的代谢产物并建立RCC诊断数据模型,为RCC早期诊断、预后检测、治疗及发病机制研究提供新思路。
1 资料与方法 1.1 一般资料尿液标本采集自2013年9月~2014年1月南方医院泌尿外科及广州市第一人民医院泌尿外科收治的RCC患者27例(RCC组,透明细胞癌17例,嫌色细胞癌6例,其它4例),泌尿系其它常见肿瘤26例(TC组,其中肾盂肾癌6例,膀胱癌9例,前列腺癌11例),健康对照组26例(HC组)来自于南方医院体检中心的健康志愿者;病例组纳入和排除标准:①纳入标准:影像学及病理证实为肾细胞癌,临床分期Ⅰ~Ⅲ肾癌行根治性肾癌切除术或保留肾单位的肾癌手术;②排除标准:肾脏实质肿块病理证实为非肾细胞癌;合并内科疾病,如血液病、免疫系统疾病;肾细胞癌行放化疗或免疫治疗者。各组标本采集性别及年龄信息如表 1所示,经T检验性别和年龄分布差异均无统计学差异(P > 0.05)。
| 表 1 样本来源基本信息 Table 1 Demographic and clinical data of the RCC patients and the control subjects |
本研究中所有样本采集前均经本人及家属知情同意,详细告知本研究的目的和方法,采样前6 h禁食禁水。
1.2 仪器与试剂低温离心机(eppendorf 5417R型);电子天平(梅特勒-托利多仪器AL104型);漩涡混合器(海门市其林贝尔仪器制造有限公司GL-88B型);真空干燥仪(上海比郎BL-Ⅰ型);氮吹仪(托普EYELA MG-2200型);安捷伦单四极杆气相-色谱质谱联用仪(Agilent 7890A/ 5975C,色谱柱为HP-5MS.30 m*0.250 mm*0.25 µm)。
吡啶购自Sigma-aldrich;氯甲酸乙酯(ECF),L-2-氯苯丙氨酸购于上海阿拉丁试剂;氯仿、无水乙醇、氢氧化钠、无水硫酸钠,皆为分析纯,购自于广州金华大化学试剂有限公司;Mill-Q超纯水。
1.3 方法 1.3.1 样本收集与保存用清洁容器收集病人术前晨尿或健康志愿者晨尿中段尿2份,3000 r/min离心10 min,取上清置于-80 ℃保存待用;确保1 h内完成。
1.3.2 样本前处理尿样于37 ℃水浴快速解冻后,12 000 r/min离心10 min,精密吸取600 µl尿液上清并加入100 µl 0.1 mg/ml L-2-氯苯丙氨酸作为内标;再依次加入400 µl无水乙醇、100 µl的吡啶和50 µl ECF,静置1 min;涡旋震荡1 min混匀,反应后加入300 µl氯仿,涡旋震荡30 s混匀后静置5 min;3000 r/min离心5 min,水层和氯仿层分离;加入100 µl 7 mol/L NaOH溶液调节水层pH值至9~10,加入50 µl ECF,涡旋振荡30 s混匀,超声反应1min;涡旋振荡混匀30 s,3000 r/min离心10 min,水层和氯仿层分离;弃去水层,氯仿层加入少量无水硫酸钠后,转于GC-MS专用样品瓶内,待进样分析。
1.3.3 样品分析GC/MS分析的色谱和质谱的参数设置如下:系统载气及流速为99.99%氦气1.2 ml/min;进样量为1 µl,分流比6:1;进样口温度为260 ℃;离子源及四级杆的温度分别为230 ℃和150 ℃;电压为70 eV;质谱全扫描范围(m/z)为30~550;色谱柱升温程序为60 ℃保持2 min,以10 ℃/min升至280 ℃,维持10 min。
1.3.4 数据分析将所得的GC/MS原始数据转化为AIA格式,导入XCMS在线平台进行预处理。将峰面积导入SIMCA-P+12.0.1.0软件包,运用模式识别技术进行非监督PCA和有监督OPLS-DA分析并进行交叉验证。在OPLS-DA模型中,鉴别出对区分不同疾病代谢轮廓贡献比较大的代谢产物,特征代谢产物根据OPLS-DA模型相应主成分的VIP值、VIP图置信区间和系数图置信区间进行筛选,并对多个筛选出的变量进行两独立样本t检验进行验证。
1.3.5 代谢物的鉴定运用仪器自带的数据库NIST11.0及W9N11.L,结合Scripps Center for Metabolomics和HMDB数据库,鉴定内源性生物标志物,选择匹配度较高的内源性生物标志物作为鉴定结果。
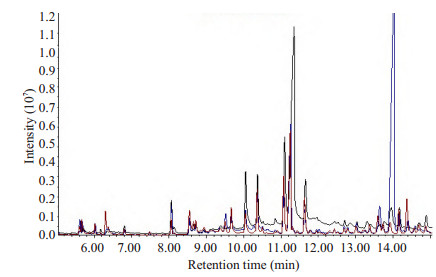
2 结果 2.1 典型的GC/MS总离子流图(total ion chromatogram, TIC)尿液经ECF衍生化后GC/MS分析获得TIC图。谱库检索后共检出119个代谢物。从直观的TIC图中能够发现RCC患者、泌尿系其它肿瘤患者及健康人尿液存在明显的差异(图 1),但是这些肉眼可观的差异还需要进一步的统计分析验证。
|
图 1 典型的RCC患者与其他肿瘤患者和正常人的GC/MS总离子流图 Figure 1 Typical GC/MS total ion chromatograms (TIC) chromatograms of RCC patients (red), TC group (black) and HC group (blue). |
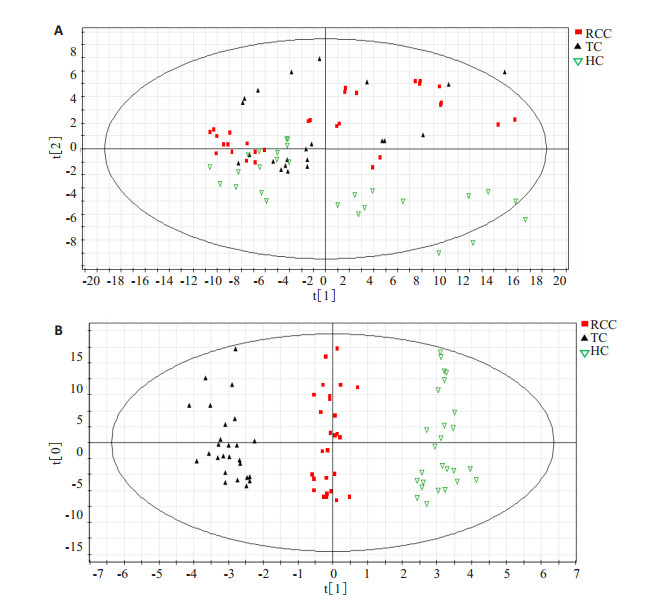
数据经预处理后,PCA分析结果表明10个主成分的累积解释率R2X=0.846,Q2=0.575,反映组间离散程度的Score Plot得分图(图 2A)显示,大多数样本点落在95%置信区间的Hotelling's T2的椭圆形内,有5个离群点。图中可以看到三组间具有一定的分离趋势,但是该趋势不太明显。同时构建OPLS-DA数据模型,将Y矩阵设为0/1/2用来分别描述RCC组、TC组及HC组。结果显示(图 2B),三组所有样本点能够很好地区分,并且该模型有较高的解释率及预测率(R2X=0.736,R2Y=0.974,Q2Y=0.897),表明OPLS-DA模型能够将RCC患者与肾脏其它肿瘤及常见泌尿系肿瘤患者、健康人正确区分。
|
图 2 PCA和OPLS-DA模型对RCC患者的区分能力 Figure 2 Ability of PCA (A) and OPLS-DA (B) models to distinguish RCC patients from TC group and healthy subjects. |
根据每一变量的系数置信区间和变量权重VIP值,选择有意义的差异变量(系数不含0以及VIP值大于1的变量),即特异性的生物标志物。本实验共筛选出18种代谢产物, 鉴定出的有14种,分别为硬脂酸、苯丙氨酸、色氨酸、马尿酸、赖氨酸、吲哚乙酸、苯基丙二酸、丙二酸、戊酸、戊二酸、己二酸6-甲氧基-硝基喹啉和氨基喹啉、喹啉。RCC组与健康对照组相比,其中戊酸、丙二酸、戊二酸、己二酸、吲哚乙酸、氨基喹啉、喹啉及色氨酸在尿液中的含量显著高于正常人(P < 0.01),同时戊酸、苯丙氨酸、6-甲氧基-硝基喹啉在尿液中含量也显著高于泌尿系其它肿瘤患者(P < 0.01)。
3 讨论本实验以RCC患者及其对照组的晨尿标本作为研究对象,应用GC-MS技术进行RCC患者的尿液代谢组学研究。结果筛选出的14种代谢产物在RCC组与肿瘤对照组及健康对照组间有明显差异。这些特征代谢产物中有多种有机酸,如丙二酸,戊二酸和己二酸等。己二酸是中链脂肪酸代谢障碍的特征代谢产物,丙二酸也是脂肪酸的代谢产物,构成脂肪酸合成的活性形式,即丙二酸辅酶A,由此可见RCC的发生发展可能与脂肪酸的代谢障碍有关。此外,丙二酸可竞争性抑制呼吸电子传递链中的琥珀酸脱氢酶,在有氧呼吸及能量产生过程中都发挥着重要的作用。大多数实体肿瘤的发生与缺氧微环境相关,RCC患者尿液中丙二酸含量比健康对照组显著增加,体内含量的多少可能会对瘤细胞的有氧呼吸产生一定的作用,从而影响能量传递。
马尿酸是苯甲酸和甘氨酸在甘氨酸酰基转移酶的作用下结合产生的,由马尿酸酶分解。有研究表明马尿酸与肾毒性有关[5],Dieme等[6]应用基于GC-MS的代谢组学方法对肾移植术进行疗效观测,结果发现马尿酸等物质可能抵抗术后免疫抑制剂的肾损伤等毒副作用。马尿酸也可作为胃肠道肿瘤的生物标志物[7],在一定程度上还能区分冠心病心绞痛的不同中医证型[8]。
喹啉是色氨酸的代谢产物之一,可合成必需辅助因子烟酸及腺嘌呤二核苷酸,研究表明其与肾脏疾病、免疫性疾病和某些神经精神病有关。喹啉酸抑制红细胞生成,可能参与尿毒症患者的贫血过程,抑制肾皮质的糖异生,也抑制肾小管对有机弱酸的重吸收[9],最后通过肾脏排出。已有报道RCC患者尿液中的喹啉含量增加[10-11]。RCC患者的色氨酸代谢增加[11],导致尿液中色氨酸水平降低,而其下游代谢产物喹啉及氨基喹啉明显增加,这与本课题组在另一实验中检测到的色氨酸在恶性肾小管上皮细胞培养上清中浓度低于良性肾小管上皮细胞的结果相一致,提示色氨酸在肿瘤细胞中的降解增多,色氨酸及其代谢产物可能是RCC潜在的生物标志物。另外,有研究者从弥漫性肿瘤病人的血清中检测到色氨酸的表达水平降低[12],其代谢产物也可能与肠道肿瘤[13]有关,但并不是所有的肿瘤都会出现色氨酸的降解,有研究表明在肝细胞和肝癌细胞中色氨酸的水平没有明显差异[14]。
利用代谢组学的分析手段检测RCC患者的尿液,发现的特征代谢产物主要与氨基酸代谢、脂肪酸代谢及能量传递等途径有关,对这些代谢产物及其代谢通路的深入研究,可能发现新型的针对RCC潜在的生物标记物,在补充RCC实验室诊断方面有一定的前景。
| [1] | 郝希山.中国恶性肿瘤流行趋势及预防[C].第十三届中国科协年会第18分会场-癌症流行趋势和防控策略研究研讨会论文集(补充), 中国天津: 2011, 2. |
| [2] | Chase DM, Huang HQ, Wenzel L, et al. Quality of Life and survival in advanced cervical cancer: A gynecologic oncology group study[J]. Gynecol Oncol,2012, 125 (2) : 315-9. DOI: 10.1016/j.ygyno.2012.01.047. |
| [3] | Kind T, Tolstikov V, Fiehn O, et al. A comprehensive urinary metabolomic approach for identifying kidney cancerr[J]. Anal Biochem,2007, 363 (2) : 185-95. DOI: 10.1016/j.ab.2007.01.028. |
| [4] | Kim K, Taylor SL, Ganti S, et al. Urine metabolomic analysis identifies potential biomarkers and pathogenic pathways in kidney cancer[J]. OMICS,2011, 15 (5) : 293-303. DOI: 10.1089/omi.2010.0094. |
| [5] | Gu L, Wang X, Zhang Y, et al. Determination of 12 potential nephrotoxicity biomarkers in rat serum and urine by liquid chromatography with mass spectrometry and its application to renal failure induced by Semen Strychni[J]. J Sep Sci,2014, 37 (9/10) : 1058-66. |
| [6] | Dieme B, Halimi JM, Emond P, et al. Assessing the metabolic effects of calcineurin inhibitors in renal transplant recipients by urine metabolic profiling[J]. Transplantation,2014, 98 (2) : 195-201. DOI: 10.1097/TP.0000000000000039. |
| [7] | Kim KB, Yang JY, Kwack SJ, et al. Toxicometabolomics of urinary biomarkers for human gastric cancer in a mouse model[J]. J Toxicol Environ Health A,2010, 73 (21/22) : 1420-30. |
| [8] | 张红栓, 贾钰华, 华何与, 等. 冠心病心绞痛痰浊证、血瘀证的尿液代谢组学研究[J]. 中国中医基础医学杂志,2010 (2) : 126-8. |
| [9] | 周前选, 唐爱国. 喹啉酸与相关疾病的研究进展[J]. 实用预防医学,2009, 16 (3) : 9封3-87. |
| [10] | Kim K, Aronov P, Zakharkin SO, et al. Urine metabolomics analysis for kidney cancer detection and biomarker discovery[J]. Mol Cell Proteomics,2009, 8 (3) : 558-70. DOI: 10.1074/mcp.M800165-MCP200. |
| [11] | Ganti S, Taylor SL, Abu Aboud O, et al. Kidney tumor biomarkers revealed by simultaneous multiple matrix metabolomics analysis[J]. Cancer Res,2012, 72 (14) : 3471-9. DOI: 10.1158/0008-5472.CAN-11-3105. |
| [12] | Weinlich G, Murr C, Richardsen L, et al. Decreased serum tryptophan concentration predicts poor prognosis in malignant melanoma patients[J]. Dermatology,2007, 214 (1) : 8-14. |
| [13] | Kolby L, Wangberg B, Ahlman H, et al. Histidine decarboxylase expression and histamine metabolism in gastric oxyntic mucosa during hypergastrinemia and carcinoid tumor formation[J]. Endocrinology,1996, 137 (10) : 4435-42. |
| [14] | Dettmer K, Vogl FC, Ritter AP, et al. Distinct metabolic differences between various human cancer and primary cells[J]. Electrophoresis,2013, 34 (19) : 2836-47. |
 2015, Vol. 35
2015, Vol. 35
