挤压伤、肢体电击伤、气性坏疽、严重糖尿病足等常常可以形成深达肌肉、筋膜、肌腱的创面并伴有大量组织坏死。笔者前期研究发现,创面坏死组织中存在大量腐胺[1],腐胺是有毒性的,其吸收后对机体产生炎症反应[2],更可导致机体肝肾功能损害及细胞凋亡[3-4]。腐胺等多胺物质存在于创面,那么它对创周邻近组织会不会有损害?其损害是否影响伤口愈合?迄今尚未见到腐胺对创面局部修复影响的相关报道。创伤愈合过程中组织改建由金属基质蛋白酶(matrixmetalloproteinases, MMPs)及组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases, TIMPs)共同参与调控,人皮肤成纤维细胞(human skin fibroblasts, HSF)是肉芽组织的主要成分之一,是MMPs及TIMPs主要分泌细胞,因此HSF被认为是创面愈合重要的组织修复细胞[5]。本研究以HSF为研究对象,探讨不同浓度腐胺对HSF增殖、迁移及凋亡的影响,旨在揭示腐胺对局部创面组织细胞的影响及损害机制,为难愈性创面治疗提供新思路。
1 材料与方法 1.1 细胞与主要试剂人皮肤成纤维细胞购自莱德尔生物公司,腐胺购自深圳麦迪逊生物技术有限公司,高糖DMEM培养液购自美国Gibico,MTS(CellTiter96® AQueous One Solution Cell Proliferation assay)试剂购自美国Promega,凋亡试剂盒购自美国BD,Transwell小室购自美国BD。采用天津开元生物工程仪器有限公司SunRise TECAN酶标仪,美国BD公司Accuri C6流式细胞仪。
1.2 细胞培养及分组将HSF以含10%胎牛血清、1%青/链霉素的高糖DMEM培养基置于37 ℃、5% CO2温箱中培养。以含腐胺浓度分别为0.5、1、5、10、50、100、500、1000 μg/ml完全培养基培养细胞设为腐胺组,以不添加腐胺的完全培养基培养细胞设为对照组。
1.3 实验方法 1.3.1 细胞增殖能力MTS实验取对数生长期的HSF以4000个/孔接种于96孔板培养24 h待细胞贴壁生长,设对照组及不同浓度腐胺的腐胺组,腐胺组再分8组,各组细胞取4个孔,分别加入100 μl含腐胺浓度为0.5、1、5、10、50、100、500、1000 μg/ml完全培养基,对照组加入100 μl不含腐胺的完全培养基,培养24 h后,每孔100 μl加入20 μl MTS溶液,避光继续培养1 h,置于酶标仪检测490 nm波长的吸光度值,以空白对照调零。细胞增殖用吸光度(x±s)来表示,实验均重复3次。
1.3.2 Transwell细胞迁移实验取生长良好的HSF,以2.5×105个细胞接种于Transwell小室中,用无血清培养基培养,下室加入700 μl分别含浓度0.5、1、5、10、50、100、500、1000 μg/ml腐胺的完全培养基,对照组下室加入700 μl不含腐胺的完全培养基,24 h后用4%甲醛固定12 min,再用0.1%结晶紫染色15 min后,置于100倍光学显微镜下随机选取5个视野,取平均值进行比较。迁移细胞数以x±s来表示,实验重复3次。
1.3.3 细胞凋亡实验收集腐胺组及对照组培养24 h的HSF,用凋亡试剂盒中结合缓冲液将细胞浓度调至1× 106/ml,取100 μl细胞悬液于5 ml离心管中,加5 μl FITC Annexin V和5 μl碘化丙锭(PI),室温避光孵育15 min后,加入400 μl预冷的结合缓冲液,将样品置于冰上保存。于1 h内置于流式细胞仪检测,采用Flowjo流式细胞分析软件分析计算出凋亡细胞百分率以x±s表示。实验重复3次。
1.4 统计分析采用SPSS 13.0软件对所得数据进行统计处理,数据以均数±标准差表示,多组间采用单因素方差分析和Kruskal-Wallis检验,两两比较采用LSD-t和GamesHowell法,P < 0.05表示差异有统计学意义。
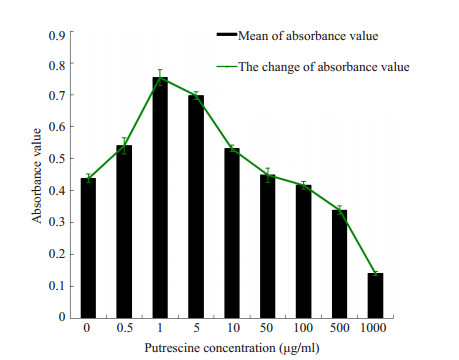
2 结果 2.1 HSF在不同浓度腐胺作用下细胞增殖情况HSF在不同浓度腐胺作用下增殖情况呈不同变化,组间比较是有差异的(F=477.715,P=0.000)。MTS实验显示,腐胺组经0.5、1、5、10 μg/ml浓度腐胺处理的HSF吸光度值与对照组处理的HSF比较均有升高,差异有统计学意义(P < 0.01),并且腐胺浓度为1 μg/ml时HSF吸光度值达到峰值0.754±0.024。另经500、1000 μg/ml浓度腐胺处理的HSF吸光度值均较对照组降低,差异有统计学意义(P < 0.01),而且吸光度值随浓度增加而降低;50、100 μg/ml腐胺处理的HSF吸光度值与对照组比较,差异无统计学意义(P > 0.05)。结果显示,腐胺促进HSF增殖活性的浓度范围为小于及等于10 μg/ml,并且1 μg/ml时促进作用最强;而腐胺抑制HSF增殖活性的浓度范围为大于100 μg/m(图 1)。
|
图 1 各浓度腐胺处理后HSF吸光度值变化趋势 Figure 1 Absorbance value of HSF after treatment with different concentrations of putrescine. |
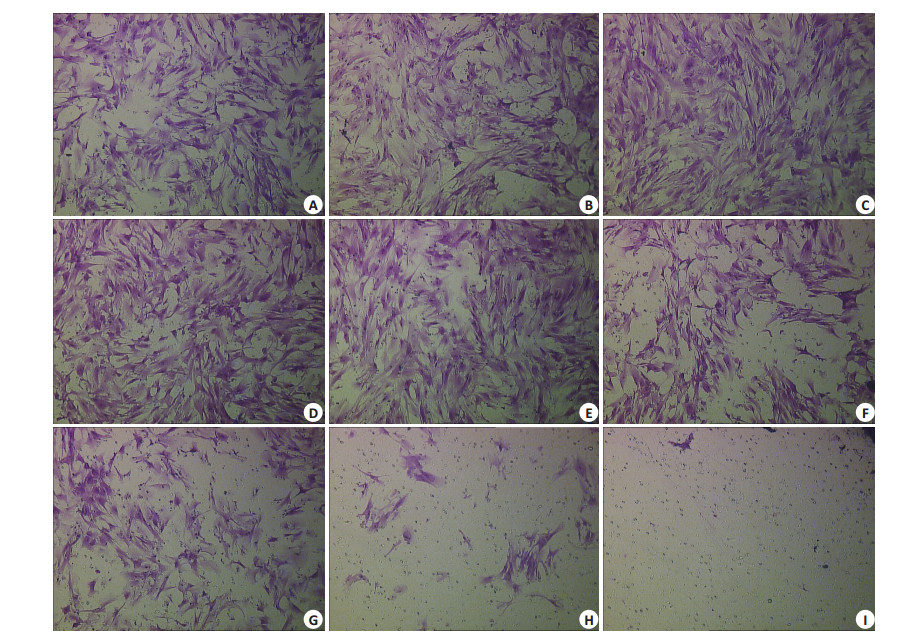
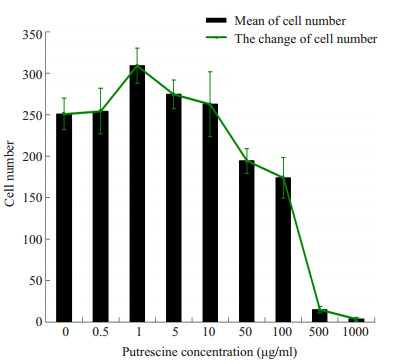
HSF在不同浓度腐胺作用下细胞迁移情况呈不同变化,组间比较是有差异的(χ2=35.910,P=0.00)。1 μg/ml腐胺组HSF穿过微孔膜的数目较对照组显著增加,差异有统计学意义(P=0.002);0.5、5、10 μg/ml腐胺组HSF穿过微孔膜的数目与对照组比较,差异无统计学意义(P分别为0.856、0.190、0.512);50、100、500、1000 μg/ml腐胺组HSF穿过微孔膜的数目较对照组显著降低,差异有统计学意义(P分别为0.043、0.000、0.000、0.000)。结果显示,腐胺浓度在1 μg/ml时促进HSF迁移,50、100、500、1000 μg/ml时抑制细胞迁移,0.5、5、10 μg/ml时不影响细胞迁移(图 2~3)。
|
图 2 各浓度腐胺处理组Transwell代表图 Figure 2 Transwell assay of HSF after treatment with different concentrations of putrescine (Original magnification, ×100). A: Control group; B-I: 0.5, 1.0, 5.0, 10, 50, 100, 500, and 1000 μg/ml putrescine, respectively. |
|
图 3 各浓度腐胺处理后HSF迁移的变化趋势 Figure 3 Changes of cell migration of the HSF after treatment with different concentrations of putrescine. |
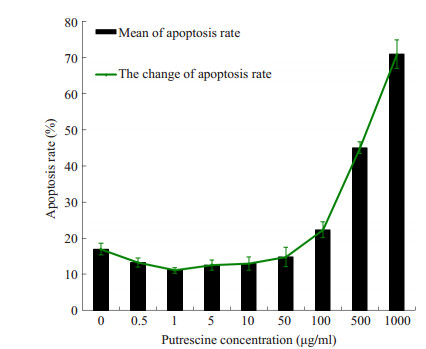
HSF在不同浓度腐胺作用下细胞凋亡呈不同变化,组间比较是有差异的(F=276.638,P=0.00)。0.5、1、5、10 μg/ml浓度腐胺组HSF凋亡率较对照组降低,差异有统计学意义(P分别为0.048、0.003、0.022、0.033),而且在1 μg/ml时细胞凋亡率最低(11.10±0.79)%;100、500、1000 μg/ml浓度腐胺组HSF凋亡率较对照组显著升高,差异有统计学意义(P分别为0.006、0.000、0.000);50 μg/ml腐胺组细胞凋亡率与对照组比较无明显差异(P=0.226)。结果显示,腐胺浓度在0.5~10 μg/ml时抑制细胞凋亡,100~1000 μg/ml时促进细胞凋亡,50 μg/ml时不影响细胞凋亡(图 4)。
|
图 4 各浓度腐胺处理后HSF凋亡率的变化趋势 Figure 4 Cell apoptosis rate of the HSF after treatment with different concentrations of putrescine. |
创面产生后HSF立即被活化,出现迁移、增殖、合成和分泌细胞外基质,进而参与肉芽组织形成、创面胶原化、瘢痕形成及改建等活动[6]。当然修复过程还依赖许多不同的细胞、可溶性介质等的共同作用[7]。胶原蛋白合成最主要的细胞是HSF,如果其迁移、增殖能力减弱,将会延迟新生胶原合成和创面修复。既往认为,造成创面愈合难的主要原因有病菌感染及局部缺血缺氧两大类[8-9],其机制是影响局部创面HSF增殖与迁移等生物学行为,进而延迟创面愈合[10-11]。腐胺由鸟氨酸脱羧生成,微量存在于正常组织中维持细胞正常增殖、分化及修复[12]。有研究表明人正常结肠粘膜组织约含0.41±0.05 μg/mg腐胺[13],慢性创面或局部存有许多坏死组织的其它创面内含较高浓度的腐胺质,那么,腐胺是否也能对HSF生物学行为造成明显改变,是本实验所关注的问题。
迁移是HSF重要的生物学行为,再者创面产生后HSF向创面迁移,大量增殖形成肉芽组织和分泌胶原填充创面,为上皮再生修复提供基础,因此HSF迁移是创面修复不可或缺的行为,是修复过程中细胞启动的第一步[12]。本研究结果显示,腐胺浓度为0.5、5、10 μg/ml时对细胞迁移无明显抑制作用,在1 μg/ml浓度组腐胺甚至可使穿过微孔膜的细胞数量增加,表明微小浓度的腐胺将有助于HSF迁移。但较高浓度时(50 μg/ml)穿过微孔膜数量明显减少,500 μg/ml时HSF基本无迁移。实验结果提示,如果不能及时地清除坏死组织,降低局部腐胺等多胺浓度,有效地将一个慢性创面转变为急性创面,那么,创面含有大量腐胺的患者(如2级及以上糖尿病足、3期压疮等)基本就无法依赖HSF的迁移、增殖进而修复。
本实验采用MTS法测定细胞增殖能力,它是通过把活细胞线粒体中脱氢酶还原成有色水溶性甲臜产物,再用酶标仪检测其吸光度值,吸光度值与细胞增殖数成正比。实验结果显示,0.5、1、5、10 μg/ml腐胺处理的HSF的吸光度值较对照组显著升高,其中在1 μg/ml浓度时达峰值,随后依浓度增加而吸光度值逐步减少,500 μg/ml组吸光度值开始出现非常明显降低,表明腐胺浓度在一定微量区间(0.5~10 μg/ml)可促进细胞增殖,当浓度超过1 μg/ml以后,腐胺对细胞的刺激力度开始减弱,50 μg/ml时的增值能力远不及峰值,到500 μg/ml时则表现出强烈抑制。其对细胞增殖的影响机制尚未明确。有可能为其毒性作用直接杀死细胞,也有可能为腐胺促进细胞凋亡导致其细胞数大量减少,还有可能通过其他机制共同起作用[13-17]。
既往关于细胞凋亡与腐胺之间的关系研究多在肿瘤细胞,而且是基于较小剂量的探讨上。Erez [18]认为腐胺积聚可产生氧压,刺激线粒体中细胞色素C释放、激活Caspase诱导小鼠骨髓瘤细胞凋亡。我们前期研究发现,较大剂量的腐胺攻击大鼠腹膜腔可导致其正常肝肾细胞凋亡[3-4]。接下来我们更想知道从微小剂量开始,不同浓度的腐胺对HSF的凋亡会产生何种连续性的影响。本实验采用流式细胞技术中的Annexin V/PI法对不同浓度腐胺处理的细胞进行检测,并对早期与晚期细胞凋亡率进行统计分析。实验结果表明,腐胺低浓度(0.5~10 μg/ml)时显著地抑制细胞凋亡,而高浓度(100~1000 μg/ml)时显著地诱导细胞凋亡。因此,本研究结果显示,腐胺不仅影响肿瘤细胞凋亡,对正常细胞如HSF的凋亡也有明显作用,且与浓度相关。
研究中我们观察到,腐胺对细胞增殖的影响与对凋亡的诱导呈现出一种此消彼长的态势。具体表现为,在腐胺刺激微量浓度区间(0.5、1、5、10 μg/ml),细胞增殖能力提高,此时细胞凋亡率下降;在较高浓度区间(50、100、500、1000 μg/ml),细胞增殖能力下降,此时细胞凋亡率增高。试验中的对照组也有一定的细胞凋亡,但实验组在腐胺浓度为1 μg/ml时细胞凋亡率最低而细胞增殖能力达到峰值,显示出低浓度区间细胞增殖能力的提高主要是通过抑制细胞凋亡来实现的,换句话说,就是腐胺处于浓度低时会抑制细胞凋亡而促进细胞增殖,浓度高时诱导细胞凋亡却抑制细胞生长。这种实验现象正好解释在临床上为什么清洁的急性创面(处于腐胺微量浓度区间)比污染重的慢性创面(处于腐胺较高浓度区间)愈合更快的原因。
综上所述,尽管微量腐胺可显著提高HSF的细胞增殖能力和维持细胞正常的迁移能力,但微量腐胺仅存在于正常组织细胞中,而较高浓度的腐胺显著抑制HSF迁移与增殖,并诱导细胞发生凋亡。含大量坏死组织的创面可产生大量腐胺,较之吸收入血后对机体产生全身损害,创面中的腐胺对溃疡创面周围正常组织产生损害更直接、更严重。如果创面患者的伤情严重,坏死组织中腐胺的浓度会迅速超越其微量促增殖浓度区间,创面也无法通过腐胺促进HSF增殖迁移而愈合,更多的是高浓度的腐胺对创面愈合的直接损害及其吸收入血后对机体产生损害。因此,及时有效地外科手术清创,清除坏死组织,降低局部腐胺等有害物质含量,将慢性创面转化为急性创面,从而促进HSF的创面迁移与增殖的有效方法,可为创面修复提供一个适宜的环境。
| [1] | 刘思容, 荣新洲, 樊桂成, 等. 糖尿病足创面及血和尿中多胺含量与相关分析[J]. 中华烧伤杂志,2013, 29 (6) : 526-30. |
| [2] | 樊桂成, 荣新洲, 王学敏, 等. 外源性腐胺和尸胺对兔外周血炎症因子的影响[J]. 中华烧伤杂志,2012, 28 (6) : 451-4. |
| [3] | 周岳平, 肖能坎, 荣新洲, 等. 外源性腐胺对正常大鼠肾功能和细胞凋亡的影响[J]. 南方医科大学学报,2012, 32 (11) : 1651-4. |
| [4] | Cook H, Davies KJ, Harding KG, et al. Defective extracellular matrix reorganization by chronic wound fibroblasts is associated with alterations in TIMP-1, TIMP-2, and MMP-2 activity[J]. J Invest Dermatol,2000, 115 (2) : 225-33. DOI: 10.1046/j.1523-1747.2000.00044.x. |
| [5] | Clark RA. Regulation of fibrophasia in cutaneous wound repair[J]. Am J Med Sci,1993, 306 (1) : 42-8. DOI: 10.1097/00000441-199307000-00011. |
| [6] | Toriseva M, Kähäri VM. Proteinases in cutaneous wound healing[J]. Cell Mol Life Sci,2009, 66 (2) : 203-24. DOI: 10.1007/s00018-008-8388-4. |
| [7] | Shi Y, Hu G, Su J, et al. Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair[J]. Cell Res,2010, 20 (5) : 510-8. DOI: 10.1038/cr.2010.44. |
| [8] | 孙亚如, 张美荣, 高宏. 干细胞分泌因子促进难愈性创面愈合的机制及应用前景[J]. 中国组织工程研究,2012, 16 (6) : 1125-8. |
| [9] | Volk SW. Mesenchymal stem cells in ischemic wound healing[J]. Advances In Wound Care,2010, 1 (2) : 471-6. |
| [10] | Falanga V. Growth factors and chronic wounds: the need to understand the microenvironment[J]. J Dermatol,1992, 19 (11) : 667-72. DOI: 10.1111/jde.1992.19.issue-11. |
| [11] | Agostinelli E, Marques MP, Calheiros R, et al. Polyamines: fundamental characters in chemistry and biology[J]. Amino Acids,2010, 38 (2) : 393-403. DOI: 10.1007/s00726-009-0396-7. |
| [12] | 李建生, 油书恒, 牛正先, 等. 结直肠癌患者血液和组织中鸟氨酸脱羧酶活性和腐胺含量的测定[J]. 胃肠病学和肝病学杂志,1994, 4 (4) : 259-60, 271. |
| [13] | Falanga V. Wound healing and its impairment in the diabetic foot[J]. Lancet,2005, 366 (9498) : 1736-43. DOI: 10.1016/S0140-6736(05)67700-8. |
| [14] | Wallace HM, Fraser AV, Hughes A. A perspective of polyamine metabolism[J]. Biochem J,2003, 376 (Pt 1) : 1-14. |
| [15] | Brunton VG, Grant MH, Wallace HM. Spermine toxicity and glutathione depletion in BHK-21/C13 cells[J]. Biochem Pharmacol,1990, 40 (8) : 1893-900. DOI: 10.1016/0006-2952(90)90371-Q. |
| [16] | Poulin R, Pelletier G, Pegg AE. Induction of apoptosis by excessive polyamine accumulation in ornithine decarboxylase-overproducing L1210 cells[J]. Biochem J,1995, 311 (Pt 3) : 723-7. |
| [17] | Tome ME, Fiser SM, Payne CM, et al. Excess putrescine accumulation inhibits the formation of modified eukaryotic initiation factor 5A (eIF-5A) and induces apoptosis[J]. Biochem J,1997, 328 (Pt 3) : 847-54. |
| [18] | Erez O, Goldstaub D, Friedman J, et al. Putrescine activates oxidative stress dependent apoptotic death in ornithine decarboxylase overproducing mouse myeloma cells[J]. Exp Cell Res,2002, 281 (1) : 148-56. DOI: 10.1006/excr.2002.5662. |
 2015, Vol. 35
2015, Vol. 35
