2. 南华大学 药学与生命科学学院,湖南 衡阳 421001 ;
3. 南方医科大学公共卫生与热带医学学院,广东 广州 510515
2. School of Pharmaceutics and Life Sciences, University of South China, Hengyang 421001, China ;
3. School of Public Health and Tropic Medicine, Southern Medical University, Guangzhou 510515, China
Compound K(C-K)为人参属药材诸如人参和西洋参中人参二醇皂苷肠道代谢降解产物[1],其抗氧化、抗炎和抗衰老功效已经在国内外得到了广泛的研究[2-5]。近年来,新的研究证据表明C-K亦具有一定的拮抗结肠肿瘤的功效[6]。在小鼠结肠癌肿瘤模型中,西洋参及人参表现出较强的抑制肿瘤细胞生长的效果,并且弱化了肿瘤细胞对化疗药物的拮抗作用[7-8]。最近的研究表明C-K能作用于免疫细胞,调节免疫系统[9]。作为肿瘤微环境中极其重要的一群免疫细胞,髓样抑制性细胞(myeloid derived suppressor cell, MDSC)对肿瘤细胞的早期增生、免疫逃逸以及转移起到非常重要的促进作用[10]。但是迄今为止,国内外尚无文献报道C-K对MD-SC的影响。本研究欲探讨C-K对MDSC细胞凋亡、免疫抑制及促炎症细胞因子产生的影响,从而阐明C-K的抗癌作用至少部分是通过抑制了MDSC这一类重要的微环境细胞来抑制肿瘤细胞的增殖。
1 材料与方法 1.1 材料细胞培养所用RPIM 1640、胎牛血清(FBS)、DPBS及细胞培养双抗均购自美国Life Technologies公司;C-K购自美国BD Biosciences公司;MDSC体外培养所需GM-CSF (10 ng/ml)以及流式分选MDSC和凋亡检测抗体及试剂包括PE-CD11b(M1/70)、FITC-Gr1(8C5)、Pacific Blue-Annexin V和7-AAD均购自美国Biolegend公司;小鼠IL-1β、IL-6和IL-17 ELISA试剂盒亦购自美国Biolegend公司;RNA提取,cDNA合成和SYBR Green qRT-PCR试剂盒购自美国Life Technologies公司。
1.2 方法 1.2.1 细胞培养 1.2.1.1 CT26细胞培养Bal b/c小鼠细胞系CT26,购自美国模式培养物集存库(ATCC),用RPMI 1640(含10% FBS,1%青霉素和链霉素)培养基,培养于5% CO2,37 ℃细胞培养箱中,3~4 d传代1次。取对数生长期细胞用Tris-EDTA消化,DPBS洗涤,重悬制成单细胞悬液,台盼蓝染色计数收集细胞用于后续实验。
1.2.1.2 MDSC分离与培养Balb/c小鼠,6~8周龄,15~20 g,SPF级,购自南华大学实验动物部。结肠肿瘤由Balb/c小鼠皮下注射CT26细胞21 d后诱导产生。小鼠断颈处死后,用注射器抽取细胞分离/流式缓冲液(DPBS加入2% FBS)冲洗双侧股骨和胫骨,70 μm细胞滤网过滤分离,随后进行40%~80% Percoll分离单细胞悬液。单细胞悬液加入CD11b(M1/70)和FITC/ Cy5.5-Gr1(8C5)抗体后,冰上避光染色30 min。缓冲液洗后,用流式细胞仪(BD FACSAria cell sorter)分选CD11b+Gr1+MDSC,培养于6孔板内,培养液为RPMI 1640(含10% FBS,1%青霉素和链霉素,5 ng/ml GM-CSF)。处理组加入50 μmol/L C-K,对照组加入PBS处理细胞96 h后,收集细胞上清保存于-80 ℃,用ELISA检测促炎性细胞因子水平。
1.2.2 Annexin V/7-AAD检测MDSC凋亡50 μmol/L C-K处理MDSCs 96 h后,C-K处理组和对照组经DPBS(含2% FBS)洗2次后转移至100 μl Annexin V结合缓冲液,加入5 μl Annexin V和10 μl 7-AAD,混匀,室温避光染色15 min,再加入400 μl结合缓冲液。于BD biosciences LSRII流式细胞仪上进行检测。早期凋亡细胞为Annexin V阳性,7-AAD阴性。晚期凋亡或坏死细胞为Annexin V和7-AAD双阳性。
1.2.3 qRT-PCR检测Cox-2和Arg-1的表达细胞总mRNA由PureLink® RNA Mini试剂盒提取,定量后取1 μg mRNA用SuperScript® III First-Strand Synthesis System合成cDNA。SYBR Green qRT-PCR用于检测MDSC中免疫抑制相关基因Cox-2和Arg-1的表达。小鼠GAPDH用于基因表达相对定量。qRT-PCR在Bio-Rad Cycler Thermal Cycler上完成,PCR定量分析采用2-ΔΔCt法,以GAPDH的表达为内参照。用于qRTPCR实验的引物:Cox-2 forward,5'-AGTGTGCGACATACTCAAGCAGGA-3';reverse,5'-TTGAAGTGGTAACCGC-TCAGGTGT-3';Arg-1 forward,5'-AAGA ATGGAAGAGTCAGTGTGG-3';reverse,5'-GGGAG TGTTGATGTCAGTGTG-3';GAPDH forward,5'-CT TTGTCAAGCTCAT-TTCCTGG-3';reverse,5'-TCTTGCTCAGTGTCCTTGC-3'。
1.2.4 ELISA检测促炎性细胞因子水平培养的MDSC经C-K或者PBS处理96 h后,细胞培养上清中促炎性细胞因子水平用IL-1β、IL-6或IL-17 LEGEND MAXTM-Mouse ELISA Kit with Pre-coated Plates试剂盒检测,具体操作参照制造商提供的实验流程完成。在多功能酶标检测仪上读取波长为450 nm的吸光度。
1.2.5 动物免疫及小鼠皮下肿瘤形态、组织学检测MDSC经50 μmol/L C-K或PBS对照处理后,流式分选DAPI(4',6-diamidino-2-phenylindole)染色阴性1× 104 MDSC混合1×106 CT26肿瘤细胞皮下免疫Balb/c小鼠21 d。小鼠断颈处死后,对所生成的肿瘤进行初步的形态学鉴定,并切取部分肿瘤组织,进行固定、脱水、石蜡包埋。0.5 μm石蜡切片,HE染色,观察分析各组小鼠肿瘤组织形态特点。
1.3 统计学方法所有数据用均数±标准差表示,采用SPSS 13.0统计软件进行two-tailed Student's t test组间比较,P < 0.05为差异有统计学意义。
2 结果 2.1 C-K诱导MDSC细胞凋亡经C-K处理流式分选的CT26肿瘤小鼠骨髓CD11b+Gr1+MDSC与对照组(PBS处理)相比,细胞凋亡率明显升高。具体表现为早期凋亡的细胞(Annexin V +/7-AAD-)较PBS处理对照组显著增多(17.2% & 5.2%,P < 0.001,n=3),坏死或晚期凋亡细胞百分比(Annexin V+/7-AAD+)也明显增加(20.5% & 7.9%,P < 0.01,n=3,图 1)。

|
图 1 C-K处理促进MDSC细胞凋亡 Figure 1 CK promotes apoptosis of MDSCs measured by Annexin V and 7-AAD staining. ***P < 0.001, **P < 0.01 by Student's t test (n=3). |
Cox-2和Arg-1是MDSC抑制CD8+ T细胞毒性功能相关的关键基因。我们用qRT-PCR比较了C-K处理组与PBS对照组的肿瘤小鼠骨髓MDSC中Cox-2和Arg-1基因在mRNA水平的表达变化。结果表明,C-K有效抑制了Cox-2和Arg-1基因的表达(P < 0.05,P < 0.01,n=3,图 2)。提示C-K有可能抑制MDSC的免疫抑制活性。
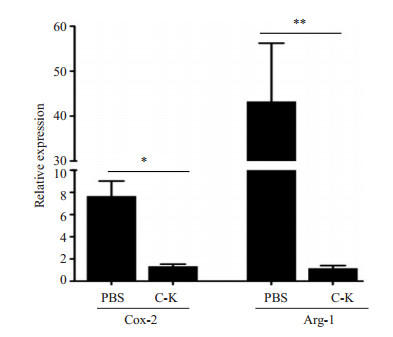
|
图 2 MDSC中Cox-2和Arg-1表达受C-K抑制 Figure 2 Expressions of Cox-2 and Arg-1 in MDSC treated with C-K detected by qRT-PCR. *P < 0.05, **P < 0.01 (n=3). |
IL-1β、IL-6和IL-17等促炎性细胞因子在肿瘤微环境中高度分泌并对肿瘤的增殖以及转移有着非常重要的促进作用。MDSC等髓性细胞被认为是肿瘤微环境中促炎性细胞因子分泌的重要细胞。ELISA检测结果表明,C-K处理MDSC组细胞培养上清中促炎性细胞因子水平如IL-1β(P < 0.05)、IL-6(P < 0.001,n=3)和IL-17(P < 0.05,n=3)均明显降低(图 3)。C-K能有效抑制体外培养的MDSC主要促炎性因子的分泌,而促炎性因子在肿瘤微环境中对肿瘤的增殖、侵润以及转移起到及其重要的促进作用。提示C-K可能通过抑制微环境中MDSC促炎性因子的分泌从而抑制肿瘤的增生。

|
图 3 C-K降低MDSC促炎性因子IL-1β、IL-6和IL-17分泌 Figure 3 Production of pro-inflammatory cytokines IL-1β, IL-6 and IL-17 by MDSCs treated with C-K (n=5). Results were from two independent experiments. *P < 0.05, **P < 0.001. |
为了进一步在体内证明,经C-K处理后能钝化MDSC的免疫抑制与促肿瘤生长能力。我们分别将C-K处理后MDSC或PBS处理后MDSC混合CT26 Balbl/c结肠癌细胞系皮下移植到野生型Balb/c小鼠。21 d后,断颈处死小鼠,比较接受C-K处理的MDSC+ CT26实验组小鼠(n=5~10只)和对照组小鼠(n=5~10只)皮下移植肿瘤生长情况。如图 4A所示,虽然两组小鼠均出现皮下移植肿瘤,但是C-K MDSC+CT26小鼠皮下的肿瘤直径明显小于对照组(P < 0.01,n=3)。HE染色肿瘤组织切片显示,对照组中肿瘤细胞增生明显,多见免疫细胞和间质细胞浸润。而实验组的免疫细胞浸润明显减少,肿瘤细胞增生减缓(图 4B)。上述结果表明C-K处理后减弱了MDSC对肿瘤细胞生长、增殖的促进作用。
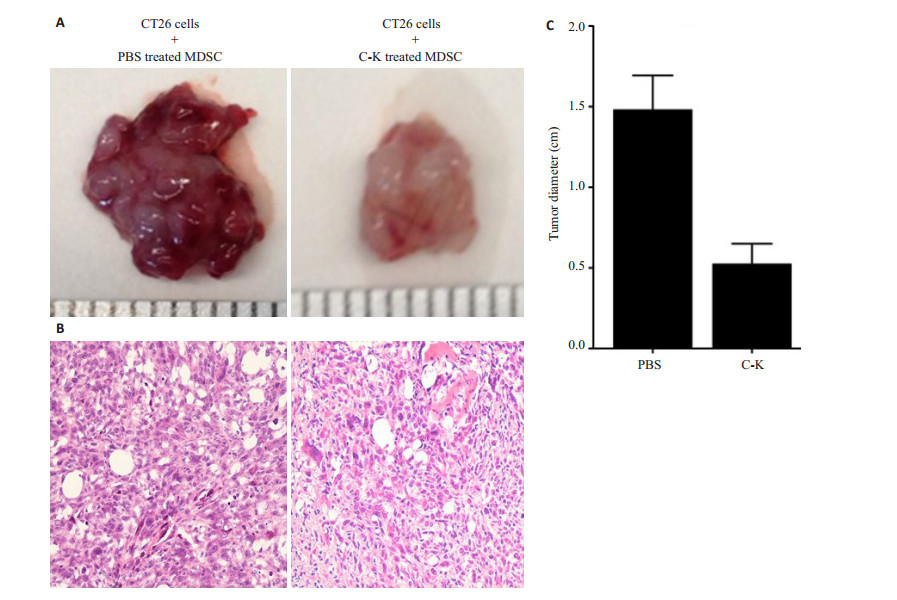
|
图 4 小鼠MDSC同CT26皮下共移植肿瘤模型 Figure 4 Tumor size in mice receiving co-implantation of CT26 cells and MDSCs pre-treated with C-K or PBS (A) and histological examination of the tumor (B, HE staining, original magnification, ×200). |
作为肿瘤微环境中非常重要的一群髓性免疫抑制细胞,MDSC分泌大量的促炎性细胞因子及趋化因子,从而促进肿瘤细胞的生长与增殖[11]。同时MDSC分泌PEG2,Arg-1等因子抑制细胞毒性CD8+ T细胞和树突细胞,协助肿瘤免疫逃逸[12]。基于MDSC在肿瘤形成中的重要作用,在结肠癌形成过程中,通过单克隆抗体中和MDSC表面表达Gr-1从而中和微环境中MDSC能非常有效地抑制肿瘤的形成[13]。鉴于MDSC在肿瘤微环境中的重要作用,目前靶向MDSC等髓性细胞是肿瘤的生物靶向治疗研究的热门领域,诸如拮抗MDSC表面抗原PD-L1的单克隆抗体已经广泛应用于结肠、乳腺和肺等肿瘤靶向治疗研究及早期临床试验[14-15]。
已有报道表明人参及西洋参肠道代谢产物C-K作用于JNK通路诱导人结肠癌HCT-116细胞的凋亡与自噬,具有一定肿瘤抑制能力[16]。研究亦发现,C-K能抑制组蛋白脱乙酰酶histone deacetylase (HDAC)活性,从而抑制肿瘤细胞的生长,促进其凋亡[6]。最新的研究也观察到C-K具有一定的免疫抑制潜能[9]。但是迄今为止,C-K对CD11b+Gr1+ MDSC这一类肿瘤微环境中极其重要的髓性免疫细胞的作用仍未得到研究。因此,我们选择肿瘤MDSC为研究C-K功能的靶细胞并通过小鼠结肠肿瘤移植模型证明了C-K能有效抑制MDSC的活性,从而延缓移植瘤的生长。本研究中,我们首先发现体外培养的肿瘤MDSC在C-K处理下,细胞增殖受到明显抑制,表现为早期凋亡细胞(Annexin V +/7 AAD-)和晚期凋亡或坏死细胞(Annexin V +/7 AAD+)均明显增多。随后我们发现,C-K能有效抑制肿瘤MDSC中Cox-2和Arg-1基因的表达,而这两者均是MDSC免疫抑制作用相关的关键基因。C-K对Cox-2和Arg-1的抑制为今后研究药物抑制MDSC免疫抑制活性提供了思路。此外,我们还测定了经C-K处理的MDSC上清中促炎性因子诸如IL-1β、IL-6和IL-17的水平,结果表明C-K能明显降低IL-1β、IL-6和IL-17的分泌,提示C-K能够有效调节MDSC的免疫活性。最后,我们用CT26小鼠结肠癌细胞系皮下诱导野生型Balb/c小鼠产生肿瘤,并共同注射经C-K处理的MDSC或对照PBS处理的MDSC。结果表明,接受C-K处理的MDSC+CT26肿瘤小鼠所生成的肿瘤直径明显小于接受PBS处理的MDSC+CT26对照组,HE染色也从形态学方面证实了C-K处理组的肿瘤形态特征弱于PBS对照组。肿瘤细胞和MDSC共移植实验进一步验证了我们上述体外实验结果,也提示了利用C-K进行体内肿瘤的免疫靶向治疗的可行性。
目前,药物靶向MDSC治疗肿瘤主要通过:(1)拮抗MDSC的免疫抑制活性。比如Sildenafil或Tadalafil等5型磷酸二酯酶(Phosphodiesterase-5, PDE-5)抑制剂主要通过作用于MDSC中cGMP通路,从而抑制MDSC免疫抑制相关Arg-1或NOS2的生成[17-18]。作用于Cox2的非甾体抗炎药(Nonsteroidal anti-inflammatory drugs, NSAID)往往也能有效的抑制MDSC的免疫抑制活性;(2)直接清除MDSC。例如中和MDSC表面抗原的单克隆抗体Gr1、Ly6G或者PD-L1等中和MDSC;(3)抑制MDSC发生发展的关键通路。JAK2/ STAT3/NFKB是MDSC和肿瘤中与促炎性因子IL-1β和IL-6分泌相关的关键通路。Seavey等[19]发现JAK2选择性抑制剂CEP-33779能有效抑制小鼠结肠癌肿瘤的生长。Tu等[20]也发现,中药成分姜黄素能有效抑制胃癌移植瘤小鼠MDSC中STAT3的磷酸化,降低IL-6的分泌并抑制MDSC的增殖。我们的研究首次发现C-K对MDSC的抑制作用,并在MDSC体外培养和体内共移植结肠瘤实验中得到了验证--C-K促进MDSC凋亡,抑制免疫抑制基因的表达以及降低促炎性因子的分泌。而Arg-1和Cox2等免疫抑制基因及IL-1β和IL-6等促炎性因子均受JAK2/STAT3这一通路所调控,此结果提示,C-K可能靶向于MDSC中JAK2/STAT3这一关键通路而实现对MDSC的抑制。事实上,红参肠道代谢产物C-K的代谢前底物的一种已被证实能有效抑制小鼠关节炎Th17细胞中STAT3的磷酸化[21]。本研究进一步提示了C-K可能是人参类中药作用于JAK/ STAT3通路的有效成分。
综上所述,本研究证实了C-K对肿瘤微环境中MDSC的抑制作用。这为今后研究小鼠的结肠癌肿瘤发生中MDSC的功能和作用机制提供了新的实验方法与经验,揭示了人参类重要代谢成分抑制肿瘤的新机制,并对肿瘤药物的筛选和研发提供了新的思路。但C-K对MDSC的具体抑制作用机制,还有待进一步探讨。
| [1] | Noh KH, Son JW, Kim HJ, et al. Ginsenoside compound K production from ginseng root extract by a thermostable beta-glycosidase from Sulfolobus solfataricus[J]. Biosci Biotechnol Biochem,2009, 73 (2) : 316-21. DOI: 10.1271/bbb.80525. |
| [2] | Chen Y, Xu Y, Zhu Y, et al. Anti-cancer effects of ginsenoside compound k on pediatric acute myeloid leukemia cells[J]. Cancer Cell Int,2013, 13 (1) : 24. DOI: 10.1186/1475-2867-13-24. |
| [3] | Park JS, Shin JA, Jung JS, et al. Anti-inflammatory mechanism of compound K in activated microglia and its neuroprotective effect on experimental stroke in mice[J]. J Pharmacol Exp Ther,2012, 341 (1) : 59-67. DOI: 10.1124/jpet.111.189035. |
| [4] | Igami K, Shimojo Y, Ito H, et al. Hepatoprotective effect of fermented ginseng and its major constituent compound K in a rat model of paracetamol (acetaminophen)-induced liver injury[J]. J Pharm Pharmacol, 2014 Dec 10. doi: 10.1111/jphp.12342. |
| [5] | Cho SH, Chung KS, Choi JH, et al. Compound K, a metabolite of ginseng saponin, induces apoptosis via caspase-8-dependent pathway in HL-60 human leukemia cells[J]. BMC Cancer,2009, 9 : 449. DOI: 10.1186/1471-2407-9-449. |
| [6] | Kang KA, Piao MJ, Kim KC, et al. Compound K, a metabolite of ginseng saponin, inhibits colorectal cancer cell growth and induces apoptosis through inhibition of histone deacetylase activity[J]. Int J Oncol,2013, 43 (6) : 1907-14. |
| [7] | Dougherty U, Mustafi R, Wang Y, et al. American ginseng suppresses Western diet-promoted tumorigenesis in model of inflammation-associated colon cancer: role of EGFR[J]. BMC Complement Altern Med,2011, 11 : 111. DOI: 10.1186/1472-6882-11-111. |
| [8] | Wang CZ, Du GJ, Zhang Z, et al. Ginsenoside compound K, not Rb1, possesses potential chemopreventive activities in human colorectal cancer[J]. Int J Oncol,2012, 40 (6) : 1970-6. |
| [9] | Ma PF, Jiang J, Gao C, et al. Immunosuppressive effect of compound K on islet transplantation in an STZ-induced diabetic mouse model[J]. Diabetes,2014, 63 (10) : 3458-69. DOI: 10.2337/db14-0012. |
| [10] | Umansky V, Sevko A, Gebhardt C, et al. Myeloid-derived suppressor cells in malignant melanoma[J]. J Deuts Dermatol Ges,2014, 12 (11) : 1021-7. |
| [11] | Solito S, Marigo I, Pinton L, et al. Myeloid-derived suppressor cell heterogeneity in human cancers[J]. Ann N Y Acad Sci,2014, 1319 : 47-65. DOI: 10.1111/nyas.2014.1319.issue-1. |
| [12] | Alizadeh D, Larmonier N. Chemotherapeutic targeting of cancerinduced immunosuppressive cells[J]. Cancer Res,2014, 74 (10) : 2663-8. DOI: 10.1158/0008-5472.CAN-14-0301. |
| [13] | Yan HH, Pickup M, Pang Y, et al. Gr-1+CD11b+ myeloid cells tip the balance of immune protection to tumor promotion in the premetastatic lung[J]. Cancer Res,2010, 70 (15) : 6139-49. DOI: 10.1158/0008-5472.CAN-10-0706. |
| [14] | Deng L, Liang H, Burnette B, et al. Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice[J]. J Clin Invest,2014, 124 (2) : 687-95. DOI: 10.1172/JCI67313. |
| [15] | Noman MZ, Desantis G, Janji B, et al. PD-L1 is a novel direct target of HIF-1α, and its blockade under hypoxia enhanced MDSCmediated T cell activation[J]. J Exp Med,2014, 211 (5) : 781-90. DOI: 10.1084/jem.20131916. |
| [16] | Kim AD, Kang KA, Kim HS, et al. A ginseng metabolite, compound K, induces autophagy and apoptosis via Generation of reactive Oxygen species and activation of JNK in human colon cancer cells[J]. Cell Death Dis,2013, 4 : e750. DOI: 10.1038/cddis.2013.273. |
| [17] | Meyer C, Sevko A, Ramacher M, et al. Chronic inflammation promotes myeloid-derived suppressor cell activation blocking antitumor immunity in transgenic mouse melanoma model[J]. Proc Natl Acad Sci USA,2011, 108 (41) : 17111-6. DOI: 10.1073/pnas.1108121108. |
| [18] | Weed DT, Vella JL, Reis IM, et al. Tadalafil reduces myeloidderived suppressor cells and regulatory T cells and promotes tumor immunity in patients with head and neck squamous cell carcinoma[J]. Clin Cancer Res,2015, 21 (1) : 39-48. DOI: 10.1158/1078-0432.CCR-14-1711. |
| [19] | Seavey MM, Lu LD, Stump KL, et al. Therapeutic efficacy of CEP-33779, a novel selective JAK2 inhibitor, in a mouse model of colitis-induced colorectal cancer[J]. Mol Cancer Ther,2012, 11 (4) : 984-93. DOI: 10.1158/1535-7163.MCT-11-0951. |
| [20] | Tu SP, Jin H, Shi JD, et al. Curcumin induces the differentiation of myeloid-derived suppressor cells and inhibits their interaction with cancer cells and related tumor growth[J]. Cancer Prev Res (Phila),2012, 5 (2) : 205-15. DOI: 10.1158/1940-6207.CAPR-11-0247. |
| [21] | Jhun J, Lee J, Byun JK, et al. Red ginseng extract ameliorates autoimmune arthritis via regulation of STAT3 pathway, Th17/Treg balance, and osteoclastogenesis in mice and human[J]. Mediators Inflamm,2014 : 351856. |
 2015, Vol. 35
2015, Vol. 35
