鼻咽癌(nasopharyngeal carcinoma, NPC)是一种分化低、转移早、地域性明显的头颈部常见肿瘤,因目前临床缺乏特异的肿瘤分子标志物,其早期诊断较为困难,5年生存率始终约70% [1-2]。因此,寻找有效的标志物进行早期发现、预测预后、监测复发或转移,对鼻咽癌的诊疗具有极其重要的临床意义。
MiRNA是一类广泛存在于生物体内的长度约18~22 nt的非编码单链小分子RNA,通过与靶基因mRNA的3'非编码区(3' untranslated region, 3'UTR)不完全互补配对,在转录后水平抑制基因表达,目前研究表明50%以上的miRNA定位在肿瘤相关基因组区域(包括杂合子缺失区、染色体扩增区和脆性位点等),广泛参与肿瘤的发生、发展、转移等各个阶段[3]。自Mitchell等[4]首次证明miRNA在血浆和血清中稳定存在后,越来越多的研究显示多种肿瘤患者的外周血中都具有特异性循环miRNA的表达。血浆循环miRNA作为癌症的非侵入性诊断和预后评价的标志物正显示出良好的应用前景[5]。
MiR-24首次于2001年被发现,广泛存在于哺乳动物多种组织中,发挥调节细胞生长及凋亡的功能[6]。现有的研究显示,miR-24在多种实体瘤组织中表达异常,扮演抑癌[7-11]或促癌[12-15]的不同角色,但在肿瘤患者血浆中表达的研究相对较少。最新研究表明,鼻咽癌组织中miR-24的表达与放疗后复发有关[16],但对于鼻咽癌血浆中的研究尚缺乏大量资料。本研究拟通过检测miR-24在鼻咽癌患者血浆中的表达及其治疗前后变化情况,探讨血浆miR-24作为鼻咽癌诊断及预后评价指标的临床应用价值。
1 材料和方法 1.1 材料 1.1.1 病例资料2007年12月~2011年6月在南方医院耳鼻喉科住院的初诊鼻咽癌患者217例,抽取6~8 ml EDTA抗凝全血,同期住院的慢性化脓性中耳炎或慢性鼻窦炎病人73例作为对照,所有患者均签署知情同意书一份。本研究通过美国NIH下属ClinicalTrials.gov临床试验注册审查批准,批准号NCT01171235;并通过南方医院伦理委员会批准。
1.1.2 主要试剂Trizol LS、外源miRNA、通用引物及特异引物均购自Invitrogen,All-in-OneTM miRNA First-Strand cDNA Synthesis Kit和SYBR Green All-in-OneTM miRNA qPCR Kit均为美国Gene Copoeia产品,其他常规分子生物学试剂均购自Sigma。超低温冰箱MDF-U32V (V)为日本SANYO产品;低温离心机LEGEND MICRO 17R为Thermo产品;NanoDrop® Spectrophotometer ND-1000微量核酸定量仪为Gene公司产品;Gene Amp 9700型PCR仪为ABI (Applied Biosystems)公司产品;LightCycler 480Ⅱ荧光定量PCR仪为Roch公司产品,分析软件为LightCycler 480 software release 1.5.0 SP3。
1.2 方法 1.2.1 血浆标本的分离与保存采集患者的EDTA抗凝外周静脉血10 ml,4 h内处理血标本。血标本在4 ℃下1800 r/min离心5 min,分装上层血浆至1.5 ml Eppendorf管,随后在4 ℃下12 000 g离心10 min去除细胞成分,转移血浆至新的1.5 ml Eppendorf管,-80 ℃保存以备后续miRNA抽提。
1.2.2 血浆miRNA检测运用Trizol法从保存的患者血浆中提取总RNA,在总RNA中加入外源性人工合成线虫miRNA之Cel-39后按照Gene Copoeia公司All-in-OneTM miRNA First-Strand cDNA Synthesis Kit说明书进行逆转录操作。按照SYBR Green All-inOneTM miRNA qPCR Kit的说明书配置PCR反应体系,反应条件为95 ℃,10 min;(95 ℃,10 s,60 ℃,20 s,72 ℃,15 s),45 cycles;95 ℃,5 s;65 ℃,1 min;97 ℃,15 s。PCR反应体系中的下游引物使用试剂盒提供的通用引物,所用的miR-24上游引物序列为TGGCTCAGTTCAGCAGGAACAG,以合成的cDNA为模板,U6 snRNA为内参照,Cel-miR-39为阳性对照,H2O为阴性对照,检测各样本中的miR-24的相对表达水平。使用罗氏公司的LightCycler 480Ⅱ荧光定量PCR仪进行荧光定量PCR反应,机器自带分析软件LightCycler 480 software release 1.5.0 SP3自动分析,检测各模板的Ct值(C代表cycle,T代表threshold),所有样品均采用复孔检查,阴性对照以DNase/ RNase-free water为模板。以Folds=2-△△Ct表示各样本检测指标表达的倍比关系。
1.3 统计学处理采用SPSS13.0软件进行统计分析,两组间年龄采用独立样本t检验;性别采用χ2检验;以ΔCt作为miR-24统计指标,两组间采用协方差分析;miR-24与T、N及临床分期采用Kruskal-Wallis多个独立样本非参数检验,与M分期采用Mann-Whitney U两独立样本非参数检验;Spearman非参数相关分析miR-24与鼻咽癌病人的T、N、M及临床分期相关性及血浆EBV-DNA;ROC曲线(受试者工作特征,receiver operating characteristic)分析miR-24的诊断效率。P < 0.05为差异有统计学意义。
2 结果 2.1 两组病例基本资料按照鼻咽癌2008分期,鼻咽癌组Ⅰ期10例,Ⅱ期52例,Ⅲ期69例,Ⅳ期86例(17例M1)。两组病人基本资料见表 1,217例鼻咽癌组男:女为2.19:1,73例对照组男:女为2.17:1,两组之间性别无统计学差异(χ2=0.001,P=0.978)。鼻咽癌组病人平均年龄45.93±11.78岁,最大77岁,最小17岁,高发年龄在35~55岁之间。对照组年龄最大75岁,最小18岁,平均40.08±10.79岁。两组间年龄有统计学差异(t=3.745,P < 0.001,表 1)。
| 表 1 两组病人基本资料表 Table 1 General data of the two groups of patients |
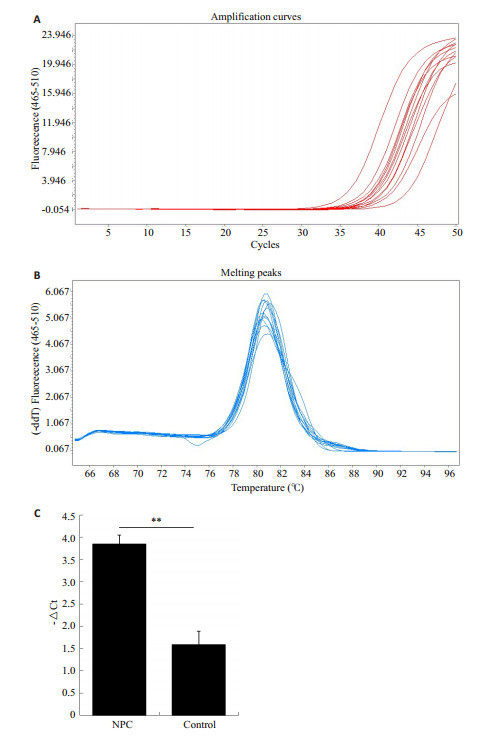
miR-24及内参照U6、外源阳性对照Cel-39的熔解曲线分析未见杂峰(图 1B),说明扩增产物单一,没有非特异性扩增。从扩增曲线可见所有样品均已进入扩增平台期(图 1A),说明反应条件设定准确。结果显示,血浆miR-24在鼻咽癌组(△Ct:-3.851±2.881)的相对表达水平为对照组(△Ct:-1.586±2.594)的4.808倍,差异具有显著性(P < 0.001,图 1C)。以血浆miR-24表达为自变量,年龄为协变量,协方差分析结果提示两组间有显著统计学差异(P < 0.001)。
|
图 1 血浆miR-24的表达 Figure 1 Plasma miR-24 expression detected by real-time PCR in. A: Amplification curves; B: Melting curves; C: Relative fold in NPC to normal group. **P < 0.001. |
采用Kruskal-Wallis多个独立样本非参数检验(T、N分期)或Mann-Whitney U两独立样本非参数检验(M分期),结果显示,血浆miR-24在不同T分期之间有统计学差异(χ2=12.074,P=0.007),而不同N分期虽然表达量有明显差异,但之间无统计学差异(χ2=7.546,P=0.056),血浆miR-24表达量在M分期中无统计学差异(Z=-0.350,P=0.726),而在临床分期中的差异具有统计学意义(χ2=11.332,P=0.010,表 2)。
| 表 2 血浆miRNA-24在T、N、M及临床分期中表达 Table 2 Expression of miR-24 in NPC patients with different TNM and clinical stages |
进一步采用Spearman非参数相关分析,结果显示,T分期与血浆miR-24相关性无统计学差异(r=-0.090,P=0.188);N分期与miR-24呈负相关性(r=-0.149,P=0.028),随N分期增加,血浆miR-24表达量逐渐下降,提示血浆miR-24可能为鼻咽癌早期转移表达的miRNA分子;M分期与血浆miR-24表达量相关性无统计学差异(r=0.024,P=0.727),血浆miR-24与临床分期无明显相关性(r=-0.086,P=0.205)。
2.4 MiR-24表达量与鼻咽癌病人血浆EBV-DNA相关性分析采用Spearman非参数相关分析,结果显示,鼻咽癌病人血浆EBV-DNA与血浆miR-24呈负相关(r=-0.140,P=0.048),提示miR-24可能与鼻咽癌EBV存在相互调控关系,具体上下游关系有待进一步验证。
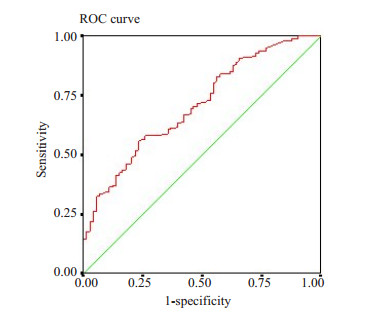
2.5 MiR-24的诊断价值分析采用ROC曲线(受试者工作特征,receiver operating characteristic)分析血浆miR-24对于本组鼻咽癌的诊断效率,结果显示(图 2),血浆miR-24诊断效率曲线下面积达到0.707,灵敏度为66.8%,特异性为57.5%。
|
图 2 血浆miR-24 ROC曲线 Figure 2 ROC curve of miR-24 in plasma. |
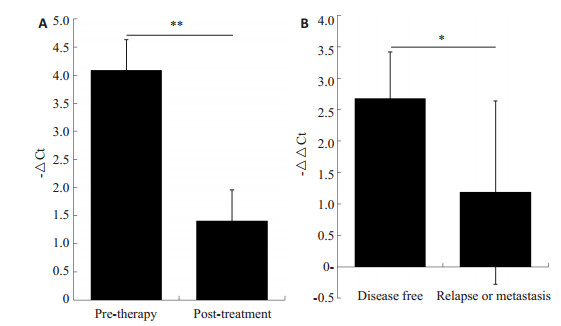
在上述鼻咽癌患者中,对41例治疗前后完整资料的患者进行血浆miR-24表达的比较。其中男性31例,女性10例,按抽血时间计算,治疗后>24个月12例,12~24个月9例,3~12个月7例, < 3个月7例,复发或转移5例,失访1例。其中对36例无复发或转移的病例治疗前后血浆miR-24表达变化采用配对t检验,结果显示(图 3A),miR-24治疗后血浆含量(-△ Ct=1.404±2.718)较治疗前(-△ Ct=4.077±3.328)下降,有统计学差异(t=3.586,P=0.001)。36例生存病人(-△ △Ct=2.674±4.474)与5例复发或转移病人(-△ △Ct=1.182±3.264)相比(图 3B),血浆miR-24的表达显示无统计学差异(t=0.716,P=0.478),由于复发或转移组病例较少,有待进一步扩大样本验证。
|
图 3 治疗前后miR-24的变化及与预后的关系 Figure 3 Changes of miR-24in the NPC patients after treatment (A) and its correlation with patients' outcomes (B). |
自2008年首次发现肿瘤病人血浆中存在miRNA的差异表达后[17],越来越多的报道证实多种肿瘤血浆中miRNA存在差异表达,并与诊断、治疗敏感性及预后相关,显示了良好的应用前景[5]。同时,血浆miRNA作为肿瘤分子标志物具有以下优点:(1)肿瘤病人血浆miRNA表达谱有明显异常并且有组织特异性趋势;(2)在血浆中稳定;(3)样本容易且可反复获得;(4)miRNA发生早于基因及蛋白的变化,容易早期发现。因此,利用血浆中的差异miRNA对于肿瘤早期诊断、进行预后指导的这一非侵袭性检测方法日益受到重视。
MiR-24在人类中的表达分为两种:miR-24-1和miR-24-2,分别位于9号和19号染色体,在肿瘤发生发展中对细胞增殖、分化和凋亡的调控起重要的作用[6]。miR-24在肿瘤中的作用研究目前不多,现有的研究发现其在不同肿瘤中扮演着不同的角色。文献报道在胶质瘤[7]、喉癌[8]、大肠癌[9]、骨肉瘤[10]、前列腺癌[11]、胃癌[12]中起抑癌作用,而在乳腺癌[13]、舌癌[14]、肝癌[15]中起促癌作用。我们推测这一看似矛盾的现象原因在于在不同细胞或相同细胞不同阶段miR-24的靶基因存在差异导致其具有不同生物学功能。而在对于鼻咽癌的miR-24研究尚处于起步阶段,仅2014年Wang等[16]发表于Mol Cancer Ther的文章首次提出miR-24在6对配对病人组织中,放疗后复发的患者miR-24表达下调。而Ye等[18]发表于Oncotarget的文章中应用microarray芯片筛选出的鼻咽癌血浆中44个上调的miRNA正包含有miR-24,但在该研究中也无大量临床样本验证。至今为止,尚缺乏大宗样本的鼻咽癌患者的T、N、M及临床分期与miR-24关联性研究。
本研究首次在鼻咽癌患者血浆中检测miR-24的表达,分析其与鼻咽癌患者分期、预后的关系,评价其诊断价值并对其治疗前后的变化情况及意义进行初步探讨。我们的结果显示miR-24在鼻咽癌血浆中高表达,进一步分析发现与N分期呈负相关,提示血浆miR-24可能为鼻咽癌早期转移表达的miRNA分子。同时血浆miR-24与血浆EBV-DNA呈负相关,提示miR-24可能与鼻咽癌EBV存在某种相互调控关系,目前有文献报道EB病毒III型潜伏感染可上调淋巴细胞及淋巴瘤中miR-24的表达[18],但在EB病毒为Ⅱ型感染的鼻咽癌中二者如何相互调控,有待进一步研究。在采用ROC曲线分析血浆miR-24对于本组鼻咽癌的诊断效率后,我们发现血浆miR-24诊断效率曲线下面积达到0.707,灵敏度为66.8%,特异性为57.5%,显示出一定的临床应用价值。
血浆miRNA的动态变化是否与病情一致是肿瘤分子标志物的重要研究内容之一,我们的研究发现在36例无复发或转移的病例治疗前后miR-24治疗后血浆含量较治疗前下降,有统计学差异。此结果与近期的一项研究结果类似[19]。而在与5例复发或转移病人的比较中,在复发组miR-24表达量较低,此结果虽与杨惠玲等[16]的结果一致,但统计显示有无复发或转移两组间miR-24的表达无统计学差异,考虑原因可能与复发转移组病例数较少有关,有待进一步扩大样本量进行验证。
同时在实验初期,我们发现,由于血浆miRNA的含量较低,荧光定量PCR的结果存在不稳定性。为了得到稳定、真实、可靠、可重复的数据,我们总结了在试验操作中以下问题需要注意:(1)血浆处理的标准化:主要指血液离体后的处理流程。为了得到准确、稳定数值,我们的研究中严格血标本处理流程,标本离体后4 h内处理完毕,同时多管分装,避免反复冻融;(2)内参照标准化:不同于细胞或组织,目前血浆miRNA研究所采用的内参照并不统一,主要采用以下三种方式:(a)高表达的miR-16,(b)U6,(c)抽提血浆RNA后加入外源的人工合成miRNA(主要是线虫miR-39)。其他如采用miR-223、let-7等罕见miRNA的报道较少。最近关于内参照的研究结果显示U6及miR-16作为内参稳定性均较好[20]。我们的研究中发现采用U6或外源线虫miR-39作为内参照时结论基本一致,但采用miR-16则得出完全相反的结果,基本所有miRNA指标在肿瘤中均为低表达,与常理不符,所以最终采用了U6作为内参照,其CT值基本在35~40之间,具备良好的重复性,满足实验需求;(3)EDTA或柠檬酸纳的去除:由于临床抽血时抗凝通常使用EDTA或柠檬酸纳,二者在抽提过程中不易完全去除,可对RT-qPCR有明显抑制作用[21]。针对此项,我们采用SiO2沉淀法,较有效去除了EDTA的影响,为实验的顺利进行提供了技术保障。
本研究利用大宗鼻咽癌病人血标本,结合详细临床资料及随访对血浆miR-24在鼻咽癌中的临床应用价值展开了探讨,初步阐明了鼻咽癌血浆miR-24异常表达的临床意义,为鼻咽癌的早期诊断、预后分析提供了新的思路。
| [1] | Lee CC, Huang TT, Lee MS, et al. Clinical application of tumor volume in advanced nasopharyngeal carcinoma to predict outcome[J]. Radiat Oncol,2010, 11 (5) : 20. |
| [2] | Wei KR, Yu YL, Yang YY, et al. Epidemiological trends of nasopharyngeal carcinoma in China[J]. Asian Pac J Cancer Prev,2010, 11 (1) : 29-32. |
| [3] | Esquela-Kerscher A, Slack FJ. Oncomirs -microRNAs with a role in cancer[J]. Cancer,2006, 6 (4) : 259-69. |
| [4] | Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA,2008, 105 (30) : 10513-8. DOI: 10.1073/pnas.0804549105. |
| [5] | Ferracin M, Veronese A, Negrini M. Micromarkers: miRNAs in cancer diagnosis and prognosis[J]. Expert Rev Mol Diagn,2010, 10 (3) : 297-308. DOI: 10.1586/erm.10.11. |
| [6] | Sun F, Wang J, Pan Q, et al. Characterization of function and regulation of miR-24-1 and miR-31[J]. Biochem Biophys Res Commun,2009, 380 (3) : 660-5. DOI: 10.1016/j.bbrc.2009.01.161. |
| [7] | Xu W, Liu M, Peng X, et al. miR-24-3p and miR-27a-3p promote cell proliferation in glioma cells via cooperative regulation of MXI1[J]. Int J Oncol,2013, 42 (2) : 757-66. |
| [8] | Guo Y, Fu W, Chen H, et al. miR-24 functions as a tumor suppressor in Hep2 laryngeal carcinoma cells partly through down-regulation of the S100A8 protein[J]. Oncol Rep,2012, 27 (4) : 1097-103. |
| [9] | Mishra PJ, Song B, Mishra PJ, et al. MiR-24 tumor suppressor activity is regulated Independent of p53 and through a target site polymorphism[J]. PLoS One,2009, 4 (12) : e8445. DOI: 10.1371/journal.pone.0008445. |
| [10] | Song L, Yang J, Duan P, et al. MicroRNA-24 inhibits osteosarcoma cell proliferation both in vitro and in vivo by targeting LPAATβ[J]. Arch Biochem Biophys,2013, 535 (2) : 128-35. DOI: 10.1016/j.abb.2013.04.001. |
| [11] | Goto Y, Kojima S, Nishikawa R, et al. The microRNA-23b/27b/ 24-1 cluster is a disease progression marker and tumor suppressor in prostate cancer[J]. Oncotarget,2014, 5 (17) : 7748-59. DOI: 10.18632/oncotarget. |
| [12] | Duan Y, Hu L, Liu B, et al. Tumor suppressor miR-24 restrains gastric cancer progression by downregulating RegIV[J]. Mol Cancer,2014, 13 (2) : 127. |
| [13] | Yin JY, Deng ZQ, Liu FQ, et al. Association between mir-24 and mir-378 in formalin-fixed paraffin-embedded tissues of breast cancer[J]. Int J Clin Exp Pathol,2014, 7 (7) : 4261-7. |
| [14] | Liu X, Wang A, Heidbreder CE, et al. MicroRNA-24 targeting RNA-binding protein DND1 in tongue squamous cell carcinoma[J]. FEBS Lett,2010, 584 (18) : 4115-20. DOI: 10.1016/j.febslet.2010.08.040. |
| [15] | Ma Y, She XG, Ming YZ, et al. miR-24 promotes the proliferation and invasion of HCC cells by targeting SOX7 tumour biology: the journal of the international society for oncodevelopmental[J]. Biology and Medicine,2014, 35 (11) : 10731-6. |
| [16] | Wang S, Zhang R, Claret FX, et al. Involvement of microRNA-24 and DNA methylation in resistance of nasopharyngeal carcinoma to ionizing radiation[J]. Mol Cancer Ther,2014, 13 (12) : 3163-74. DOI: 10.1158/1535-7163.MCT-14-0317. |
| [17] | Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res,2008, 18 (10) : 997-1006. DOI: 10.1038/cr.2008.282. |
| [18] | Ye SB, Li ZL, Luo DH, et al. Tumor-derived exosomes promote tumor progression and T-cell dysfunction through the regulation of enriched exosomal microRNAs in human nasopharyngeal carcinoma[J]. Oncotarget,2014, 5 (14) : 5439-52. DOI: 10.18632/oncotarget. |
| [19] | Sochor M, Basova P, Pesta M, et al. Oncogenic microRNAs: miR-155, miR-19a, miR-181b, and miR-24 enable monitoring of early breast cancer in serum[J]. BMC Cancer,2014, 14 (5) : 448. |
| [20] | Song J, Bai Z, Han W, et al. Identification of suitable reference genes for qPCR analysis of serum microRNA in gastric cancer patients[J]. Dig Dis Sci,2012, 57 (4) : 897-904. DOI: 10.1007/s10620-011-1981-7. |
| [21] | Kroh EM, Parkin RK, Mitchell PS, et al. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR)[J]. Methods,2010, 50 (4) : 298-301. DOI: 10.1016/j.ymeth.2010.01.032. |
 2015, Vol. 35
2015, Vol. 35
