急性T淋巴细胞白血病是一种来源于T淋巴细胞的恶性程度高,预后差的恶性克隆性疾病,大约占成人急性淋巴细胞白血病的25%。儿童急性淋巴细胞白血病的10%~15% [1]。随着新的化疗药物和方案的应用,其预后有了很大改善,但其耐药和复发仍是临床治疗面临的难题。
成人T细胞白血病/淋巴瘤(adult T-cell leukemia/ lymphoma)是由HTLV-1感染引起,但普通型急性T淋巴细胞白血病的确切病因迄今不明。我们前期研究发现,人内源性逆转录病毒HERV-K编码的Np9基因在人急性T淋巴细胞白血病中呈异常激活状态,具有促进白血病细胞增殖的作用,该结果提示抑制HERV-K Np9基因表达可能为治疗人急性T淋巴细胞白血病提供一种新的希望[2]。因此,筛选具有抑制HERV-K Np9基因功能的药物有可能为寻找新的抗白血病药提供新的方向。
雷公藤甲素是从中草药雷公藤中提取出来的一种环氧二萜内酯成分[3],具有抗炎、免疫调节[4-5]、抗肿瘤等作用[6]。已有研究表明雷公藤甲素能够活化抑癌基因p53促进肿瘤细胞凋亡[7],诱导Bcl-2剪切和线粒体依赖的途径导致凋亡[8],并且能够下调周期相关因子cyclin D1和Bcl-x[9]。Titov等[10]研究发现,抑制肿瘤细胞RNA聚合酶Ⅱ转录作用是雷公藤甲素发挥抗癌作用的重要机制之一,而RNA聚合酶Ⅱ已被证实是所有已知逆转录病毒基因转录必需的[11]。因此,我们推测雷公藤甲素可能是一种HERV-K Np9 mRNA基因转录抑制剂,通过抑制RNA聚合酶Ⅱ而抑制Np9 mRNA的表达,进而抑制其下游信号通路发挥抗肿瘤作用。本研究通过检测雷公藤甲素作用于Jurkat细胞后细胞凋亡、Np9基因转录水平及其下游信号分子c-myc,β-catenin,ERK,AKT和Notch1蛋白水平的变化,探讨雷公藤甲素诱导Jurkat细胞凋亡的可能分子机制,为人T淋巴细胞白血病的治疗提供新的科学依据。
1 材料和方法 1.1 材料 1.1.1 Jurkat细胞来自于浙江大学肿瘤研究所细胞库 1.1.2 试剂及抗体RPMI 1640细胞培养基购于Gibco;胎牛血清购于Biological Industries;MTT粉剂购于Sigma;Np9全长上游引物:5-ATGAACCCATCGGAG ATGCAA-3,下游引物:5-ACAGAATCTCAAGGCAG AAG-3;内参β-actin上游引物:5-GGATCCGACTTCG AGCAAGAGATGGCCAC-3,下游引物:5-CAATGCC AGGGTACATGGTG-3;上述引物均由Invitrogen上海合成部合成。RNA提取试剂购于Invitrogen;逆转录酶试剂盒购于Promega;DL2000 DNA ladder、Taq polymerase购于Takara公司;琼脂糖购于生工生物工程公司,Gelred核酸凝胶染料购于美国Biotium公司,一抗:β-catenin,p-ERK,ERK,p-AKT,AKT和Notch1,c-myc购于CST;GAPDH购于康成生物;二抗:HRP偶联的抗兔、抗鼠购于康成生物;PVDF膜购于BIO-RAD;ECL购于PIERCE。AV/PI细胞凋亡试剂盒购于美国BD公司。
1.2 方法 1.2.1 细胞培养Jurkat细胞用含有10%胎牛血清,1%青-链霉素的RPMI 1640培养,置于37 ℃,5% CO2,饱和湿度培养箱,实验所用细胞均处于对数期。
1.2.2 MTT法检测雷公藤甲素对Jurkat细胞的增殖抑制率将细胞悬液(5×104/ml)加入到96孔培养板中,每孔100 μl,培养4 h后,根据实验要求加入不同浓度的雷公藤甲素100 μl,另设空白孔(只有培养基,无细胞),不加药对照,每组6个复孔。培养72 h后,每孔加入20 μl的5 mg/ml的MTT溶液,反应4 h,离心吸去培养基,每孔加200 μl DMSO摇匀后酶标仪(波长570 nm)测其吸光度值(A)。利用公式测定抑制率(%)=(1-A 实验组/A 对照组)× 100%,然后用OriginPro8计算出IC50。
1.2.3 流式细胞仪检测雷公藤甲素诱导Jurkat细胞凋亡Jurkat细胞(1×105 /ml),按照0、2、4、8、16 nmol/L浓度,加入雷公藤甲素处理,48 h后收集细胞,用冷的PBS洗两遍,取1×106个细胞加入1 ml结合缓冲液重悬,取100 μl加入Annexin V/FITC 5 μl和PI 5 μl,混匀室温避光孵育15 min,然后加入400 μl结合缓冲液,采用流式细胞仪进行细胞凋亡检测。
1.2.4 雷公藤甲素Jurkat细胞Np9 mRNA表达水平的影响Jurkat细胞(1×105/ml),按照0、2、4、8、16 nmol/L浓度,加入雷公藤甲素处理,48 h后收集细胞,按Trizol说明书方法提取总RNA,以2 μg总RNA为模板逆转录成cDNA,按照Taq polymerase说明书进行半定量RT-PCR,PCR产物5 μl进行琼脂糖电泳,紫外灯下显像。用Kodak 1D 3.6软件对条带进行定量。mRNA相对含量=目的基因条带积分吸光度值/内参照β-actin,基因条带积分吸光度值。采用统计软件SPSS 19.0分析Np9转录抑制与细胞凋亡的相关性。
1.2.5 Western blotting检测雷公藤甲素对c-myc,β-catenin,p-ERK,ERK,p-AKT,AKT和Notch1等蛋白的影响Jurkat细胞(1×105/ml),按照0、2、4、8、16 nmol/L浓度,加入雷公藤甲素处理,48 h后收集细胞,冷PBS洗2遍,用M-PER(PIERCE)裂解液冰上裂解20 min,4 ℃ 14 000 g离心15 min,提取上清总蛋白。BCA法测蛋白浓度,取40 μg总蛋白进行SDS-PAGE电泳,转膜,用含5%奶粉的TBST室温1 h。一抗4 ℃过夜,二抗室温1 h,ECL显影,胶片曝光成像。
1.3 统计学处理统计分析,多个样本均数的比较采用方差分析,统计软件为SPSS 19.0,数据以均数±标准差表示,P < 0.05认为差异有统计学意义。
2 结果 2.1 雷公藤甲素对Jurkat细胞的增殖抑制作用(0.5~64)nmol/L浓度范围内的雷公藤甲素对Jurkat细胞具有增殖抑制作用,随着浓度的增高,抑制作用增强,提示雷公藤甲素对Jurkat细胞的增殖抑制作用呈剂量依赖关系。0.5~64 nmol/L浓度雷公藤甲素对Jurkat细胞的增殖抑制率与阴性对照组相比均具有显著统计学差异(图 1,P < 0.05)。
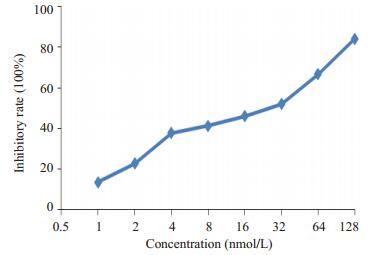
|
图 1 不同浓度雷公藤甲素对Jurkat细胞增殖抑制率的影响 Figure 1 Effects of triptolide at different concentrations on the proliferation of Jurkat cells. |
0、2、4、8、16 nmol/L的雷公藤甲素处理Jurkat细胞48 h后,细胞的凋亡比例分别为5.2%,16.3%,23.5%,29.9%,57.3%,随着药物浓度的上升而增加,呈剂量依赖(图 2),提示雷公藤甲素能够诱导Jurkat细胞凋亡。
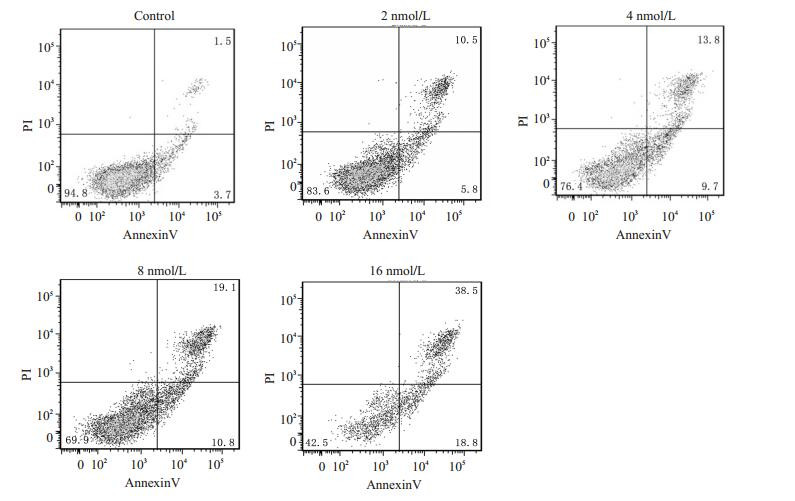
|
图 2 不同浓度雷公藤甲素对Jurkat细胞凋亡的情况 Figure 2 Effects of triptolide at different concentrations on the apoptosis of Jurkat cells. |
0、2、4、8、16 nmol/L的雷公藤甲素处理Jurkat细胞48 h后,随着药物浓度的升高,Np9的mRNA表达水平降低,各组Np9 mRNA表达水平分别为1.23,0.94,0.57,0.34,0.03,加药组和对照组比较,差异具有统计学意义(P < 0.05),(图 3),说明雷公藤甲素能够下调Np9基因的mRNA表达水平,呈剂量依赖。
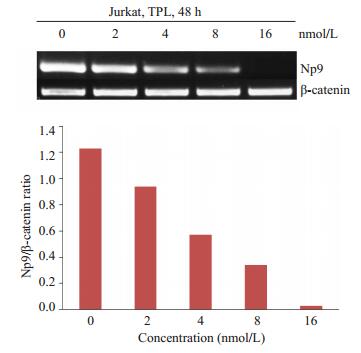
|
图 3 不同浓度雷公藤甲素对Jurkat细胞Np9 mRNA转录的影响 Figure 3 Effects of triptolide at different concentrations on levels of Np9 mRNA of Jurkat cells. |
由于Np9是白血病的可能的致病基因,而0、2、4、8、16 nmol/L的雷公藤甲素抑制Jurkat细胞中Np9转录的同时导致Jurkat细胞凋亡,所以采用统计软件SPSS 19.0进行分析Np9转录抑制与细胞凋亡的相关性。结果显示两者之间具有显著的相关性,R2=0.907,(P < 0.05,图 4)。提示0、2、4、8、16 nmol/L的雷公藤甲素抑制Np9转录可能是诱导细胞凋亡的重要机制之一。
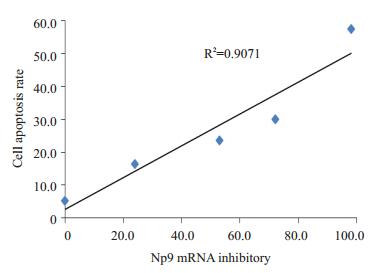
|
图 4 Np9 mRNA转录抑制与细胞凋亡的相关性 Figure 4 Correlation analysis between the inhibition of Np9 mRNA transcription and the cell apoptosis (R2=0.907, P < 0.05). |
Western blotting结果显示,0、2、4、8、16 nmol/L雷公藤甲素处理48 h后,c-myc,β-catenin,p-ERK,p-AKT和Notch1蛋白,随着药物浓度的上升,表达水平降低越明显。提示0、2、4、8、16 nmol/L雷公藤甲能够下调Np9下游信号分子c-myc,β-catenin,p-ERK,p-AKT和Notch1的蛋白表达水平(图 5)。
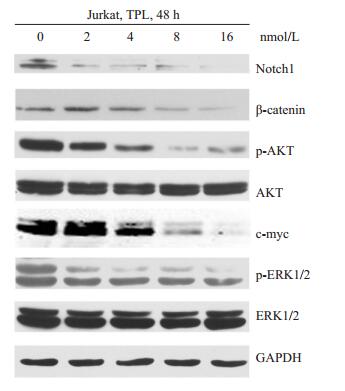
|
图 5 不同浓度雷公藤甲素对Np9下游信号分子c-myc, β-catenin, p-ERK, ERK, p-AKT, AKT和Notch1蛋白表达的影响 Figure 5 Effects of triptolide at different concentrations on the protein levels of c-myc, β-catenin, p-ERK, ERK, p-AKT, AKT and Notch1. R2=0.9071 60.0 |
目前临床治疗白血病主要面临的问题仍是复发和耐药,所以寻找新的治疗靶点,开发新的治疗药物,对于提高白血病的治疗效果十分必要。白血病发病机制不明导致缺乏有效的靶向病因治疗方法,Np9蛋白特异性表达于白血病人中,而正常人中却没有,并且在急性早幼粒白血病中,Np9蛋白解除PLZF(promyelocytic leukemia zinc finger)对原癌基因c-myc的抑制,促进白血病的发生和发展[12]。我们前期研究提示:人内源性逆转录病毒HERV-K Np9基因高表达于白血病人中,通过激活其下游c-myc,β-catenin,ERK,AKT和Notch1等多条信号通路促进白血病细胞增殖,可能是白血病发病的机制之一[2]。因此寻找针对Np9基因的抑制剂,有希望能够从病因上抑制甚至消除白血病。已有研究提示雷公藤甲素具有抑制RNA聚合酶Ⅱ的作用[10],因而推测雷公藤甲素能够抑制Np9基因,从而起到靶向治疗白血病的潜在价值。目前尚无相关的研究报道。
本研究中首先通过雷公藤甲素处理人T淋巴细胞白血病Jurkat细胞,结果导致Jurkat细胞增殖抑制和凋亡,呈剂量依赖,说明雷公藤甲素具有抑制和杀伤白血病细胞的作用,与Carter等[13]报道结果相吻合。雷公藤甲素抑制和杀伤白血病细胞,其分子机制是否涉及HERV-K Np9基因的变化?因而检测雷公藤甲素处理Jurkat细胞之后,HERV-K Np9基因的表达变化。结果发现HERV-K Np9基因表达水平降低,呈剂量依赖,说明雷公藤甲素可能是Np9基因的抑制剂,与我们的推断相符。雷公藤甲素诱导白血病细胞凋亡与其下调HERV-K Np9基因表达水平之间的关系呢?采用相关性分析发现,雷公藤甲素抑制Np9基因转录与诱导细胞凋亡之间具有显著的相关性(R2=0.907)。提示雷公藤甲素抑制Np9基因转录可能是其诱导白血病细胞凋亡的分子机制之一。如前所述,HERV-K Np9基因通过激活其下游c-myc,β-catenin,ERK,AKT和Notch1等多条信号通路促进白血病细胞增殖。由于雷公藤甲素能够抑制Np9基因转录,推测雷公藤甲素也能够影响Np9激活的c-myc,β-catenin等下游信号分子的表达水平。进一步研究发现,雷公藤甲素处理细胞之后,Np9下游的信号分子c-myc、β-catenin、ERK、Akt和Notch1蛋白表达水平同时降低。与我们前期研究采用shRNA下调Np9基因所观测到的其下游的这些信号分子的表达水平降低一致[2]。而且雷公藤甲素下调c-myc、β-catenin等信号分子,与其他的研究[14-17]中报道一致。c-myc在急性T淋巴白血病过度激活,活化下游Notch1,阻遏抑癌基因pten [18]。β-catenin在急性髓系白血病中高表达,介导混合系白血病干细胞的产生和耐药[19]。ERK促进白血病细胞生长和诱导产生耐药[20]。Akt见于大量白血病人中,其激活可以导致恶性血液系统肿瘤[21-22]。Notch1是调节干细胞功能的重要调节分子,阻断Notch1能够部分抑制甚至消除白血病干细胞的活性[23]。因此,雷公藤甲素抑制Np9基因转录的同时下调这些信号分子,对于抗白血病具有重要作用。
综上所述,我们认为雷公藤甲素通过抑制逆转录病毒HERV-K Np9基因转录并同时下调其下游信号分子c-myc、β-catenin、p-ERK、p-AKT和Notch1蛋白水平,可能是诱导人急性T细胞淋巴白血病Jurkat细胞凋亡的重要分子机制之一。
雷公藤甲素抑制Np9基因转录是否具有特异性,其详细的分子机制等问题仍需要进一步的研究。
| [1] | Ferrando AA, Neuberg DS, Staunton J, et al. Gene expression signatures define novel oncogenic pathways in T cell acute lymphoblastic leukemia[J]. Cancer Cell,2002, 1 (1) : 75-87. DOI: 10.1016/S1535-6108(02)00018-1. |
| [2] | Chen T, Meng Z, Gan Y, et al. The viral oncogene Np9 acts as a critical molecular Switch for co-activating beta-catenin, ERK, Akt and Notch1 and promoting the growth of human leukemia stem/ progenitor cells[J]. Leukemia,2013, 27 (7) : 1469-78. DOI: 10.1038/leu.2013.8. |
| [3] | Kupchan SM, Court WA, Dailey RJ, et al. Triptolide and tripdiolide, novel antileukemic diterpenoid triepoxides from Tripterygium wilfordii[J]. Am Chem Soc,1972, 94 (20) : 7194-5. DOI: 10.1021/ja00775a078. |
| [4] | Chen BJ. Triptolide, a novel immunosuppressive and antiinflammatory agent purified from a Chinese herb Tripterygium Wilfordii Hook F[J]. Leuk Lymphoma,2001, 42 (3) : 253-65. DOI: 10.3109/10428190109064582. |
| [5] | Qiu D, Kao PN. Immunosuppressive and anti-inflammatory mechanisms of triptolide, the principal activediterpenoid from the Chinese medicinal herb Tripterygium wilfordii Hook.f[J]. Drugs R D,2003, 4 (1) : 1-18. DOI: 10.2165/00126839-200304010-00001. |
| [6] | Yang SM, Chen JG, Guo Z, et al. Triptolide inhibits the growth and metastasis of solid tumors[J]. Mol Cancer Ther,2003, 2 (1) : 65-72. |
| [7] | Carter BZ, Mak DH, Schober WD, et al. Triptolide sensitizes AML cells to TRAIL-induced apoptosis via decrease of XIAP and p53-mediated increase of Dr5[J]. Blood,2008, 111 (7) : 3742-50. DOI: 10.1182/blood-2007-05-091504. |
| [8] | Wan CK, Wang C, Cheung HY, et al. Triptolide induces Bcl-2 cleavage and mitochondria dependent apoptosis in p53-deficient HL-60 cells[J]. Cancer Lett,2006, 241 (1) : 31-41. DOI: 10.1016/j.canlet.2005.10.001. |
| [9] | Zhao G, Vaszar LT, Qiu D, et al. Anti-inflammatory effects of triptolide in human bronchial epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol,2000, 279 (5) : 958-66. |
| [10] | Titov DV, Gilman B, He QL, et al. XPB, a subunit of TFⅡH, is a target of the natural product triptolide[J]. Nat Chem Biol,2011, 7 (3) : 182-8. DOI: 10.1038/nchembio.522. |
| [11] | Menéndez-Arias L. Molecular basis of fidelity of DNA synthesis and nucleotide specificity of retroviral reverse transcriptases[J]. Prog Nucleic Acid Res Mol Biol,2002, 71 : 91-147. DOI: 10.1016/S0079-6603(02)71042-8. |
| [12] | Denne M, Sauter M, Armbruester V, et al. Physical and functional interactions of human endogenous retrovirus proteins Np9 and rec with the promyelocytic leukemia Zinc finger protein[J]. J Virol,2007, 81 (11) : 5607-16. DOI: 10.1128/JVI.02771-06. |
| [13] | Carter BZ, Mak DH, Schober WD, et al. Triptolide induces caspasedependent cell death mediated via the mitochondrial pathway in leukemic cells[J]. Blood,2006, 108 (2) : 630-7. DOI: 10.1182/blood-2005-09-3898. |
| [14] | Vispé S, Devries L, Créancier L, et al. Triptolide is an inhibitor of RNA polymerase I and Ⅱ-dependent transcription leading predominantly to down-regulation of short-lived mRNA[J]. Mol Cancer Ther,2009, 8 (10) : 2780-90. DOI: 10.1158/1535-7163.MCT-09-0549. |
| [15] | Shao H, Ma J, Guo T. Triptolide induces apoptosis of breast cancer cells via a mechanismassociated with the Wnt/β-catenin signaling pathway[J]. Exp Ther Med,2014, 8 (2) : 505-8. |
| [16] | Kim MJ, Lee TH, Kim SH, et al. Triptolide inactivates Akt and induces caspase-dependent death in cervical cancer cells via the mitochondrial pathway[J]. Int J Oncol,2010, 37 (5) : 1177-85. |
| [17] | Shi XP, Jin YL, Cheng C, et al. Triptolide inhibits Bcr-Abl transcription and induces apoptosis in STI571-resistant chronic myelogenous leukemia cells harboring T315I mutation[J]. Clin Cancer Res,2009, 15 (5) : 1686-97. DOI: 10.1158/1078-0432.CCR-08-2141. |
| [18] | Gutierrez A, Grebliunaite R, Feng H, et al. Pten mediates Myc oncogene dependnce in a conditional zebrafish model of T a cell acute lymphoblastic leukemia[J]. J Exp Med,2011, 208 (8) : 1595-603. DOI: 10.1084/jem.20101691. |
| [19] | Yeung J, Esposito MT, Gandillet AA, et al. beta-Catenin mediates the establishment and drug resistance of MLL leukemic stem cells[J]. Cancer Cell,2010, 18 (6) : 606-18. DOI: 10.1016/j.ccr.2010.10.032. |
| [20] | Steelman LS, Franklin RA, Abrams SL, et al. Roles of the Ras/Raf/ MEK/ERK pathway in leukemia therapy[J]. Leukemia,2011, 25 (7) : 1080-94. DOI: 10.1038/leu.2011.66. |
| [21] | Polak R, Buitenhuis M. The PI3K/PKB signaling module as key regulator of hematopoiesis: implications for therapeutic strategies in leukemia[J]. Blood,2012, 119 (4) : 911-23. DOI: 10.1182/blood-2011-07-366203. |
| [22] | Sykes SM, Lane SW, Bullinger L, et al. AKT/FOXO signaling enforces reversible differentiation blockade in myeloid leukemias[J]. Cell,2011, 146 (5) : 697-708. DOI: 10.1016/j.cell.2011.07.032. |
| [23] | Tatarek J, Cullion K, Ashworth T, et al. Notch1 inhibition targets the leukemia-initiating cells in a Tal1/Lmo2 mouse model of T-ALL[J]. Blood,2011, 118 (6) : 1579-90. DOI: 10.1182/blood-2010-08-300343. |
 2015, Vol. 35
2015, Vol. 35
