Notch信号通路为邻近细胞之间信息交流平台,激活后经二次裂解,释放Notch胞内结构域(Notch intracellular domain, NICD)进入细胞核,启动靶基因转录,发挥生物学效应[1]。研究发现Notch不仅调节胚胎期心脏的发育和分化[2],而且刺激未成熟心肌细胞的增殖[3],促进静止期心肌细胞重新进入细胞周期,有利于损伤心肌的再生修复[4]。最新研究发现Notch1信号通路的激活可加快心肌梗死后期心功能的恢复[5]。因此本研究将包装高滴度Notch1胞内结构域(Notch1 intracellular domain, N1ICD)慢病毒过表达载体(N1ICD lentiviral vector, LV-N1ICD)及N1ICD慢病毒干扰载体(N1ICD-shRNA lentiviral vector, LVN1ICD-shRNA),并研究其在H9c2心肌细胞中的生物学功能,为探讨Notch1信号通路在心肌保护作用奠定研究基础。
1 材料与方法 1.1 材料 1.1.1 细胞及菌株293T细胞、H9c2心肌样细胞购于中科院上海生命科学院细胞库,DH5α化学感受态细胞购于Invitrogen。
1.1.2 大鼠cDNA文库及慢病毒载体系统大鼠cDNA文库来购于TAKARA;pGC-FU-EGFP-3Flag Vector、GV112 Vector、pHelper 1.0 plasmid、pHelper 2.0 plasmid购于上海吉凯基因化学技术有限公司。
1.1.3 主要试剂Taq DNA polymerase购于北京全式金生物技术有限公司,限制性核酸内切酶(AgeⅠ、NheⅠ、EcoRⅠ)购于New England Biolabs;T4 DNA Ligase购于TaKaRa,凝胶回收试剂盒及质粒小提试剂盒购于OMEGA,In-Fusion PCR Cloning Kit购于Clontech laboratories;LipofectamineTM 2000购于Invitrogen,细胞裂解液购于碧云天生物技术研究所,小鼠抗Flag单克隆抗体购于anbo,小鼠抗β-Actin单克隆抗体购于Cell signaling technology;辣根过氧化物酶标记山羊小鼠IgG均购于北京中杉金桥公司,化学发光试剂盒(SuperSignal West Pico Chemiluminescent Substrate)购自美国Pierce,CCK-8试剂盒购于Solarbio。
1.1.4 引物设计与合成根据GeneBank中的大鼠Notch1基因编码序列(NCBI Reference Sequence: NM_001105721),Primer Premier 5.0设计N1ICD克隆引物并插入AgeⅠ与NheⅠ酶切位点(Forward Primer: 5'-GAGGATCCCCGGGTACCGGTCGCCACCATGG TGCTGCTGTCCCGCAAGC-3',Reverse Primer:5'-T CATCCTTGTAGTCGCTAGCCTTAAATGCCTCTGGAATG-3'),产物大小为2364 bp;设计N1ICD鉴定引物(Forward Primer: 5'-GTGCAGACCCAGCAGGT G-3', Reverse Primer: 5'-AGCGTA AAAGGAGCAAC ATAG-3'),产物大小为665 bp;设计LV-N1ICD Realtime PCR引物(Forward Primer: 5'-AATTCCGTGG TGTTGTCG-3',Reverse Primer: 5'-AAGGTCCGCTG GATTGAG-3'),产物大小为123 bp;设计GV112通用引物(Forward Primer: 5'-CCTATTTCCCATGATTCC TTCATA-3', Reverse Primer: 5'-GT AATACGGTTATC CACGCG-3'),产物大小542 bp;一起交Invitrogen公司合成,规格为2OD。
1.1.5 干扰片段设计与合成针对大鼠Notch1基因,设计4对N1ICD-shRNA寡核苷酸序列(N1ICDshRNA-1: GCACAGTGCTGAGTACCAA;N1ICDshRNA-2: GCCTCTCC ACCAATACCTT;N1ICDshRNA-3: CCCACATTCCAGAGGCATT;N1ICDshRNA-4: TCTGGATGCCCGAATGCAT),分别插入AgeⅠ与EcoRⅠ酶切位点,交Invitrogen公司合成,规格为2OD。
1.2 方法 1.2.1 pGC-FU-N1ICD-3Flag重组质粒构建及鉴定以大鼠cDNA文库为模板,PCR法获得N1ICD,经In-Fusion PCR Cloning Kit交换入pGC-FU-EGFP-3Flag Vector,转化DH5α感受态细胞,接种于氨苄青霉素(Amp+,100 μg/ml)的LB培养基平板,次日随机挑选阳性单克隆菌落,菌落PCR鉴定转化子,送基因测序,无突变的克隆命名为pGC-FU-N1ICD-3Flag重组质粒。利用LipofectamineTM 2000分2组(Control组:转染pGC-FU-EGFP-3Flag Vector、Overexpression组:转染pGC-FU-N1ICD-3Flag重组载体)转染293T细胞,48 h后提总蛋白,Western-blotting检测Flag及β-Actin表达。
1.2.2 GVC112-N1ICD-shRNA干扰质粒构建及筛选将4对Oligonucleotide退火形成双链,T4 DNA Ligase连接AgeⅠ与EcoRⅠ双切酶后的双链Oligonucleotide、GVC112。将4组连接产物转化DH5α化学感受态细胞,接种于Amp+的LB培养基平板,次日随机挑选阳性单克隆菌落,使用GV112通用引物PCR鉴定阳性转化子,行基因测序,序列无误后分别命名为GVC112-N1ICD-shRNA-1、GVC112-N1ICD-shRNA-2、GVC112-N1ICD-shRNA-3、GVC112-N1ICD-shRNA-4。按LipofectamineTM 2000方法,分5组进行转染293T细胞,其中Control组为pGC-FU-N1ICD-3Flag+无义干扰质粒、N1ICD-shRNA-1组为pGC-FUN1ICD-3Flag + GVC112-N1ICD-shRNA-1、N1ICDshRNA-2组为pGC-FU-N1ICD-3Flag + GVC112-N1ICD-shRNA-2、N1ICD-shRNA-3组为pGC-FUN1ICD-3Flag + GVC112-N1ICD-shRNA-3、N1ICDshRNA-4组为pGC-FU-N1ICD-3Flag + GVC112-N1ICD-shRNA-4,48 h后提总蛋白,Western-blotting检测Flag及β-Actin表达。
1.2.3 N1ICD及N1ICD-shRNA慢病毒包装与浓缩将pGC-FU-N1ICD-3Flag/GVC112-N1ICD-shRNA 20 μg、pHelper 1.0 15 μg、pHelper 2.0 10 μg共转293T细胞,48 h后,收集上清液,浓缩纯化,获得LV-N1ICD及LV-N1ICD-shRNA慢病毒载体,分别采用Real-time PCR及药物筛选法测定LV-N1ICD及LV-N1ICDshRNA滴度。
1.2.4 H9c2心肌细胞慢病毒感染H9c2心肌细胞铺板,感染增强液(ENi.S)稀释病毒至20感染复数(MOI),去除半量DEME+10%FBS,加入稀释病毒,再加入5 μl/ml Ploybrene,混匀,孵育24 h后,更换DMEM+10% FBS,继续培养72 h。
1.2.5 细胞增殖检测H9c2心肌细胞铺96孔板,每孔加入10 μl CCK-8溶液,CO2培养箱内继续孵育1.5 h,酶标仪测定450 nm吸光度。
2 结果 2.1 pGC-FU-N1ICD-3Flag重组质粒成功构建N1ICD经PCR扩增后,1%琼脂糖凝胶电泳可见一条约2364 bp的特异条带(图 1A),与预计结果相符。将N1ICD插入pGC-FU-EGFP-3Flag Vector获得pGCFU-N1ICD-3Flag转化子,菌落PCR鉴定,1%琼脂糖凝胶电泳可见一条约665 bp的特异条带(图 1B),与预计结果相符。DNAMAN(Version 6.0.3.99)比对分析基因测序结果,与NlICD基因编码序列完全一致(图 1C)。将pGC-FU-N1ICD-3Flag质粒转染293T细胞,48 h后提总蛋白,Western-blotting显示Flag在Overexpression组表达,位置在89 000左右,提示pGC-FU-N1ICD-3Flag重组质粒构建成功,功能正常(图 1D)。

|
图 1 pGC-FU-N1ICD-3Flag重组质粒构建及鉴定 Figure 1 Construction and identification of recombinant plasmid of pGC-FU-N1ICD-3Flag: A: N1ICD gel electrophoresis imaging; B: pGC-FU-N1ICD-3Flag transformant colony PCR identification; C: The pGC-FU-N1ICD-3Flag recombinant plasmid of gene sequencing; D: The normal expression of pGC-FU-N1ICD-3Flag recombinant plasmid. |
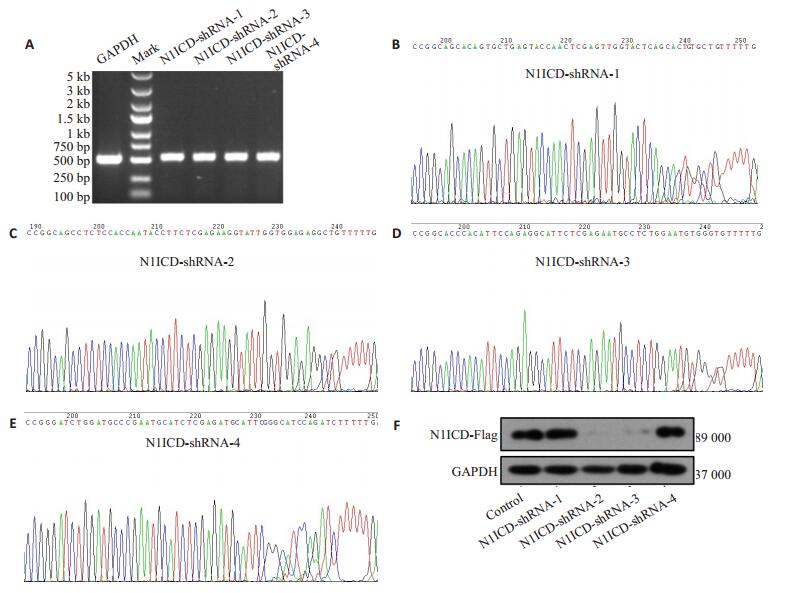
GVC112-N1ICD-shRNA阳性转化子菌落PCR鉴定,1%琼脂糖凝胶电泳可见一条约586 bp的特异条带,与预计结果相符(图 2A)。DNAMAN比对分析基因测序结果,与N1ICD-shRNA基因序列完全一致(图 2B~E)。将GVC112-N1ICD-shRNA干扰质粒与pGCFU-N1ICD-3Flag重组质粒共转293T细胞,48 h后提总蛋白,Western-blotting显示Flag在第4、5组表达最低,约为Mock组的90%,提示GVC112-N1ICD-shRNA-2、GVC112-N1ICD-shRNA-3可有效干扰N1ICD(图 2F)。本课题选取GVC112-N1ICD-shRNA-3作为后续实验研究。
|
图 2 GVC112-N1ICD-shRNA干扰质粒构建 Figure 2 Construction of GVC112-N1ICD-shRNA interference plasmids: A: GVC112-N1ICD-shRNA transformant colony PCR identification; B-E: GVC112-N1ICD-shRNA interference plasmid DNA sequencing; F: Screening of GVC112-N1ICD-shRNA interference plasmid. |
利用Real-time PCR测定LV-N1ICD滴度,分析不同浓度病毒感染后样品组的Ct值及表达量(表 1),10-4 μl组和Con组样品间Ct值存在2个左右差异,认为在10-4 μl组样品中存在病毒颗粒。假定该组样品含有至少1个病毒颗粒,则LV-N1ICD滴度为:1/(1.00E-04)×20=2.00E+5TU/μl=2.00E+8TU/ml。
| 表 1 不同浓度病毒感染后样品组的Ct值及表达量分析 Table 1 Ct value and expression analysis of different concentrations of virus infection |
因LV-N1ICD-shRNA带有Puromycin抗性,所以采用药筛法测定滴度,即通过感染后活细胞数量来判断滴度数值,其值等于带有活细胞数除以病毒原液量。在本实验中,加入1E-5 μl病毒原液的孔中观察到5个细胞存活,说明该孔中至少有5个病毒颗粒感染了细胞,则LV-N1ICD-shRNA滴度为:5(/ 1E-5)=5E+5TU/μl=5E+ 8TU/ml。
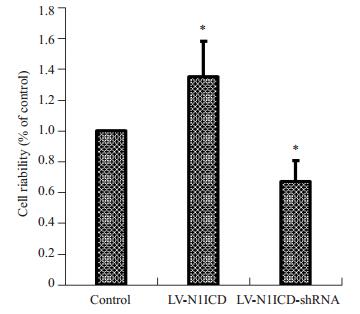
2.4 Notch1对心肌细胞增殖功能的影响LV-N1ICD及LV-N1ICD-shRNA分别感染H9c2心肌细胞,利用CCK-8检测细胞活力。结果显示(图 3):LV-N1ICD可明显提高心肌细胞活力(P < 0.05),LV-N1ICD-shRNA可降低心肌细胞活力(P < 0.05),可见Notch1可改善心肌细胞增殖能力。
|
图 3 Notch1对心肌细胞活力的影响 Figure 3 Effect of Notch1 on myocardial cell viability. P < 0.05 vs LV-N1ICD; *P < 0.05 vs LV-N1ICDshRNA (n=3). |
Notch信号通路无特异性激动剂,因此特异性激活Notch信号通路并非易事。利用Notch激动型抗体,虽然可以激活Notch信号通路,但特异性不佳[6]。Gude等[7]用50 ng/ml的HGF刺激大鼠心肌细胞,在HGF/c-Met/ Notch信号转导下间接激活Notch1,在5 min内可使Notch1及Hes1表达增加,效应可维持到6 h,但HGF仍不能直接激活Notch1。Notch信号通路抑制剂包括γ-secretase抑制剂、Notch受体及配体单克隆抑制型抗体,中药成分姜黄素等[8]。作为γ-secretase抑制剂,DAPT可以抑制Notch蛋白向NICD分裂的关键过程,能够非特异性阻断Notch信号通路的所有亚型,同样不适合Notch1信号通路的特异性研究[9]。因此利用基因异位表达和RNAi技术,针对特定Notch1蛋白构建相应表达载体,可达到特异性激活或抑制Notch1信号通路的作用。
Notch蛋白由胞外结构域和胞内结构域组成,胞外结构域由36个表皮生长因子样重复序列和3个半胱氨酸富集的LIN12/Notch重复序列组成,表皮生长因子样重复序列负责与Notch配体结合,LIN12/Notch预防Notch信号自身激活[10]。NICD含1个RAM23结构域、6个锚蛋白/cdc10重复序列、2个核定位序列、1个转录激活结构域、1个C末端富集脯氨酸、谷氨酸、丝氨酸、苏氨酸的PEST序列。Notch蛋白编码序列长达近7.6kb,全长难以完整克隆。由于Notch信号通路主要通过NICD发挥功能,因此对NICD的功能区进行选择性克隆,是近年Notch信号通路研究的主要手段之一[11]。但NICD在Notch蛋白编码序列上的功能定位各家报道不一,Tezuka K等利用RT-PCR技术获得小鼠cDNA文库,在Notch1 5428-6549位点定向克隆N1ICD,经验证具有Notch1蛋白的生物学功能[12]。由于国内外尚无大鼠N1ICD载体构建报道,因此我们选择Notch第二分裂位点(Gly1743和Val1744 [13])作为N1ICD基因克隆位点,经验证该片段具有Notch1蛋白的生物学效应。
目前,用于目的基因转移的的病毒载体主要包括腺病毒、腺相关病毒、逆转录病毒和慢病毒载体[14]。慢病毒载体是逆转录病毒的一个亚型,目前应用较多的来源于HIV-1的病毒载体,载体容量大,可感染非分裂期细胞,能在机体内持续表达。由于N1ICD片段较大,涉及细胞及动物实验,对病毒感染效率要求高,后续有可能需要构建N1ICD稳定表达细胞株,因此我们采用慢病毒载体系统构建N1ICD过表达及干扰载体。研究发现Notch1信号通路可刺激缺血心肌细胞增生,产生良好的心肌保护效应[7]。国内文献报道应用Notch信号通路阻断剂DAPT能抑制原代乳鼠心肌细胞增殖,促使心肌细胞发生凋亡[15],我们分别用LV-N1ICD及LV-N1ICDshRNA感染H9c2心肌细胞,发现Notch信号可提高心肌细胞活力,可见LV-N1ICD及LV-N1ICD-shRNA构建成功,并具有Notch信号的生物学功能,为将来Notch1信号通路在心肌保护中的功能与机制研究奠定了实验基础。
| [1] | Guruharsha KG, Kankel MW, Artavanis-Tsakonas S. The notch signalling system: recent insights into the complexity of a conserved pathway[J]. Nat Rev Genet,2012, 13 (9) : 654-66. DOI: 10.1038/nrg3272. |
| [2] | Macgrogan D, Luna-Zurita L, de la Pompa JL. Notch signaling in cardiac valve development and disease[J]. Curr Top Dev Biol,2011, 91 (6) : 449-59. |
| [3] | Collesi C, Zentilin L, Sinagra G, et al. Notch1 signaling stimulates proliferation of immature cardiomyocytes[J]. J Cell Biol,2008, 183 (1) : 117-28. DOI: 10.1083/jcb.200806091. |
| [4] | Campa VM, Gutiérrez-Lanza R, Cerignoli F, et al. Notch activates cell cycle reentry and progression in quiescent cardiomyocytes[J]. J Cell Biol,2008, 183 (1) : 129-41. DOI: 10.1083/jcb.200806104. |
| [5] | Li Y, Hiroi Y, Ngoy S, et al. Notch1 in bone marrow-derived cells mediates cardiac repair after myocardial infarction[J]. Circulation,2011, 123 (8) : 866-76. DOI: 10.1161/CIRCULATIONAHA.110.947531. |
| [6] | Fassbender JM, Myers SA, Whittemore SR. Activating notch signaling post-SCI modulates angiogenesis in penumbral vascular beds but does not improve hindlimb locomotor recovery[J]. Exp Neurol,2011, 227 (2) : 302-13. DOI: 10.1016/j.expneurol.2010.12.002. |
| [7] | Gude NA, Emmanuel G, Wu W, et al. Activation of notch-mediated protective signaling in the myocardium[J]. Circ Res,2008, 102 (9) : 1025-35. DOI: 10.1161/CIRCRESAHA.107.164749. |
| [8] | Bailis W, Yashiro-Ohtani Y, Pear WS. Identifying direct Notch transcriptional targets using the GSI-washout assay[J]. Methods Mol Biol,2014, 1187 (3) : 247-54. |
| [9] | Xie K, Qiao F, Sun Y, et al. Notch signaling activation is critical to the development of neuropathic pain[J]. BMC Anesthesiol,2015, 15 (3) : 41. |
| [10] | Wang MM. Notch signaling and Notch signaling modifiers[J]. Int J Biochem Cell Biol,2011, 43 (11) : 1550-62. DOI: 10.1016/j.biocel.2011.08.005. |
| [11] | Zhang J, Yin JC, Wesley CS. Notch intracellular domain (NICD) suppresses Long-Term memory formation in adult drosophila flies[J]. Cell Mol Neurobiol,2015 (2) : 145. |
| [12] | Tezuka K, Yasuda M, Watanabe N, et al. Stimulation of osteoblastic cell differentiation by Notch[J]. J Bone Miner Res,2002, 17 (2) : 231-9. DOI: 10.1359/jbmr.2002.17.2.231. |
| [13] | Rand MD, Grimm LM, Artavanis-Tsakonas S, et al. Calcium depletion dissociates and activates heterodimeric notch receptors[J]. Mol Cell Biol,2000, 20 (5) : 1825-35. DOI: 10.1128/MCB.20.5.1825-1835.2000. |
| [14] | Liu YP, Berkhout B. miRNA cassettes in viral vectors: problems and solutions[J]. Biochim Biophys Acta,2011, 1809 (11/12) : 732-45. |
| [15] | 杨阳, 段维勋, 周京军, 等. γ-分泌酶抑制剂对正常乳鼠心肌细胞的影响[J]. 中国体外循环杂志,2011, 9 (2) : 89-92. |
 2015, Vol. 35
2015, Vol. 35
