2. 药学系,蚌埠医学院安徽 蚌埠 233030
2. Faculty of Pharmacy, Bengbu Medical College, Bengbu 233030, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是东南亚地区及我国南方发病率较高的恶性肿瘤之一[1-2],发病率为头颈部肿瘤中的首位。鼻咽癌的发病原因较复杂,可能是由于家族遗传的因素、生活环境的因素和一些病毒的慢性感染等共同作用所致[1, 3-4]。单纯放疗能够在早期对鼻咽癌有良好的控制,但大多数患者在就诊时已是晚期,病灶侵犯广泛[5]。目前,临床上通过放疗联合化疗来治疗晚期鼻咽癌,但是患者的预后较差,放、化联合治疗后5年存活率只占到50%左右。鼻咽癌细胞对放疗敏感性的降低以及对化疗药物耐药性的提高是导致5年存活率较低的主要因素[6]。因此,寻找和发现新的治疗靶点和新的有效药物、克服肿瘤耐药性,提高治疗效果成为该领域当前研究热点之一。
氯喹,常用于治疗疟疾、自身免疫性疾病和炎症性疾病[7]。近年来,国内外的研究发现,氯喹除了上述作用外,还具有良好的体内、体外抗肿瘤作用[8]。课题组前期的研究也证实了氯喹能够抑制鼻咽癌CNE-2Z细胞的增殖并促进其凋亡[9]。那么,氯喹对耐药人鼻咽癌细胞是否有逆转耐药作用,对其抑制增殖、促进凋亡的影响是怎样的呢?本文通过观察氯喹逆转人鼻咽癌HNE1/ DDP细胞耐药的作用,探讨其抗肿瘤作用及克服肿瘤耐药性的初步机制,以期为鼻咽癌的临床治疗提供新的靶点,提高治疗效果。
1 材料和方法 1.1 材料 1.1.1 细胞株人鼻咽癌HNE1和HNE1/DDP细胞均购于中南大学湘雅医学院,蚌埠医学院生化药理研究室培养冻存。
1.1.2 主要仪器与试剂酶标仪(Synergy HT公司);流式细胞仪(美国BECTON DICKNSON公司);RPMI 1640培养基和胰蛋白酶(Gibco公司);胎牛血清(杭州四季青公司);二甲基亚枫(DMSO)(Sigma公司);兔抗人P-gp抗体,鼠抗人β-actin:Santa Cruz公司。
1.2 方法 1.2.1 细胞培养HNE1和HNE1/DDP细胞培养于含5%胎牛血清、青霉素(80 U/ml)、链霉素(100 U/ml)的RPMI 1640培养液中,5% CO2、饱和湿度、37 ℃培养箱中培养,每2~3 d传代1次。
1.2.2 MTT法检测不同浓度顺铂(cisplatin, DDP)处理HNE1和HNE1/DDP细胞存活率将人鼻咽癌HNE1和HNE1/DDP细胞接种于96孔板细胞培养板中,每孔5~7×103细胞。于5% CO2饱和湿度37 ℃培养箱中培养24 h后,用不同浓度的顺铂(2、4、8、16、32 μmol/L)处理,同时设阴性对照组和空自对照组,并在培养48 h后加入20 μl MTT(以PBS配成5 mg/ml),37 ℃继续培养4 h,弃上清,每孔加入150 μl DMSO,37 ℃孵育30 min,酶标仪上振荡10 min使结晶充分溶解后以酶标仪检测波长490 nm处吸光度(A)值,计算细胞存活率%:细胞存活率(%)=实验组D490 nm/对照组D490 nm× 100%。以上实验重复3次。
1.2.3 MTT法检测不同浓度氯喹对鼻咽癌细胞的增殖抑制作用将人鼻咽癌HNE1和HNE1/DDP细胞接种于96孔板细胞培养板中,每孔5~7×103细胞。于5% CO2饱和湿度37 ℃培养箱中培养,24 h后,用不同浓度的氯喹(5, 10, 20, 40, 80 μmol/L)处理,同时设阴性对照组和空自对照组,并在培养48 h后加入20 μl MTT(以PBS配成5 mg/ml),37 ℃继续培养4 h,弃上清,每孔加入150 μl DMSO,37 ℃孵育30 min,酶标仪上振荡10 min使结晶充分溶解后以酶标仪检测波长490 nm处吸光度(A)值,计算细胞存活率%:细胞存活率(%)=实验组D490 nm/对照组D490 nm×100%。以上实验重复3次。
1.2.4 氯喹对鼻咽癌细胞HNE1/DDP的逆转耐药作用HNE1/DDP细胞接种于96孔板细胞培养板中,每孔5~7×103细胞。于5% CO2饱和湿度37 ℃培养箱中培养48 h后,实验分为单用DDP 2 μmol/L组,以及DDP 2 μmol/L分别与氯喹(5, 10, 20, 40, μmol/L)合用组,同时设阴性对照组和空自对照组,并在培养48 h后加入20 μl MTT(以PBS配成5 mg/ml),37 ℃继续培养4 h,弃上清,每孔加入150 μl DMSO,37 ℃孵育30 min,其余步骤按“1.2.1”行MTT检测,逆转耐药倍数=使用逆转剂后IR/使用逆转剂前IR。
1.2.5 q-PCR方法检测氯喹对鼻咽癌细胞HNE1/DDP MDR1 mRNA的影响实验分为HNE1,HNE1/DDP,氯喹(5 μmol/L),氯喹(10 μmol/L)。给药后24 h收集细胞,TRzol试剂提取细胞总RNA。逆转录合成cDNA,构建20 μl逆转录体系,含有总RNA 1 μg,PCR扩增仪上运行:42 ℃ 60 min,70 ℃ 5 min。人MDR1基因引物由上海生工生物工程有限公司合成。其中MDR1上游引物:5'-AAAGTCGGAGTATCTTCTTCCAA-3';下游引物:5'CCAATTTGAATAGCGAAACATTGA-3';扩增长度:201 b;内参引物为GAPDH,其上游引物:5'-GTGAAGGTCGGTGTCAACGGATTT-3',下游引物:5'CACAGTCTTCTGAGTGGCAGTGAT-3',增长度:558 b。产物进行PCR扩增,构建20 μl PCR体系,上下游引物及内参引物均加入1 μl。预变性Step1:95 ℃ 30 s。反应阶段Step1:95 ℃ 15 s。Step2:60 ℃ 30 s。Step3:72 ℃ 30 s,30个循环。根据不同浓度的模板的扩增Ct值,计算3个重复孔的平均值,采用2-ΔΔCt方法计算比较两组基因表达差异;以上每个样品需做3个重复孔,实验重复3次。
1.2.6 溴化吡啶(propiodide, PI)染色检测细胞凋亡将对数生长期的细胞制成单细胞悬液接种于12孔细胞培养板,每孔1×105细胞,培养24 h后,用不同浓度的氯喹(10、20 μmol/L)处理,继续培养24 h收集细胞至10 ml离心管,2500 r/min,离心5 min,去上清,加入体积分数为75%的乙醇4 ℃固定过夜。将细胞转移至5 ml离心管1500 r/min离心5~10 min,去上清,用PBS洗涤离心2500 r/min,5 min,去上清,每管加入600 ml PI缓冲液,避光孵育3~4 h,流式细胞仪检测具有亚Gl期DNA含量的细胞比例,以统计细胞凋亡率。以上实验重复3次。
1.2.7 Western blot检测P-gp蛋白表达将HNE1,HNE1/DDP制成单细胞悬液接种于6孔细胞培养板,5× 105/孔,培养24 h后使用5,10 μmol·L-1氯喹处理细胞,48 h后收集蛋白。采用BCA蛋白定量试剂盒测定所提蛋白浓度。SDS-PAGE电泳,转膜;5%脱脂牛奶封闭室温封闭2 h(或4 ℃过夜),一抗室温孵育2 h,洗膜后加二抗,室温孵育2 h;ECL发光试剂盒显影;Bin-Rad凝胶成像系统获取图像。
1.2.7 统计学方法所有数据以均数±标准差表示,采用SPSS 13.0统计软件进行方差分析及Dunnette-t检验,以P < 0.05为有统计学意义。
2 结果 2.1 HNE1和HNE1/DDP细胞的多药耐药性实验使用不同浓度的DDP(2, 4, 8, 16, 32 μmol·L-1)处理HNE1细胞和HNE1/DDP细胞,48 h后MTT法检测细胞存活率。结果显示,耐药株细胞HNE1/DDP对接受DDP处理后细胞存活率较HNE1高(图 1)。通过计算得出HNE1细胞的IC50值为4.62±0.41,HNE1/DDP的值为20.64±0.37,HNE1/DDP细胞的耐药倍数为4.46,说明细胞具有耐药性。
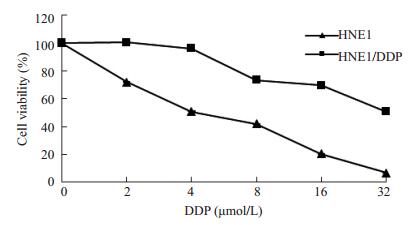
|
图 1 DDP对鼻咽癌细胞HNE1和HNE1/DDP增殖抑制作用 Figure 1 Cellular sensitivity to chemotherapeutics detected by MTT assay. |
使用不同浓度的氯喹(5, 10, 20, 40, 80 μmol·L-1)处理HNE1和HNE1/DDP细胞,48 h后MTT法检测细胞存活率来观察氯喹对HNE1和HNE1/DDP的增殖抑制作用。结果表明,不同浓度的氯喹(5, 10, 20, 40, 80 μmol·L-1)呈浓度依赖性地抑制HNE1和HNE1/DDP细胞的体外增殖活性(图 2)。
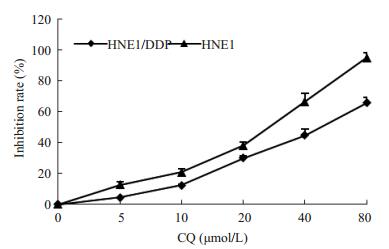
|
图 2 氯喹对鼻咽癌细胞HNE1和HNE1/DDP的增殖抑制作用 Figure 2 MTT assay of HNE1 and HNE1/DDP cells after DDP treatment for 48 h |
根据氯喹对鼻咽癌的抑制作用,选择不同浓度的氯喹(0, 5, 10, 20, 40 μmol·L-1)联合2 μmol·L-1的DDP处理HNE1/DDP细胞,结果如表所示,5,10,20,40 μmol·L-1对HNE1/DDP的细胞耐药性有明显的逆转作用,并且逆转作用呈浓度相关性(表 1)。
| 表 1 氯喹对HNE1/DDP细胞的逆转耐药作用 Table 1 Effect of chloroquine in reversing multidrug resistance in HNE1/DDP cell line |
MDR1在肿瘤细胞耐药中具有重要作用,为观察氯喹逆转鼻咽癌耐药的作用机制,实验采用q-PCR方法检测了5,10 μmol · L-1氯喹处理HNE1/DDP后的MDR1 mRNA的表达,结果显示,5,10 μmol·L-1作用细胞后能明显降低MDR1 mRNA水平(图 3),差异有统计学意义(P < 0.05)。
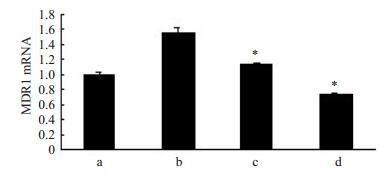
|
图 3 氯喹对HNE1/DDP细胞MDR1 mRNA水平的影响 Figure 3 Effect of chloroquine on relative expression levels of MDR1 mRNA. (a) HNE1; (b) HNE1/DDP; (c) HNE1/DDP with CQ (10 μmol/L); (d) HNE1/DDP with CQ (20 μmol/L). *P < 0.05 vs HNE1/DDP. |
为进一步检查氯喹诱导鼻咽癌细胞凋亡的作用,实验采用PI单染方法检测了10,20 μmol·L-1氯喹处理HNE1/DDP后的细胞凋亡率,结果表明,10, 20 μmol·L-1氯喹作用细胞后,细胞的凋亡率明显增加(图 4)。
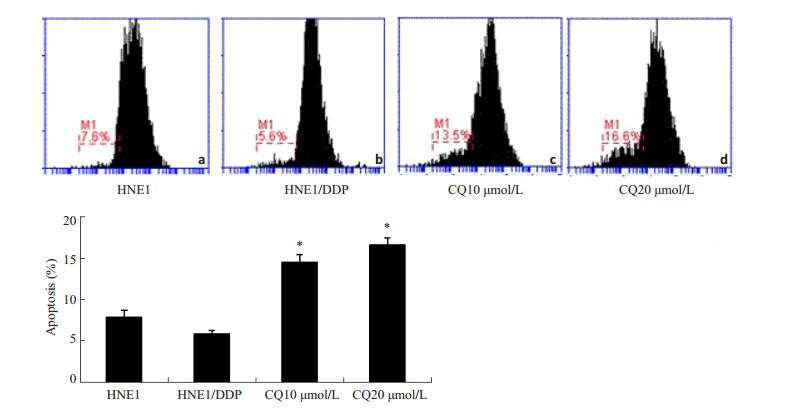
|
图 4 氯喹诱导鼻咽癌耐药细胞株凋亡的作用 Figure 4 Apoptotic rate of HNE1 cells, HNE1/DDP cells, and HNE1/DDP cells treated with chloroquine. (a) HNE1; (b) HNE1/DDP; (c) HNE1/ DDP with CQ (10 μmol/L); (d) HNE1/DDP with CQ (20 μmol/L). *P < 0.05 vs HNE1/DDP. |
P-gp蛋白参与了肿瘤细胞的耐药,实验中采用western blot方法检测P-gp蛋白的表达,分别使用5,10 μmol·L-1氯喹处理HNE1/DDP后进行Western blot检测,结果显示,5,10 μmol·L-1作用细胞后MDR1和P-gp蛋白水平明显降低(图 5)。
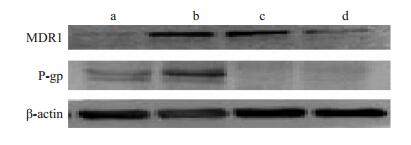
|
图 5 鼻咽癌细胞中MDR1和P-gp蛋白的表达 Figure 5 Expression of MDR1 and P-gp in HNE1 and HNE1/ DDP cells detected by Western blotting. (a) HNE1; (b) HNE1/DDP; (c) HNE1/DDP with CQ (10 μmol/L); (d) HNE1/DDP with CQ (20 μmol/L). |
本研究探讨了常用抗疟疾药物氯喹逆转鼻咽癌细胞耐药的作用,并对其机制进行了初步探讨,发现氯喹通过影响肿瘤细胞耐药相关的蛋白而发挥了逆转鼻咽癌耐药的作用。
氯喹是治疗和预防疟疾的首选药物,后来研究中发现氯喹具有新的药理作用如免疫调节和抗炎等。近年来又发现,氯喹在肿瘤治疗中具有良好的作用[10]。氯喹对消化、生殖以及神经系统等许多肿瘤细胞有抑制生长、抑制增殖和促进凋亡的作用,联合其它化疗药物还有化疗增敏作用[10-14]。本研究的体外实验结果显示氯喹对鼻咽癌HNE1和HNE1/DDP细胞具有增殖抑制作用,且随着药物浓度的增加对细胞增殖的抑制作用增加。流式细胞仪凋亡分析结果发现氯喹能促进HNE1/ DDP细胞凋亡。氯喹对HNE1/DDP细胞耐药性有明显的逆转作用,并且逆转作用呈浓度相关性。
肿瘤的药物治疗过程中常常出现病人对抗肿瘤药物的多药耐药(multidrug resistance, MDR),其是指肿瘤细胞对一种抗肿瘤药物耐药,对非同类型的结构和功能机制不同的药物也产生耐药,这是导致化学治疗失败的主要原因。MDR产生的机制相当复杂,一般认为MDR是多种机制共同作用的结果[11, 15]。产生耐药的其中一种机制是通过增加药物的外排使得进入细胞的药物变少而导致药效降低,这种作用是通过ATP依赖的外排泵也就是ATP结合盒家族(ABC)实现的[16]。每一个ABC转录因子包含1~2个ATP结合域,根据同源性和结合域的组成将其分为7个亚区(ABCA-G)。ABC家族的蛋白通常在正常的组织中也能够表达,并且发挥药物外排作用以保护脑组织或者睾丸组织不受药物的伤害。有研究表明,在耐药的肿瘤细胞和组织中,P-gp、MRP-1、BCRP这几种蛋白会发生变化。其中,P-gp在包括乳腺癌、肺癌、胃癌的许多肿瘤细胞中已经被广泛研究[17-18]。P-糖蛋白(P-gp)[19]是由肿瘤多药耐药基因MDR-1基因编码的跨膜糖蛋白,属于转运蛋白ATP结合盒(ATP-binding cassette, ABC)家族[20]。由于MDR-1的过度表达,导致P-gp增多从而增加药物转运和外排是MDR现象产生的最重要原因[21-23]。部分药物逆转肿瘤细胞耐药性的机制可能与下调MDR1基因表达,减少P-gp蛋白表达及药物外排有关[24]。本研究检测了氯喹处理HNE1/DDP后的MDR1 mRNA的表达,结果显示,氯喹能明显降低MDR1 mRNA水平;并且Western blot结果提示,氯喹处理后鼻咽癌细胞HNE1和HNE1/ DDP的P-gp蛋白水平明显降低。以上结果提示氯喹逆转HNE1/DDP细胞的耐药性可能与氯喹能够使MDR1 mRNA水平下降,从而抑制P-gp蛋白的表达,起到逆转耐药的作用有关。
本研究结果扩展了氯喹新的药理作用,探讨了其新的治疗用途,并对其机制进行了初步的研究。结果提示,氯喹针对鼻咽癌耐药细胞起到了逆转耐药的作用,这为克服鼻咽癌在化疗过程中的耐药提供了新思路。但是,氯喹调控MDR1 mRNA的途径及肿瘤细胞自噬等机制还有待进一步的研究。
| [1] | Mcdermott AL, Dutt SN, Watkinson JC. The aetiology of nasopharyngeal carcinoma[J]. Clin Otolaryngol Allied Sci,2001, 26 (2) : 82-92. DOI: 10.1046/j.1365-2273.2001.00449.x. |
| [2] | Tao Q, Chan AT. Nasopharyngeal carcinoma: molecular pathogenesis and therapeutic developments[J]. Expert Rev Mol Med,2007, 9 (12) : 1-24. |
| [3] | Proceedings of the 7th International Cancer Vaccine Symposium, 1284.Florence, Italy[J].Ann N Y Acad Sci, 2013: 1-86. https://www.ncbi.nlm.nih.gov/pubmed/23908987/ |
| [4] | Bensouda Y, Kaikani W, Ahbeddou N, et al. Treatment for metastatic nasopharyngeal carcinoma[J]. Eur Ann Otorhinolaryngol Head Neck Dis,2011, 128 (2) : 79-85. DOI: 10.1016/j.anorl.2010.10.003. |
| [5] | Kam MK, Leung SF, Zee B, et al. Prospective randomized study of intensity-modulated radiotherapy on salivary gland function in early-stage nasopharyngeal carcinoma patients[J]. J Clin Oncol,2007, 25 (31) : 4873-9. DOI: 10.1200/JCO.2007.11.5501. |
| [6] | Doumbo S, Ongoiba OA, Doumtabe D, et al. Prevalence of Plasmodium falciparum, anemia and molecular markers of chloroquine and sulfadoxine-pyrimethamine resistance in delivered women in Fana, Mali[J]. Bull Soc Pathol Exot,2013, 106 (3) : 188-92. DOI: 10.1007/s13149-013-0301-1. |
| [7] | Zinn RL, Gardner EE, Dobromilskaya I, et al. Combination treatment with ABT-737 and chloroquine in preclinical models of small cell lung cancer[J]. Mol Cancer,2013 : 16. |
| [8] | Yamada H, Takahashi N, Tanno S, et al. A selective orexin-1 receptor antagonist, SB334867, blocks 2-DG-induced gastric acid secretion in rats[J]. Neurosci Lett,2005, 376 (2) : 137-42. DOI: 10.1016/j.neulet.2004.11.043. |
| [9] | 张浩轩, 肖明. 氯喹对鼻咽癌细胞凋亡的影响[J]. 蚌埠医学院学报,2013, 38 (11) : 1396-8. |
| [10] | Amaravadi RK. PUMA: a puzzle piece in chloroquine's antimelanoma activity[J]. J Invest Dermatol,2013, 133 (9) : 2133-5. DOI: 10.1038/jid.2013.135. |
| [11] | Goldsborough AS, Handley MD, Dulcey AE, et al. Collateral sensitivity of multidrug-resistant cells to the orphan drug tiopronin[J]. J Med Chem,2011, 54 (14) : 4987-97. DOI: 10.1021/jm2001663. |
| [12] | Wilson EN, Bristol ML, Di X, et al. A Switch between cytoprotective and cytotoxic autophagy in the radiosensitization of breast tumor cells by chloroquine and vitamin D[J]. Horm Cancer,2011, 2 (5) : 272-85. DOI: 10.1007/s12672-011-0081-7. |
| [13] | Hirata Y, Yamamoto H, Atta MS, et al. Chloroquine inhibits glutamate-induced death of a neuronal cell line by reducing reactive Oxygen species through sigma-1 receptor[J]. J Neurochem,2011, 119 (4) : 839-47. DOI: 10.1111/jnc.2011.119.issue-4. |
| [14] | Cufi S, Vazquez-Martin A, Oliveras-Ferraros C, et al. The antimalarial chloroquine overcomes primary resistance and restores sensitivity to trastuzumab in HER2-positive breast cancer[J]. Sci Rep,2013, 3 : 2469. |
| [15] | Hall MD, Handley MD, Gottesman MM. Is resistance useless? Multidrug resistance and collateral sensitivity[J]. Trends Pharmacol Sci,2009, 30 (10) : 546-56. DOI: 10.1016/j.tips.2009.07.003. |
| [16] | Szakacs G, Paterson JK, Ludwig JA, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov,2006, 5 (3) : 219-34. DOI: 10.1038/nrd1984. |
| [17] | Ambudkar SV, Dey S, Hrycyna CA, et al. Cellular, and pharmacological aspects of the multidrug transporter[J]. Annu Rev Pharmacol Toxicol,1999, 39 : 361-98. DOI: 10.1146/annurev.pharmtox.39.1.361. |
| [18] | Deuchars KL, Ling V. P-glycoprotein and multidrug resistance in cancer chemotherapy[J]. Semin Oncol,1989, 16 (2) : 156-65. |
| [19] | Laberge RM, Ambadipudi R, Georges E. P-glycoprotein mediates the collateral sensitivity of multidrug resistant cells to steroid hormones[J]. Biochem Biophys Res Commun,2014, 447 (4) : 574-9. DOI: 10.1016/j.bbrc.2014.04.045. |
| [20] | Yan F, Jiang Y, Li YM, et al. Reversal of P-glycoprotein and multidrug resistance-associated protein 1 mediated multidrug resistance in cancer cells by HZ08 Isomers, tetrataisohydroquinolin derivatives[J]. Biol Pharm Bull,2008, 31 (6) : 1258-64. DOI: 10.1248/bpb.31.1258. |
| [21] | Nobili S, Landini I, Mazzei T, et al. Overcoming tumor multidrug resistance using drugs able to evade P-glycoprotein or to exploit its expression[J]. Med Res Rev,2012, 32 (6) : 1220-62. DOI: 10.1002/med.2012.32.issue-6. |
| [22] | Lorendeau D, Dury L, Genoux-Bastide E, et al. Collateral sensitivity of resistant MRP1-overexpressing cells to flavonoids and derivatives through GSH efflux[J]. Biochem Pharmacol,2014, 90 (3) : 235-45. DOI: 10.1016/j.bcp.2014.05.017. |
| [23] | Pluchino KM, Hall MD, Goldsborough AS, et al. Collateral sensitivity as a strategy against cancer multidrug resistance[J]. Drug Resistance Updates,2012, 15 (1/2, SI) : 98-105. |
| [24] | 王培培, 许杜娟, 黄灿, 等. 黄芪皂苷Ⅱ对人肝癌多药耐药细胞BEL-7402/FU的逆转耐药作用[J]. 中国临床药理学与治疗学,2014, 19 (2) : 139-44. |
 2015, Vol. 35
2015, Vol. 35
